Ioniske elektrolytter
vand og andre polære molekyler tiltrækkes af ioner, som vist i figur \(\Sideindeks{2}\). Den elektrostatiske tiltrækning mellem en ion og et molekyle med en dipol kaldes en ion-dipol attraktion. Disse attraktioner spiller en vigtig rolle i opløsningen af ioniske forbindelser i vand.
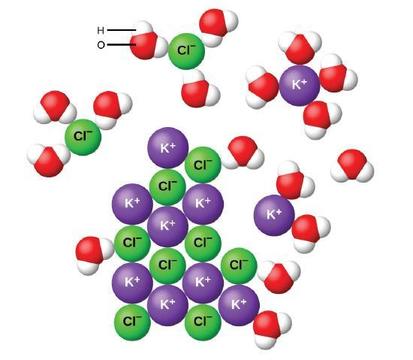
når ioniske forbindelser opløses i vand, adskilles ionerne i det faste stof og spredes ensartet gennem opløsningen, fordi vandmolekyler omgiver og solverer ionerne, hvilket reducerer de stærke elektrostatiske kræfter mellem dem. Denne proces repræsenterer en fysisk ændring kendt som dissociation. Under de fleste forhold vil ioniske forbindelser dissociere næsten fuldstændigt, når de opløses, og derfor klassificeres de som stærke elektrolytter.
lad os overveje, hvad der sker på mikroskopisk niveau, når vi tilføjer fast KCl til vand. Ion-dipolkræfter tiltrækker den positive (hydrogen) ende af de polære vandmolekyler til de negative chloridioner ved overfladen af det faste stof, og de tiltrækker de negative (ilt) ender til de positive kaliumioner. Vandmolekylerne trænger ind mellem individuelle K+− og Cl-ioner og omgiver dem, hvilket reducerer de stærke indre kræfter, der binder ionerne sammen og lader dem bevæge sig ud i opløsning som solvated ioner, som figur viser. Reduktionen af den elektrostatiske tiltrækning tillader den uafhængige bevægelse af hver hydreret ion i en fortyndet opløsning, hvilket resulterer i en stigning i systemets forstyrrelse, når ionerne skifter fra deres faste og ordnede positioner i krystallen til mobile og meget mere uordnede tilstande i opløsning. Denne øgede lidelse er ansvarlig for opløsningen af mange ioniske forbindelser, herunder KCl, som opløses med absorption af varme.
i andre tilfælde er de elektrostatiske attraktioner mellem ionerne i en krystal så store, eller ion-dipolens attraktive kræfter mellem ionerne og vandmolekylerne er så svage, at stigningen i forstyrrelse ikke kan kompensere for den energi, der kræves for at adskille ionerne, og krystallen er uopløselig. Dette er tilfældet for forbindelser såsom calciumcarbonat (kalksten), calciumphosphat (den uorganiske komponent i knogler) og jernilte (rust).