Dimethyl Sulfoxide Oxidations
Dimethyl sulfoxide-based oxidation of primary alcohols to aldehydes or secondary alcohols to ketones is a mild method that does not depend upon heavy metal oxidants. Here is a brief, chronological history of the procedure.
Index:
-
Swern Oxidation (trifluoroacetic anhydride)
-
Swern Oxidation (oxalyl chloride)
Kornblum Oxidation: (1959) en primær tosylat opvarmes ved 150o at forårsage SN2 forskydning af ilt af dimethylsulfoksid (DMSO) i nærvær af NaHCO3. Den accepterede mekanisme på det tidspunkt var en E2-eliminering som vist. Dimethylsulfid (DMS) er reduktionsproduktet af reaktionen. Dette arbejde dannede tosylatet fra alkyliodidet med sølvtosylat. Formentlig kan tosylat fremstilles ud fra alkoholen, som er en mere direkte rute. Ulempen ved proceduren er den forhøjede temperatur, selvom kontakttiden kun er et par minutter. Det væsentlige spørgsmål er at finde en metode til at generere sulfenatsaltet.

Barton modifikation: (1964) Barton og kolleger var i stand til at generere sulfenatsalte ved at behandle alkylchloroformater med DMSO med tab af CO2. Tilsætning af triethylamin genererer iltningsproduktet. Denne procedure forbedrede de hårde betingelser for Kornblum-proceduren. Desuden er chloroformatet let tilgængeligt ved behandling af den alkohol, der skal iltes med overskydende fosgen.

Moffatt: (1963) denne variant af en dimethylsulfilte-baseret iltning blev udviklet ved Synteks. Aktivatoren fremstilles ved protonation af dicycloheksylcarbodiimid (1, DCC), som angribes af dimethylsulfoksid. Intermediate 2 protoneres igen for at lette tilsætning af alkoholens ilt på svovlatomet. Stabil dicycloheksylurinstof 4 dannes sammen med sulfenatsalt 3. Denne art lider sammenbrud til carbonylforbindelsen under påvirkning af dihydrogenphosphatanionen. Selvom fosforsyre er en effektiv syrekatalysator til denne reaktion, er svovlsyre, hydrogenchlorid og trifluoreddikesyre ikke. Imidlertid er pyridiniumtrifluoracetat en effektiv katalysator. Det er kritisk, at den konjugerede base af syren er basisk nok til at påvirke det sidste trin i reaktionen.

Torrsell Mechanism: (1966) den svenske kemiker Torrsell demonstrerede, at mekanismen for disse DMSO-baserede iltninger ikke fortsætter via en intermolekylær kur-eliminering. Elimineringen er en intramolekylær proces. Sulfenatsalt 5 blev fremstillet ved Moffatt-Pfitsner-proceduren (se ovenfor). Hvis Kornblum-mekanismen skulle anvendes, ville det opnåede dimethylsulfid være blottet for deuterium (eksperiment 1). Imidlertid blev dimethylsulfid-d1 (7) opnået. Dette resultat er i overensstemmelse med en base, der deprotonerer methylgruppen bundet til svovldannende ylid 6. Ylid nedbrydes ved intramolekylær deprotonation for at producere de observerede produkter.
eksperiment 1:

for at bekræfte denne mekanisme blev deuterium inkorporeret i DMSO som DMSO-d6. Følgelig frembragte reaktionen dimethylsulfid-d5 (12) og ufortyndet aldehyd 11 (eksperiment 2).
eksperiment 2:

Parikh-Doering iltning: (1967) denne iltning anvender pyridin svovltrioktekomplekset (13) som aktivator af dimethylsulfilte. Sulfat er den forlader gruppe i forskydningen af alkoholen (primær eller sekundær) i mellemprodukt 14. Sulfenat 15 nedbrydes af den intramolekylære mekanisme (vide supra) for at give et aldehyd eller keton.

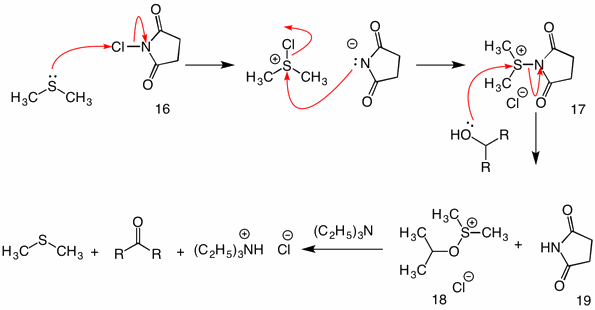
Corey-Kim: (1972) i denne procedure aktiveres dimethylsulfid (iltet) med N-chlorsuccinimid (16) for at tilvejebringe reagens 17. I reaktionen af denne art med en alkohol fungerer succinimidylgruppen som en forlader gruppe. Det sædvanlige sulfenat mellemprodukt 18 kollapser af den intramolekylære mekanisme ved tilsætning af triethylamin.
(1976) denne tidlige Oksidering anvender trifluoreddikeanhydrid (20) at-50oc for at aktivere dimethylsulfoksid. Tilsætning af alkoholen til mellemprodukt 21 giver det ønskede sulfenat 22. Ketonen eller aldehydet fremstilles på sædvanlig måde med triethylamin.

(1978) denne senere Svingprocedure er en bekvem metode til fremstilling af reagens 24 uden anvendelse af dimethylsulfid og chlor. Dimethylsulfilte, som er på samme iltningsniveau som salt 24, reagerer med oksalylchlorid (23) for at frigøre kulilte, kulilte og reagens 24. Tilsætning af den primære eller sekundære alkohol efterfulgt af deprotonation af sulfenat 25 med triethylamin fører til henholdsvis det ønskede aldehyd eller keton.
