- protokoller
- Hybridomaproduktion
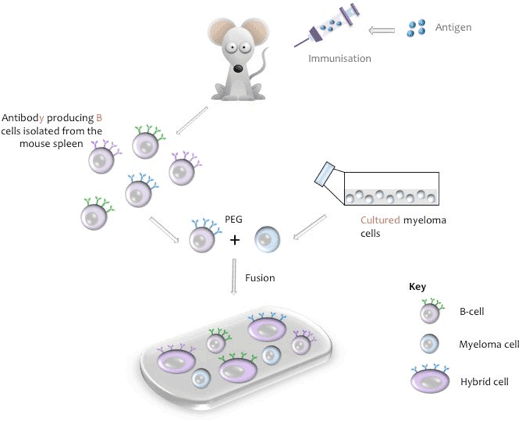
- skematisk repræsentation af cellefusion
- nødvendigt udstyr
- medium og andre reagenser (se tillæg A for flere detaljer)
- før du starter (Se bilag A for flere detaljer)
- optøning og vækst af myelomcellerne
- fusionsprocessen
- tre dage før – Forbered myelomcellerne til fusionen
- en dag før – forbered mediet
- fusionsdagen
- dag efter fusionen
- tillæg i
protokoller
Hybridomaproduktion
et hybridom er en cellelinie, der stammer fra en hybridcelle, der er i stand til permanent at udskille et monoklonalt antistof, der er specifikt for en epitop af dit antigen i kultur. Hybridcellen produceres ved fusion af specifikt antistof, der producerer B-celle fra et immuniseret dyr (normalt en mus, rotte eller kanin), og som har en endelig levetid med en celle fra en “udødelig” dyrket myelomcellelinie (f.eks. mus NS-1 eller NS-0).
produktion af en musehybrid celle
under fusionsprocessen isoleres B-celler fra musemilten, blandes med musemyelomacellelinjen, og fusion induceres med polyethylenglycol (PEG, se tillæg i). (Den relevante myelomlinie anvendes, når der anvendes B-celler fra andre dyrearter). De resulterende hybridomer dyrkes derefter i vævskulturmedium indeholdende Hypoksathin, Aminopterin, thymidin (HAT), et trin, der dræber eventuelle ikke-anvendte myelomceller, der kan vokse ud af de andre svagere hybridomaceller. Ufuserede B-celler har begrænsede opdelingsevner og vil dø naturligt i kultur. Ti dage efter fusionsprocessen opsamles kultur supernatant og testes for tilstedeværelsen af det ønskede antistof.
skematisk repræsentation af cellefusion
nødvendigt udstyr
- et sterilt miljø til fremstilling og håndtering af celler (laminær strømning eller klasse II kabinet)
- en inkubator indstillet til 37 liter, med 5% CO2 og fugtighed på 95%
- et omvendt mikroskop
- et 37 liter vandbad, der kan placeres i kabinettet
- en centrifuge med en svingende rotor
- sterile dissekeringsinstrumenter-ideelt to sæt-hver bestående af to par saks og tang (en buet og en stump ende).
- 75 ml væv Corning kultur kolber-Ref. 15430641
- 24 brønd Falk plader-Ref. 353047
- Sterile pipetter
- Pipettefyldstof
- Sterile pasteurpipetter
- en timer
medium og andre reagenser (se tillæg A for flere detaljer)
- RPMI 1640 bikarbonatbufret, med L-Glutamin (Lone Ref. BE12-702F)
- RPMI 1640 Hepes bufret, uden L-Glutamin
- god kvalitet (batch testet) føtalt bovint Serum (Genycell Ref. GCS0101-500)
- Penicillin / Streptomycin (Gibco Ref. 15070-063)
- Ultroser G (Pall Ref. 15950-017)
- HAT (Hypoksathin, Aminopterin, thymidin) (Gibco Ref. 21060-017)
- pind 1500 (Roche Ref. 10783641001)
før du starter (Se bilag A for flere detaljer)
- lav 500 ml af A
- lav 500 ml medium a+
- lav 100 ml medium B
- lav 100 ml medium C
- lav 500 ml medium D
optøning og vækst af myelomcellerne
optø myelomcellelinjen og vokse i medium A. Brug følgende metode til at optø og dyrke myelomcellelinjen.
- fjern det frosne hætteglas med myelomceller fra LN2-lageret.
- Placer cellerne i et 37 liter vandbad.
- Opbevar låget på frysehætteglasset over vandoverfladen for at mindske risikoen for kontaminering.
- når cellerne næsten er optøet (kun en lille del af isrester) flyttes til vævskulturhætten.
- tør hætteglassets yderside af med 70% ethanol, og fjern toppen.
- fjern forsigtigt cellesuspensionen ved hjælp af en steril Pasteur-pipette.
- overfør indholdet til et centrifugerør indeholdende 10 ml medium a (se tillæg A)
- drej cellesuspensionen forsigtigt ved 300 g i 5 minutter.
- Fjern supernatanten og opbland cellerne i 10 ml frisk medium A og læg dem i en lille (25cm2) kolbe.
- Tag 1 ml af suspensionen fra den originale kolbe og føj til en anden med 9 ml medium A. Dette sikrer, at hvis koncentrationen i den første kolbe er for høj, er en anden (lavere) koncentration af celler tilgængelig.
- sæt kolberne i CO2-inkubatoren. Husk at lade kolbe låg være let åbne for at tillade gasudveksling.
fusionsprocessen
tre dage før – Forbered myelomcellerne til fusionen
myelomcellerne skal være i eksponentiel vækstfase, når du bruger dem, og dette har brug for erfaring. Men hvis du opretter to 75 cm2 kolber af dine myelomceller, en ved en fortynding på 1:40 og en på 1:60 (se nedenfor), 3 dage før fusionen skal en af kolberne være ideel på fusionsdagen. (Oprindeligt opsætning af yderligere kolber ved fortyndinger over og under dem, der er givet her, skal give dig den nødvendige erfaring bedøm væksten i myelomcellerne til efterfølgende fusioner).
en dag før – forbered mediet
følgende skal laves og forvarmes til 37 liter (du kan sætte dem i din inkubator natten over).
- to * 200ml medium A+ i to 75cm2 kolber
- 100ml medium B
- 100ml medium C
- 1h4ml PEG 1500 overført til en folie indpakket (PEG er lysfølsom) steril universal
- a mini vandbad, lavet af et 200 ml bægerglas indeholdende ca. 100 ml destilleret vand og krydset med tape, der er bredt nok til, at der er en åbning til at holde et 50 ml Falcon-rør lodret
fusionsdagen
- dræb musen (efter institutionelle retningslinjer), træk milten ud og læg den i en steril beholder indeholdende 5 ml medium C.
- alle efterfølgende trin skal udføres i en laminær strømningshætte.
- læg milten og mediet i en petriskål.
- Flyt milten med sterile tang for at vaske den. Fjern eventuelle adhæsioner og overfør milten til en anden petriskål
- skær milten i to. Hold den ene halvdel med stump tang, og brug et andet par buede tang, ret forsigtigt cellerne ud fra miltkapslen, og pas på at fjerne så mange celler som muligt. Gentag med anden halvdel af milten
- Fjern miltkapselrester, og bland cellerne godt, men meget forsigtigt, ved hjælp af en steril Pasteur-pipette.
- Overfør cellesuspensionen til et 15 ml rør og brug yderligere 5 ml medium C til at skylle petriskålen og tilføje til miltcellerne i røret.
- tæl myelom og miltceller.
- du har brug for et forhold på 1 myelomcelle til hver 10 miltceller
- Tilføj myelomcellerne til et 50 ml konisk rør.
- centrifuger både miltcellerne (15 ml rør) og myelomcellerne i (50 ml rør) til 300 g i 10 minutter.
- hæld supernatanten af begge rør meget forsigtigt og opbland forsigtigt pellets hver i 10 ml medium B. fraværet af FBS, indtil fusionsprocessen er afsluttet, er ekstremt vigtigt, da celler ikke smelter, hvis der er FBS til stede)
- kombiner den resuspenderede miltcelle og myelompellets i et 50 ml centrifugerør.
- Centrifuge i 5 minutter ved 300g.
- hæld meget forsigtigt så meget supernatant som muligt.
- Opbland pillen ved at trykke let på røret på bænken. Flick ikke pelleten eller pipette den, da dette vil distribuere celler op omkring røret, hvilket reducerer cellenumre, der er tilgængelige til fusion.
- Placer røret i det hjemmelavede vandbad.
- tilsæt 1,2 ml pind dråbe for dråbe over et minut, omrør forsigtigt hvert par dråber.
- tilsæt 1 ml medium B, dråbe for dråbe over et minut, omrør forsigtigt hvert par dråber.
- tilsæt yderligere 2 ml medium B, dråbe for dråbe over to minutter, omrør forsigtigt hvert par dråber.
- tilsæt yderligere 4 ml medium B, dråbe for dråbe over fire minutter, omrør forsigtigt hvert par dråber.
- i slutningen af tiden tilsættes 8 ml medium C.
- centrifuger cellerøret i 5 minutter 300g.
- dekanter supernatanten meget omhyggeligt og opbland cellepelleten i 1 minut med 10 ml medium a+. For at gøre dette skal du tilføje et par ml af mediet for at begynde at bryde pelleten op. Sug disse klumper af celler meget forsigtigt op og bevæg dig op og ned i pipetten. Udvis disse celler og gentag processen. Vær meget blid, tving ikke pelleten fra hinanden, du kan have små klumper af celler, når du er færdig. Cellerne er ekstremt skrøbelige på dette stadium.
- sæt 10 ml resuspenderet fusionsblanding i 190 ml varmt medium A+
- det endelige volumen er 200 ml
- sæt 1 ml af denne suspension i hver brønd på 8 * 24 brøndplader (2 ml). (192 brønde i alt)
- lad pladerne stå i inkubatoren natten over (cirka 24 timer).
dag efter fusionen
- Tilføj 8 ml HAT i 200 ml medium a+.
- læg 1 ml af dette selektive medium i hver brønd på de 8 plader.
- lad pladerne være i inkubatoren. Kolonierne vises mellem 7 til 10 dage

tillæg i
dyrkningsmedium a:
RPMI 1640 medium med L-Glutamin (bikarbonatbufret) (Lone Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100u/ml)/Streptomycin (100 mg/l) (Gibco Ref. 15070-063)
Kulturmedium A+:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
Culture Medium B (no FBS):
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium C:
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium D:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
+ HAT (Hypoxathine, Aminopterin, Thymidine) supplement which is usually 50X (dilute 10ml in 500mls of medium) (Gibco Ref. 21060-017)