- plasticitet af Vsmc ‘er i fysiologi og sygdom
- Vsmc ‘ er påvirker Adventitiaimmunresponser hos hyperlipidemiske mus
- aldring eller kronisk eller begge dele?
- nydannede Adventitiastrukturer deltager i atlo-funktion ved at fremme Lymfocytrecirkulation
- Atlo-dannelse er stærkt Territorialiseret, hvilket indikerer, at signaler transmitteres fra plaketter til Adventitia via lymfoide Vævsarrangørlignende Vsmc ‘ er
- Vsmc ‘er bidrager direkte til Adventitiaimmunitet ved åreforkalkning
- konklusion
- Forfatterbidrag
- finansiering
- interessekonflikt
plasticitet af Vsmc ‘er i fysiologi og sygdom
vaskulære glatte muskelceller (Vsmc’ er) er de vigtigste bestanddele af mellemstore og store arterier. Selvom mekanismer for atherogenese stort set stadig skal defineres, har undersøgelser vist, at sygdomsprogression involverer krydstale mellem immunceller med både ECs og Vsmc ‘ er. Nogle af disse interaktioner fremmer plakvækst, mens andre dæmper størrelsen, den cellulære sammensætning og stabiliteten af aterosklerotisk plak (1, 2) (Figur 1, Tabel 1). Vsmc ‘ er viser bemærkelsesværdig plasticitet som reaktion på vaskulær skade, betændelse og lipoproteinakkumulering under sygdomsprogression via omprogrammering af genekspression og et skift til en proliferativ, Pro-migrerende og aktiveret fænotype, dvs.fænotypeskift (5). I Figur 1, vi skildrer kritiske molekylære omskiftere, der er blevet foreslået at være vigtige regulatorer for sygdomsprogression (3, 6, 8, 11). Under aterosklerose initiering, blod-afledte monocytter, som er blevet rekrutteret i intima, akkumulere lipid giver dem en skummende udseende. Disse skumceller bidrager til dannelse af fedtstriber, som udgør det tidligste og muligvis reversible stadium af aterosklerotisk plak. Fede striber udvikler sig gradvist til atheromer/plaketter, der i sidste ende fører til ekspanderede plaketter, der indeholder Vsmc ‘ er, T-celler og myeloide celler (Figur 1) (33). Interessant nok bestemmer sammensætningen af en aterosklerotisk plak snarere end dens størrelse dens stabilitet, da fibrøs hættetykkelse og nekrotisk kernestørrelse er potentielle kendetegn for henholdsvis en stabil vs. en ustabil plak (4, 9). Vsmc ‘ er i intima-laget betragtes traditionelt som gavnlige under atherogenese, fordi de producerer ekstracellulære matrikskomponenter og derved fremmer dannelsen af stærkere fibrøse hætter, hvilket resulterer i beskyttelse mod plakbrud (4, 9). Det er i stigende grad tydeligt, at Vsmc ‘ er gennemgår en overflod af strukturelle og funktionelle fænotypiske transformationer og endda helt kan miste deres oprindelige træk for at erhverve egenskaber ved andre celletyper, herunder makrofager. Data indikerer, at Vsmc ‘ er kan erhverve dikotomiske fænotyper med en Janus-hovedtype, dvs.pro – vs. anti-atherogene egenskaber, afhængigt af vævsmiljøet og virkningen af risikofaktorer (3). Vsmc ‘ er frigiver cytokiner for at stimulere tilstødende ECs til at udtrykke adhæsionsmolekyler og frigive cytokiner og/eller forbedre kemotaksen af monocyt/makrofager i plakken (3, 34, 35) (tabel 1). Disse data indikerer, at akkumulering af Vsmc ‘er i den fibrøse hætte eller intima er gavnlig, hvorimod deres tab eller overgang til en inflammatorisk fænotype er skadelig, og at balancen mellem vsmc’ er proliferation/migration vs. død/aldring bestemmer atheroprogression vs. plakstabilitet (3). Forskellige yderligere aspekter af VSMC biologi i sundhed og sygdom blev for nylig dækket af en række fremragende anmeldelser (https://academic.oup.com/cardiovascres/issue/114/4) og vil ikke blive dækket her. Under, Vi fokuserer derfor opmærksomheden på adventitiens rolle og den potentielle indvirkning af Vsmc ‘ er i ATLO-dannelse.

Figur 1. Fænotyper af Vsmc ‘ er under aterosklerose progression afslører ekstraordinær plasticitet. ECs og Vsmc ‘ er i aterosklerotisk plak viser aktiverede fænotyper (3, 4). Nogle af Vsmc ‘ erne stammer fra medierne efter rekruttering til intima; andre Vsmc ‘ er kan være knoglemarvsafledte, eller de kan stamme fra myeloide celler i cirkulationen (3). En brøkdel af Vsmc ‘ er prolifererer ( ^ ) (3, 5). Vsmc ‘ er udskiller ekstracellulære matrikskomponenter; den pluripotente transkriptionsfaktor, dvs. Klf4, kan spille store roller i en proces kaldet fænotypeskift (mam) (6, 7). I forsøg på at beskytte den aterosklerotiske plak mod dødelig brud, Oct4 kan kontrollere en proces, der er blevet betegnet remigration til dannelse af en fibrøs hætte (gt) (4, 8-10). Senescens og apoptose udløser dannelsen af yderligere inflammatoriske cytokiner til dannelse af en nekrotisk kerne, der indleder en ond cirkel med dødelige kliniske konsekvenser i de sene stadier af sygdommen (KTI) (3, 4, 11).
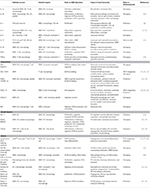
tabel 1. Vigtige inflammatoriske mediatorer involveret i VSMC-medieret aterosklerose immunitet.
Vsmc ‘ er påvirker Adventitiaimmunresponser hos hyperlipidemiske mus
i løbet af de sidste to årtier blev det mere og mere tydeligt, at adventitia er et meget komplekst og immunologisk aktivt væv, der huser celler så forskellige som stromaceller, nerver, lymfekar, vasa vasora og residente leukocytter/stamceller, som alle har evnen til at påvirke sygdomsfremskridt (36, 37). Vi observerede, at adventitia af ApoE – / – mus gennemgår store omstruktureringshændelser i alle stadier af aterosklerose: Både medfødte og adaptive immunceller akkumuleres ved siden af de nærliggende aterosklerotiske plakker (figur 2). Desuden blev vores undersøgelser i eksperimentelle mus bekræftet i humane syge arterier: vi og andre observerede ATLO-lignende strukturer i adventitia hos patienter, der præsenterede med aterosklerotiske aortaaneurismer (38, 39) og for nylig, Akhavanpoor et al. observeret veludviklet ATLOs i adventitia af en betydelig procentdel af patienter ramt af iskæmisk hjertesygdom (40). I murine aterosklerose, lymfekar -, høj endotel venule (HEV) – og blodkar neogenese er fremtrædende træk ved denne omstruktureringsproces (16, 41).
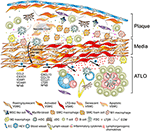
figur 2. Vaskulære glatte muskelceller (VSMC) deltager i adventitiaimmunitet under dannelse af plak. Vsmc ‘ er, der er klemt inde mellem aterosklerotisk plak og adventitia, adopterer en lymfoid vævsarrangørlignende fænotype efter aktivering via plakafledte signaler (IV) og transdifferentierer derefter til LTO-lignende celler (IV). Ved hjælp af deres proliferative og cytokinudtrykkende fænotype påvirker de omstruktureringen og skulpturen af adventitia, herunder angiogenese, hev-dannelse og lymfekar neogenese ( ^ ). Fænotypeskift resulterer også i ekspression og sekretion af lymforganogene kemokiner, dvs.CKSCL13 og CCL21, hvorved der fremmes ATLO-dannelse afbildet skematisk i den nederste del af grafen (lt).
aldring eller kronisk eller begge dele?
det er vigtigt, at aldring viste sig at være en vigtig determinant for adventitia omstrukturering og skulptur. Fuldt udviklet ATLOs-form under avancerede stadier af aterosklerose, men deres tidlige stadier, dvs. T / B-celleaggregater, fremkommer parallelt med dannelsen af aterosklerotisk plak (16, 27, 41, 42). Faktisk dannes disse tidlige ATLOs i en alder af ~30 uger og når mere avancerede stadier omkring 52 uger for at toppe ved 78 uger (16, 41). Lignende aldersafhængige udviklingsstadier af tlo ‘ er er blevet observeret i andre kroniske uløselige sygdomme (1, 42). Disse data indikerer, at ATLO-udvikling er aldersafhængig, og aldring er positivt forbundet med adventitial skulptur (figur 2). Forholdet mellem aldring og kronicitet er imidlertid vanskeligt at studere i Murin aterosklerose, da aterosklerotisk plakudvikling begynder i aortabuen og derefter rejser sået aorta for at nå abdominal aorta ved senere sygdomsstadier, hvilket tager længere perioder. Der er behov for mere arbejde for at afklare det vigtige spørgsmål, om immuncelle-og/eller VSMC-senescens bidrager til ATLO-dannelse, og hvilke celletyper, dvs., Vsmc ‘ er, ECs og/eller immunceller er involveret. Undersøgelser i andre former for tlo-dannelse, såsom dem, der forekommer i lungen og mave-tarmkanalen, ville indikere, at det er kroniciteten af en vedvarende inflammatorisk vævsreaktion snarere end bona fide aldringshændelser i immunsystemet, der afgørende bidrager til dannelsen af ATLOs (43, 44).
nydannede Adventitiastrukturer deltager i atlo-funktion ved at fremme Lymfocytrecirkulation
avancerede ATLO-stadier inkluderer T/B-celleaggregater, germinale centre inden for aktiverede B-cellefollikler, lymfekar, HEV ‘ er i T-celleområder og ekstracellulære ledningsnetværksværker (16). Disse store ændringer ligner strukturer, der minder om dem, der findes i sekundære lymfoide organer, hvor de fremmer grundlæggende aspekter af immunresponser mod antigen, herunder recirkulation af Na-larvelymfocytter for at finde deres kognitive antigener/autoantigener og organisere affinitetsmodning af B-celler mod potentielle autoantigener. Ved hjælp af adoptiv lymfocytoverførselsundersøgelser observerede vi, at ATLOs i høj grad forbedrer lymfocytrekruttering i arterievæggen ved både at fremme indvandring og samtidig dæmpning af udvandring af antigen-uerfarne lymfocytter (27). Efter deres rekruttering aktiveres T-celler, begynder at proliferere, og nogle af CD4 T-hjælpercellerne omdannes til inducerede t-regulatoriske celler. Disse data afslører, at immunsystemet i adventitia er meget lydhør over for den underliggende inflammatoriske vævsreaktion i arterievæggen. Desuden ser B-celler, der danner germinale centre i aktiverede B-cellefollikler, ud til at gennemgå en germinal center-reaktion i nærvær af follikulære dendritiske celler, hvor nogle omdannes til hukommelse B-celler, mens andre forlader germinale centre for at blive plasmaceller (45). Når de tages sammen, indikerer disse data, at ATLOs snarere end sekundære lymfoide organer (som tidligere antaget) organiserer aterosklerose immunitet.
Atlo-dannelse er stærkt Territorialiseret, hvilket indikerer, at signaler transmitteres fra plaketter til Adventitia via lymfoide Vævsarrangørlignende Vsmc ‘ er
et andet aspekt af adventitia-omstrukturering under atherogenese er, at ATLO-dannelse er stærkt territorialiseret, idet den stort set er begrænset til adventitia-segmenter ved siden af aterosklerotisk plak i abdominal aorta hos mus (16, 45). ATLOs findes kun lejlighedsvis i adventitia af innominatarterien eller af aortabuen, hvor aterosklerose er mest fremtrædende. Immunceller i aortas thorakale segmenter er hovedsageligt sammensat af T-celleaggregater sammenlignet med ATLOs i abdominal aorta (16, 41). Den nøjagtige mekanisme for territorialitet af Atlosdannelse i abdominal aorta er stadig ukendt. Tlo ‘ er ser ud til at være et træk ved mange kroniske uløselige inflammatoriske sygdomme og er fremtrædende kendetegn ved autoimmune sygdomme (42). Cellulariteten og strukturerne af TLOs i aterosklerose ligner TLOs i mange andre kroniske sygdomme, herunder kræftassocieret tlo-dannelse (46, 47). Feltet tlo biologi har dramatisk udvidet i de senere år, hvilket øger den vigtige mulighed for, at nyt terapeutisk mål kan identificeres via forståelse af TLO ‘ s funktion i hver af TLO-associerede sygdomme. Imidlertid afslører de forskellige typer tlo ‘ er nogle sygdomsspecifikke træk, som i sidste ende kan afgøre, om de tilknyttede immunresponser er skadelige eller beskyttende. Sådanne sygdomsspecifikke egenskaber opstår muligvis gennem en af flere mekanismer, herunder organspecificitet og arten af vævsskade (1, 42). Udviklingen af lymfoide organer er en kompleks proces, der involverer hæmatopoietiske lymfoide vævsinducerende celler (LTi), ikke-hæmatopoietiske stromale lymfoide vævsarrangørceller (LTo) og lt-larr-signalering. Vores in vitro-undersøgelser af mus aorta Vsmc ‘ er viste, at de efter passende stimulering kan tjene som LTO-lignende celler (20), oprindeligt identificeret under embryonal udvikling under dannelsen af sekundære lymfoide væv inklusive lymfeknuder og milt (48, 49) (se nedenfor). Det er vigtigt at bemærke, at Atlo ‘er ser ud til at involvere Vsmc’ er som vigtige deltagere, mens andre tlo ‘ er involverer andre LTO-lignende mesenkymale celler (50). Fællesnævneren for alle former for TLOs synes imidlertid at være–i modsætning til sekundære lymfoide organer–en kronisk inflammatorisk vævsreaktion, der driver immunsystemet til at danne disse lymfoide strukturer tæt på eller i nogle tilfælde inden for det syge væv (42, 43).
Vsmc ‘er bidrager direkte til Adventitiaimmunitet ved åreforkalkning
i betragtning af den stærkt territorialiserede karakter af ATLOs, der støder op til aterosklerotisk plak, begrundede vi, at Vsmc’ er kan være involveret i ATLO-dannelse og på samme måde kan indtage en funktionel rolle i ateroskleroseprogression. Vsmc ‘ er udtrykker i høj grad lt LRR konstitutivt (16), mens dets ligand Lta1-LR2 udtrykkes på forskellige immunceller betegnet LTi-celler (51). Vsmc ‘ er antages at blive aktiveret gennem lt larr-LT signalvejen af LTi-celler involveret i sekundær lymfoid vævsneogenese. Oprindelsen af LTI-celle er endnu ikke klart bestemt, selvom aktiverede makrofager og andre immunceller i intima-plaketten er kandidater til denne aktivitet i LTO-neogenese. Som reaktion på cellulære og opløselige mediatorer ser Vsmc ‘ er ud til at gennemgå en særskilt type fænotype, der skifter til en LTo-lignende fænotype ved parakrinsekretion af de lymforganogene kemokiner, dvs.CKSCL13 og CCL21, hvorved immunceller, f. eks. makrofager/dendritiske celler, T-celler og B-celler tiltrækkes til det lokale adventitia-miljø, der fører til dannelse af ATLO i adventitia (27, 41, 45) (tabel 1). Global eller VSMC-specifik mangel på lt-Cholr hos ældre hyperlipidemiske APOE – / – mus viste øget dannelse af aterosklerotisk plak, hvilket indikerer, at VSMC lt-Cholr har evnen til at dæmpe udviklingen af aterosklerose under nogle eksperimentelle betingelser (27). Andre undersøgelser viste imidlertid, at unge globale ApoE−/− LTbR−/−mus, der blev opretholdt under en fedtfattig diæt (HFD), afslørede en lavere aortaplakkebyrde end deres normale diætfodrede ApoE-/− modstykker (52). Disse tilsyneladende modstridende data indikerer, at rollen af LT Kurtr hos unge mus og under betingelser med overdreven hyperlipidæmi kan være forskellig i de to modeller. Alternativt kan den fedtholdige diæt, der fører til dramatiske og muligvis berusende niveauer af plasmalipider, være ansvarlig for disse forskelle. Da vi ikke regelmæssigt bruger en fedtfattig diæt i ApoE – / – mus, forbliver disse uoverensstemmelser uløste problemer, selvom det har vist sig, at immunsystemet kan blive overvældet af ekstreme niveauer af plasmalipider . Disse data kræver yderligere undersøgelser for at undersøge det molekylære grundlag for den tilsyneladende dikotomi af LT-larr i aterosklerose progression hos unge vs. ældre mus og/eller tidlig vs. avanceret aterosklerose. Desuden kan knoglemarvsafledte makrofager fungere som lt-Lti-uafhængige LTI-celler og udløse ekspressionen af CCL19, CCL20 og CKSC16 af VSMCs (53) (tabel 1). Således kan Vsmc ‘ er deltage i dannelsen af TLOs i aterosklerose ved opregulering af lymforganogene kemokiner for at fremme immuncelleaggregater i adventitia. Som nævnt ovenfor er ATLOs almindelige hos mennesker belastet af iskæmisk koronar hjertesygdom (40) og hos humane aterosklerotiske aortaaneurismer (38, 39). Når det tages sammen, forekomsten af ATLOs i eksperimentelle mus og i human aterosklerose rejser vigtige spørgsmål vedrørende arten af aterosklerose som en autoimmun sygdom: det er tænkeligt, at der under atherogenese genereres autoimmune T-celler og autoimmune B-celler rettet mod endnu ikke identificeret autoantigener. Isolering af sådanne autoimmune lymfocytter inklusive sekventering af deres T-cellereceptorer og/eller B-cellereceptorer ville gøre det muligt at teste større hypoteser ved åreforkalkning. Faktisk ville ateroskleroseforskning gennemgå et stort skift, og testning af individuelle autoimmune lymfocytkloner i funktionelle in vitro-og in vivo-systemer ville blive mulig.
konklusion
aterosklerose er en inflammatorisk sygdom i arterier. Vsmc ‘ er kommunikerer med både ECs og immunceller i aterosklerotisk plak og residente celler i adventitia. Denne evne gør det muligt for Vsmc ‘ er at påvirke aterosklerose immunitet på store måder, herunder dannelsen af ATLOs. Der kræves yderligere arbejde for at afgrænse rollen som Vsmc ‘ er i forskellige stadier af åreforkalkning, bestemme deres rolle i unge vs. aldrende arterier og belyse yderligere deres dikotomiske roller i sygdomsprogression. En bedre forståelse af disse processer kan åbne vejen for at udvikle terapeutiske strategier for fremtidig intervention i klinisk vigtige sene stadier af sygdommen.
Forfatterbidrag
alle forfattere bidrog til design, skrivning og redigering af det indsendte manuskript og godkendte det til offentliggørelse.
finansiering
interessekonflikt
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
4. Clarke MC, Figg N, Maguire JJ, Davenport AP, Goddard M, Lilletræ TD et al. Apoptose af vaskulære glatte muskelceller inducerer træk ved plak sårbarhed i aterosklerose. Nat Med. (2006) 12:1075–80. doi: 10.1038 / nm1459
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
5. Jørgensen, Jørgensen, Jørgensen BR. Molekylær regulering af vaskulær glat muskelcelledifferentiering i udvikling og sygdom. Physiol Rev. (2004) 84:767-801. doi: 10.1152 / physrev.00041.2003
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
6. Shankman LS, Gomes D, Cherepanova OA, laks M, Alencar GF, Haskins RM, et al. KLF4-afhængig fænotypisk modulering af glatte muskelceller har en nøglerolle i aterosklerotisk plakpatogenese. Nat Med. (2015) 21:628–37. doi: 10.1038 / nm.3866
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
7. Gomes D, Ove GK. Glat muskelcelle fænotypisk skift i aterosklerose. Cardiovasc Res. (2012) 95:156-64. doi: 10.1093 | CVR / cvs115
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
8. Det er en af de mest almindelige måder at gøre det på. Aktivering af pluripotensfaktoren OCT4 i glatte muskelceller er atheroprotektiv. Nat Med. (2016) 22:657–65. doi: 10.1038 / nm.4109
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
10. Yla-Herttuala S, bent JF, Daemen M, Falk E, Garcia-Garcia HM, Herrmann J, et al. Stabilisering af aterosklerotisk plak. Positionspapir fra European Society of Cardiology (ESC) arbejdsgruppe om åreforkalkning og vaskulær biologi. Thromb Haemost. (2011) 106:1–19. doi: 10.1160 / TH10-12-0784
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
11. Grootaert MOJ, Moulis M, Roth L, Martinet m, Vindis C, Bennett MR, et al. Vaskulær glat muskelcelledød, autofagi og aldring ved aterosklerose. Cardiovasc Res. (2018) 114: 622-34. doi: 10.1093 / CVR | cvy007
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
14. Ao, Katus HA, et al. De to ansigter af Interleukin-17a i aterosklerose. Curr Stof Mål. (2017) 18:863–73. doi: 10.2174/1389450117666161229142155
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
15. Jia G, Cheng G, Gangahar DM, AGRAVAL DK. Insulinlignende vækstfaktor-1 og TNF-alfa regulerer autofagi gennem c-jun N-terminal kinase og Akt-veje i humane aterosklerotiske vaskulære glatte celler. Immunolcellebiol. (2006) 84:448–54. doi: 10.1111 / j. 1440-1711.2006.01454.
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
16. Grabner R, lots K, Dopping S, Hildner M, Radke D, øl M, et al. Lymfotoksin beta-receptor signalering fremmer tertiær lymfoid organogenese i aorta adventitia af alderen ApoE−/− mus. Med. (2009) 206:233–48. doi: 10.1084 / jem.20080752
CrossRef Fuld Tekst | Google Scholar
17. Damas JK, Smith C, Oie E, Fevang B, Halvorsen B, Vejhre T, et al. Forbedret ekspression af de homeostatiske kemokiner CCL19 og CCL21 i klinisk og eksperimentel aterosklerose: mulig patogen rolle i plak destabilisering. Arterioscler Thromb Vasc Biol. (2007) 27:614–20. doi: 10.1161 / 01.ATV.0000255581.38523.7c
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doring Y, Noels H, van der Vorst EPC, Neideck C, Egea V, Drechsler M, et al. Vascular CXCR4 limits atherosclerosis by maintaining arterial integrity: evidence from mouse and human studies. Circulation. (2017) 136:388–403. doi: 10.1161/CIRCULATIONAHA.117.027646
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Akhtar S, Gremse F, Kiessling F, Weber C, Schober A. CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells in Apoe-deficient mice. Arterioscler Thromb Vasc Biol. (2013) 33:679–86. doi: 10.1161/ATVBAHA.112.301162
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lotzer K, Dopping S, Connert S, Grabner R, Spanbroek R, Lemser B, et al. Mouse aorta smooth muscle cells differentiate into lymphoid tissue organizer-like cells on combined tumor necrosis factor receptor-1/lymphotoxin beta-receptor NF-kappaB signaling. Arterioscler Thromb Vasc Biol. (2010) 30:395–402. doi: 10.1161 / atvbaha.109.191395
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
21. Smedbakken LM, Halvorsen B, Daissormont I, Ranheim T, Michelsen Ae, Skjelland M, et al. Forhøjede niveauer af homeostatisk kemokin CKSCL13 i human aterosklerose-potentiel rolle i plakstabilisering. Åreforkalkning. (2012) 224:266–73. doi: 10.1016 / j. aterosklerose.2012.06.071
CrossRef Fuld Tekst | Google Scholar
22. Higashi Y, Sukhanov S, Shai SY, Danchuk S, Tang R, Snarski P, et al. Insulinlignende vækstfaktor – 1-receptormangel i makrofager fremskynder aterosklerose og inducerer en ustabil plakfænotype hos apolipoprotein E-mangelfulde mus. Omløb. (2016) 133:2263–78. doi: 10.1161 / CIRCULATIONAHA.116.021805
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
23. Aleksandr Hr. Epigenetisk kontrol af glat muskelcelledifferentiering og fænotypisk skift i vaskulær udvikling og sygdom. Annu Rev Physiol. (2012) 74:13–40. doi: 10.1146 / annurev-physiol-012110-142315
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
24. Han C, medley SC, Hu T, Hinsdale ME, Lupu F, Virmani R, et al. Pdgfrbeta-signalering regulerer lokal inflammation og synergiserer med hypercholesterolæmi for at fremme aterosklerose. Nat Commun. (2015) 6:7770. doi: 10.1038 / ncomms8770
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
26. Da Ros F, Carnevale R, Cifelli G, Casaburo M, Perrotta M, et al. Målretning af Interleukin-1beta beskytter mod aortaaneurismer induceret af forstyrret transformerende vækstfaktor beta-signalering. Immunitet. (2017) 47: 959-73 e9. doi: 10.1016 / j.immuni.2017.10.016
CrossRef Fuld Tekst | Google Scholar
27. Hu D, Mohanta SK, Yin C, Peng L, Ma s, Srikakulapu P, et al. Arterie tertiære lymfoide organer styrer aorta immunitet og beskytter mod aterosklerose via vaskulære glatte muskelcelle lymfotoksin beta receptorer. Immunitet. (2015) 42:1100–15. doi: 10.1016 / j.immuni.2015.05.015
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
29. Paramel Varghese G, Folkersen L, Halmbridge RJ, Halvorsen B, Yndestad A, Ranheim T, et al. NLRP3 inflammatorisk ekspression og aktivering i human aterosklerose. J Am Heart Assoc. (2016) 5:e003031. doi: 10.1161 / JAHA.115.003031
CrossRef Fuld Tekst / Google Scholar
30. de Jong RJ, Paulin N, Lemnits P, Viola JR, vinter C, Ferraro B, et al. Beskyttende aptitude af bilag A1 i arteriel neointima dannelse i aterosklerose-tilbøjelige mus-kort rapport. Arterioscler Thromb Vasc Biol. (2017) 37:312–5. doi: 10.1161 / atvbaha.116.308744
CrossRef Fuld Tekst | Google Scholar
32. van Gils JM, Derby MC, Fernandes LR, Ramkhelvon B, Ray TD, Rayner KJ, et al. Den neuroimmune vejledning cue netrin-1 fremmer aterosklerose ved at hæmme udvandringen af makrofager fra plaketter. Nat Immunol. (2012) 13:136–43. doi: 10.1038 / ni.2205
CrossRef Fuld Tekst | Google Scholar
35. Tchkonia T, J, van deursen J, Campisi J, Kirkland JL. Cellulær aldring og senescent sekretorisk fænotype: terapeutiske muligheder. J Clin Invest. (2013) 123:966–72. doi: 10.1172 / JCI64098
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
37. Majesky MVH, Horita H, Ostriker A, Lu s, Regan JN, Bagchi A, et al. Differentierede glatte muskelceller genererer en underpopulation af residente vaskulære stamceller i adventitia reguleret af Klf4. Circ Res. (2017) 120: 296-311. doi: 10.1161 / CIRCRESAHA.116.309322
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
40. Akhavanpoor M, Gleissner CA, Akhavanpoor H, Lasitschka F, Doesch AO, Katus HA, et al. Adventitial tertiær lymfoid organklassificering i human aterosklerose. Cardiovasc Pathol. (2018) 32:8–14. doi: 10.1016 / j. carpath.2017.08.002
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
41. Moos MP, John N, Grabner R, Nossmann S, Gunther B, Vollandt R, et al. Lamina adventitia er det vigtigste sted for immuncelleakkumulering i standard-fodret apolipoprotein E-mangelfulde mus. Arterioscler Thromb Vasc Biol. (2005) 25:2386–91. doi: 10.1161 / 01.ATV.0000187470.31662.fe
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
42. Mohanta SK, Yin C, Peng L, Srikakulapu P, Bontha V, Hu D, et al. Arterie tertiære lymfoide organer bidrager til medfødte og adaptive immunresponser i avanceret musens aterosklerose. Circ Res. (2014) 114: 1772-87. doi: 10.1161 / CIRCRESAHA.114.301137
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
43. Buettner M, Lochner M. udvikling og funktion af sekundære og tertiære lymfoide organer i tyndtarmen og tyktarmen. Front Immunol. (2016) 7:342. doi: 10.3389 / fimmu.2016.00342
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
45. Srikakulapu P, Hu D, Yin C, Mohanta SK, Bontha SV, Peng L, et al. Arterie tertiære lymfoide organer kontrollerer flerlags territorialiseret aterosklerose B-cellerespons i alderen ApoE–/– mus. Arterioscler Thromb Vasc Biol. (2016) 36:1174–85. doi: 10.1161 / atvbaha.115.306983
CrossRef Fuld Tekst | Google Scholar
48. van de Pavert SA, Mebius RE. Ny indsigt i udviklingen af lymfoide væv. Nat Rev Immunol. (2010) 10:664–74. doi: 10.1038 / nri2832
CrossRef Fuld tekst / Google Scholar
50. Barone F, Gardner DH, Nayar S, Steinthal N, Buckley CD, Luther SA. Stromale fibroblaster i tertiære lymfoide strukturer: et nyt mål ved kronisk betændelse. Front Immunol. (2016) 7:477. doi: 10.3389 / fimmu.2016.00477
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
51. Scandella E, Bolinger B, Lattmann E, Miller S, Favre s, Littman DR, et al. Restaurering af lymfoid organintegritet gennem interaktion mellem lymfoide vævsinducerceller med stroma i T-celleområdet. Nat Immunol. (2008) 9:667–75. doi: 10.1038 / ni.1605
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
52. Grandoch M, Feldmann K, Gothert JR, Dick LS, Homann S, Klatt C, et al. Deficiency in lymphotoxin beta receptor protects from atherosclerosis in apoE-deficient mice. Circ Res. (2015) 116:e57–68. doi: 10.1161/CIRCRESAHA.116.305723
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Guedj K, Khallou-Laschet J, Clement M, Morvan M, Gaston AT, Fornasa G, et al. M1 macrophages act as LTbetaR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis. Cardiovascular research. (2014) 101:434–43. doi: 10.1093/cvr/cvt263
PubMed Abstract | CrossRef Full Text | Google Scholar