26. oktober 2020 af NCI-personale
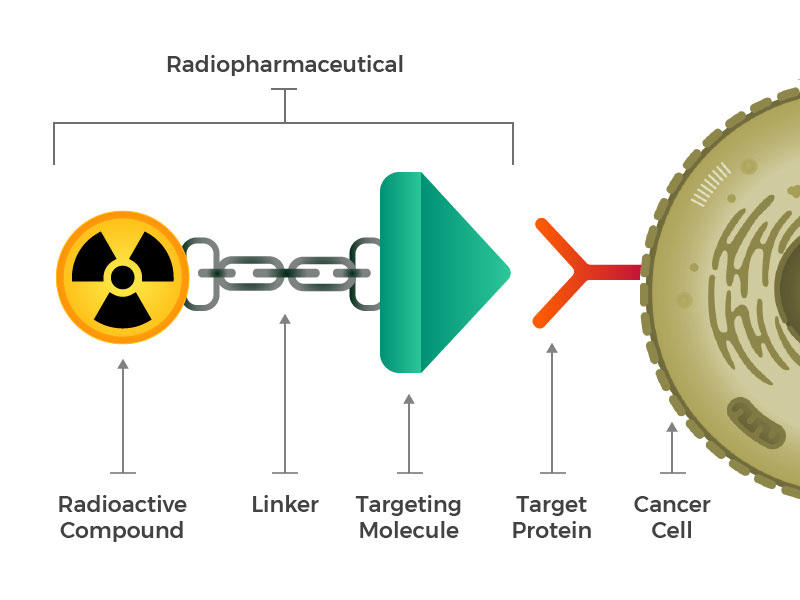
radioaktive lægemidler består af et radioaktivt molekyle, et målretningsmolekyle og en linker, der forbinder de to.
de sidste to årtier har medført en havændring i den måde, mange typer kræft behandles på. Målrettede terapier lukker specifikke proteiner i kræftceller, der hjælper dem med at vokse, opdele og sprede sig. Immunterapier stimulerer eller undertrykker kroppens immunsystem for at hjælpe med at bekæmpe kræft. Men langvarige behandlinger-kirurgi, kemoterapi og strålebehandling — forbliver rygraden i behandlingen af de fleste kræftformer.
strålebehandling blev først brugt til behandling af kræft for mere end 100 år siden. Cirka halvdelen af alle kræftpatienter modtager det stadig på et tidspunkt under deres behandling. Og indtil for nylig blev de fleste strålebehandling givet meget som det var for 100 år siden ved at levere stråler af stråling uden for kroppen for at dræbe tumorer inde i kroppen.
selvom effektiv, ekstern stråling kan også forårsage sikkerhedsskader. Selv med moderne strålebehandlingsudstyr, ” skal du normalt væv for at komme til en tumor,” sagde Charles Kunos, MD, Ph. D., fra NCI ‘ s Cancer Therapy Evaluation Program (CTEP). De resulterende bivirkninger af strålebehandling afhænger af det behandlede område af kroppen, men kan omfatte tab af smag, hudændringer, hårtab, diarre og seksuelle problemer.
nu udvikler forskere en ny klasse af lægemidler kaldet radioaktive lægemidler, som leverer strålebehandling direkte og specifikt til kræftceller. De sidste mange år har der været en eksplosion af forskning og kliniske forsøg, der tester nye radioaktive lægemidler.
disse undersøgelser har antydet, at målretning af strålebehandling på celleniveau har potentialet til at reducere risikoen for både kort – og langsigtede bivirkninger af behandlingen, samtidig med at selv små aflejringer af kræftceller kan dræbes i hele kroppen.
” jeg tror, de vil omdanne strålingskræft i de næste 10 til 15 år,” sagde Dr. Kunos.
at bygge på en naturlig affinitet
at levere stråling direkte til celler er ikke i sig selv en ny tilgang. En sådan terapi, kaldet radioaktivt iod, er blevet brugt til behandling af nogle typer skjoldbruskkræft siden 1940 ‘ erne. jod akkumuleres naturligt i skjoldbruskkirtelceller. En radioaktiv version af elementet kan produceres i laboratoriet. Når det indtages (som en pille eller en væske), akkumuleres det i og dræber kræftceller, der er tilbage efter skjoldbruskkirtelkirurgi.
en lignende naturlig affinitet blev senere udnyttet til at udvikle lægemidler til behandling af kræft, der har spredt sig til knoglerne, såsom radium 223 dichlorid, som blev godkendt i 2013 til behandling af metastatisk prostatacancer. Når kræftceller vokser i knoglen, får de knoglevævet, de invaderer, til at nedbrydes. Kroppen forsøger derefter at reparere denne skade ved at erstatte den knogle—en proces kaldet knogleomsætning.
det radioaktive element radium “ligner et calciummolekyle, så det bliver indarbejdet i områder af kroppen, hvor knogleomsætningen er højest”, såsom områder, hvor kræft vokser, forklarede Dr. Kunos. Radium er derefter i stand til at dræbe nærliggende kræftceller.
disse radioaktive forbindelser rejser alle til kræftceller uden hjælp. Forskere spekulerede på, om det ville være muligt at konstruere nye radioaktive molekyler, der specifikt er målrettet mod andre kræftformer.
de forestillede sig konstruerede radioaktive lægemidler, der består af tre hovedbygningsblokke: et radioaktivt molekyle, et målretningsmolekyle (der genkender og låser specifikt på kræftceller) og en linker, der forbinder de to. Sådanne forbindelser kunne injiceres, infunderes, indåndes eller indtages og derefter komme ind i blodbanen.
ideen om at forbinde et kræftmålrettet molekyle med et molekyle, der dræber kræftceller, er heller ikke nyt. For eksempel er flere lægemidler kaldet antistof–lægemiddelkonjugater, hvor et antistof, der binder til specifikke kræftceller, er knyttet til et giftigt lægemiddel, blevet godkendt til behandling af kræft.
men bestræbelserne på at skabe sådanne stoffer har mødt med begrænset succes, forklarede Dr. Kunos, fordi det ikke er nok, at toksiner bringes tæt på en kræftcelle. Toksinerne skal tages inde og forblive inde i cellerne længe nok til at forårsage skade. Mange kræftceller har eller udvikler mekanismer til blot at pumpe toksiner lige tilbage, før det kan ske.
radioaktive lægemidler fungerer også bedst, når stofferne kan komme ind i celler. Men det er ikke nødvendigt for dem at være effektive. Når et radiofarmaceutisk middel har fastgjort sig til en kræftcelle, nedbrydes den radioaktive forbindelse naturligt. Dette henfald frigiver energi, der beskadiger DNA fra nærliggende celler. Og når en celles DNA er uopretteligt beskadiget, dør den celle. Kræftceller er særligt følsomme over for strålingsinduceret DNA-skade.
afhængig af den anvendte type radioaktive forbindelse kan den resulterende energi trænge ind i cellen bundet til det radioaktive lægemiddel såvel som omkring 10 til 30 celler, der omgiver den celle. Dette øger antallet af kræftceller, der kan dræbes med et enkelt radiofarmaceutisk molekyle.
i midten af 2010 ‘ erne havde Food and Drug Administration (FDA) godkendt to radioaktive lægemidler, der målretter molekyler på visse B-celler til behandling af nogle mennesker med ikke-Hodgkin lymfom, en type blodkræft. Men disse stoffer blev aldrig bredt vedtaget. Få læger, der behandlede patienter med lymfom, blev uddannet til at administrere disse typer radioaktive forbindelser. Og de radioaktive lægemidler stod over for konkurrence fra nyere, ikke-radioaktive stoffer.
game-changer for feltet kom i 2018, sagde Jacek Capala, Ph. D., fra NCI ‘ s Strålingsforskningsprogram, da FDA godkendte lutetium Lu 177-Dotatat (Lutathera) til behandling af visse kræftformede neuroendokrine tumorer (net), der påvirker fordøjelseskanalen.
“dette viste, at solide tumorer også kan målrettes på denne måde,” med et radiofarmaceutisk middel Bygget fra bunden, sagde han. I dette tilfælde er målene visse hormonreceptorer, der findes i overflod på overfladen af NETCELLER.
Lutetium Lu 177-Dotatate var bedre til at bremse nettovæksten end noget tidligere testet lægemiddel, forklarede Aman Chauhan, MD, fra University of Kentucky, der leder flere nye kliniske forsøg med lægemidlet. “Dette var et stort skridt fremad for vores felt,” sagde han.
tilpasning af lægemidler fra Billeddannelsesforbindelser
forskere designer og tester nu radioaktive lægemidler til en række kræftformer så forskellige som melanom, lungekræft, kolorektal cancer og leukæmi, sagde Dr. Capala. Enhver tumor, der har et målbart molekyle på overfladen af dets celler og en god blodforsyning—tilstrækkelig til at levere lægemidler—kunne potentielt behandles med radioaktive lægemidler, tilføjede Dr. Chauhan.
mange af disse nyere lægemidler er genudviklede versioner af eksisterende forbindelser, der anvendes til nuklear billeddannelse. Nukleare billeddannelsestest, såsom positronemissionstomografi (PET), bruger undertiden svagt radioaktive forbindelser bundet til molekyler, der binder til specifikke mål på overfladen af kræftceller. Specialiserede kameraer kan derefter afsløre selv små aflejringer af kræftceller, hvilket hjælper med at måle spredningen af kræft gennem kroppen.
forskere har nu repurposed disse målretningsmolekyler til at bære mere potente radioaktive forbindelser eller isotoper i stedet—dem der kunne dræbe kræftceller i stedet for blot at hjælpe med at visualisere dem.
prostatacancer har været en tidlig testplads for denne repurposing. Et protein kaldet PSMA findes i store mængder—og næsten udelukkende-på prostataceller. Ved at smelte et molekyle, der binder til PSMA til en radioaktiv forbindelse, der anvendes i PET-scanningsbilleddannelse, har forskere været i stand til at visualisere små forekomster af prostatacancer, der er for små til at blive detekteret ved konventionel billeddannelse.
flere radiofarmaceutiske behandlinger, der er målrettet mod PSMA, testes nu i kliniske forsøg.
de fleste prostatacancer er meget følsomme over for stråling, og ekstern stråling bruges ofte til at behandle sygdommen, forklarede Frank Lin, MD, fra NCI ‘ s Center for Cancer Research, der leder et klinisk forsøg med et PSMA-målrettet radiofarmaceutisk middel ved NIH Clinical Center.
de fleste mænd, der modtager stråling som deres indledende behandling, vil ikke opleve en gentagelse af deres kræft. Men hvis de gør det, spredes det nogle gange i hele kroppen, med mange små forekomster af kræftceller i mange organer, forklarede han.
“når tumoren har spredt sig sådan, kan du ikke rigtig gøre ekstern stråling længere, fordi ekstern stråling kun kan fokuseres på og behandle en lille del af din krop ad gangen,” sagde Dr. Lin.
at have et radiofarmaceutisk middel, der er målrettet mod PSMA, er en bedre måde at give stråling i disse tilfælde, fordi det kan infunderes direkte i blodstrømmen og cirkulere bredt og fastgøres til prostatacancerceller, der har spredt sig i hele kroppen, forklarede han.
og en stor fordel ved at have billeddannelses-og behandlingsmolekyler, der bruger det samme mål, er, at billeddannelse derefter kan give læger et smugkig på, om behandlingen sandsynligvis fungerer, tilføjede Dr. Lin.
for eksempel skal mænd i Dr. Lins forsøg have en PET-scanning med billeddannelsesversionen af forbindelsen før behandling. Hvis billeddannelsesforbindelsen finder vej til kræftcellerne og detekteres ved PET-scanningen, kan forskerne antage, at den tilsvarende radiofarmaceutiske behandling vil ramme sit mål.
“denne komplementære udvikling af diagnostik hånd i hånd med lægemiddelterapier gør dette felt så meget mere spændende,” sagde Dr. Chauhan. “På denne måde kan vi vide, at vi leverer terapien lige til tumorcellerne.”
flytning til kombinationsterapier
mens radioaktive lægemidler har vist løfte i tidlige studier, er de også, som det er tilfældet med andre typer kræftlægemidler, usandsynligt at udslette en tumor alene.
for eksempel fordoblede lutetium Lu 177-dotatat mere end antallet af mennesker, der havde deres neuroendokrine tumorer, krympet efter behandling, men dette antal var stadig beskedent: omkring 17%, op fra 7% uden lægemidlet, forklarede Dr. Chauhan.
” der er stadig betydelig plads til forbedring, ” sagde han.
brug af radioaktive lægemidler i kombination med andre terapier kan være en måde at drive denne forbedring på. Nogle forskere tester nu radioaktive lægemidler kombineret med strålingsfølsomme stoffer—lægemidler, der gør kræftceller endnu mere sårbare over for stråling. For eksempel leder Dr. Chauhan et klinisk forsøg med lutetium Lu 177-dotatat kombineret med en strålingssensibilisator kaldet triapin, som blokerer celler fra at producere de forbindelser, der er nødvendige til DNA-reparation efter strålingsinduceret skade.
i et andet forsøg tester Dr. Lin lutetium Lu 177-dotatat med en type lægemiddel kaldet en PARP-hæmmer. Disse lægemidler, som allerede er godkendt til behandling af nogle typer bryst -, ovarie-og andre kræftformer, blokerer selve processen med DNA-reparation. “Så strålingen ville forårsage DNA-skaden, og PARP-hæmmeren ville forhindre tumorcellerne i at helbrede deres DNA efter strålingen,” forklarede han.
andre forskere kombinerer radioaktive lægemidler med immunterapier for at forsøge at øge effektiviteten af disse lægemidler. “Nylige undersøgelser har vist, at radioaktive lægemidler kan gøre tumorer mere lydhøre over for immunterapi,” sagde Dr. Capala.
mange tumorer er “kolde” tumorer, forklarede han, idet immunceller ikke genkender dem eller ikke fungerer korrekt i mikromiljøet omkring tumorer, forklarede han.
men når stråling dræber kræftceller, kan proteiner og DNA fra disse celler spildes ind i blodbanen for immunceller at se, hvilket kan gøre det muligt for immuncellerne at genkende og dræbe andre kræftceller i hele kroppen. Strålebehandling kan også gøre tumormikromiljøet mere gæstfrit for immunceller, tilføjede Dr. Capala.
sammen kan disse effekter gøre en kold tumor til en “varm” tumor: en, der har en overflod af immunceller og kan være lydhør over for immunterapimedicin. Nogle undersøgelser har forsøgt at bruge ekstern stråling til at skabe denne form for respons.
“men der er data, der tyder på, at det virker bedre, hvis hver tumor, hver metastase, udsættes for stråling. Så radiofarmaceutisk terapi har en fordel der, ved at når den først er i kroppen, når den alle metastaser, ” forklarede Dr. Capala.
det kan endda være fornuftigt at kombinere radioaktive lægemidler med ekstern stråling, så længe omhyggelig behandlingsplanlægning kan sikre en sikker samlet strålingsdosis, tilføjede Dr. Capala. “Ekstern strålebehandling er meget god til at målrette mod store tumorer, og så kan du kombinere det med radiofarmaceutisk terapi for at målrette metastaser,” sagde han.
udfordringer og advarsler
området for radioaktive lægemidler er stadig i sine tidlige dage. En udfordring, som tilgangen skal overvinde, før den kan bruges mere bredt, er manglen på læger, der er uddannet til at administrere sådanne lægemidler.
“antallet af nuklearmedicinske læger i USA er lille,” sagde Dr. Lin, der har uddannelse i både nuklearmedicin og medicinsk onkologi. “Og jeg tror, vi kun træner måske 70 eller 80 nye mennesker om året.”
indtil videre har denne mangel på arbejdsstyrke forhindret radioaktive lægemidler i at leve op til deres sande potentiale som en personlig behandling, forklarede Dr. Capala. Dette potentiale afspejler det faktum, at læger i modsætning til andre typer kræftmedicin kan bruge billeddannelse til at måle nøjagtigt, hvor meget af et radiofarmaceutisk middel der har nået en tumor, næsten i realtid, og juster dosis i overensstemmelse hermed.
men denne type behandlingsplanlægning kræver tværfaglig ekspertise, der ikke er bredt tilgængelig og har efterladt folk, der bruger radioaktive lægemidler mere som “radioaktiv kemoterapi” med en dosis, der passer til alle, tilføjede han. “Det betyder, at mange patienter ikke får optimal behandling,” sagde Dr. Capala.
langsigtede sikkerhedsundersøgelser er også nødvendige, tilføjede Dr. Chauhan. Personer, der behandles med ekstern strålebehandling, kan opleve nogle bivirkninger, kaldet sene effekter—såsom udvikling af anden kræft—måneder eller år efter behandlingen. Selvom forskning til dato ikke har vist en høj grad af sene effekter fra radiofarmaceutisk behandling, “er disse meget nye stoffer, og vi skal fortsætte med at være forsigtige og overvåge dem,” sagde han.
udjævning af samarbejde
fordi disse lægemidler er relativt nye, selv med de igangværende forsøg, “skraber vi bare overfladen af lægemiddeludvikling til radioaktive lægemidler,” sagde Dr. Chauhan.
i 2019, for yderligere at øge forsøg med lovende nye radioaktive lægemidler, lancerede NCI Radiofarmaceutical Development Initiative (RDI) for at fremskynde lovende nye lægemidler til klinisk test.
en ting NCI håber at opnå med RDI er at mægle flere forsøg ved hjælp af kombinationer af lægemidler produceret af forskellige farmaceutiske virksomheder, der måske ikke samarbejder ellers, forklarede Dr. Kunos, der leder initiativet. Bekymringer om intellektuel ejendomsret og manglende tillid kan stoppe sådanne projekter, før de starter, forklarede Dr. Kunos.
“disse typer samarbejde ville ikke nødvendigvis ske, medmindre NCI var den ærlige mægler i midten,” sagde han. Lige nu tester kun omkring 2% af de tidlige fase forsøg, der understøttes af NCI, radioaktive lægemidler, men med RDI kan dette vokse eksponentielt i de kommende år, tilføjede han.
“vi vil ikke eliminere maskiner eller andre teknikker, som vi bruger i strålebehandling,” sagde Dr. Kunos. “Men med deres målrettede karakter tror vi, at radioaktive lægemidler vil ændre, hvordan vi bruger stråling.”