Calmodulin
dette er en video introduktion til calcium signalering protein, calmodulin, fra en uorganisk kemiker perspektiv!
Calmodulin, eller CaM, er et polypeptid, der er allestedsnærværende i alle eukaryote celler. Dette protein er kendt som calmodulin, fordi det er et calciummoduleret protein, der spiller en afgørende rolle i processen med calciumsignaltransduktion. Calciumsignaltransduktion er den proces, gennem hvilken interaktionerne mellem calciumioner og adskillige proteiner formidler kommunikation mellem celler. calmodulins funktion er derfor nødvendig i alle eukaryote celler, og nogle af de opgaver, det hjælper med at udføre, er nervesignalering, skeletmuskelbevægelse og hukommelse. Ved at registrere calciumioner i miljøet aktiverer calmodulin og fungerer derefter som et mellemprodukt, initierer bindingen af vigtige proteiner, såsom kinaser, hjælper vores celler med grundlæggende og sofistikeret funktion (“Calmodulin”).
videoen nedenfor viser den strukturelle ændring, der opstår inden for CaM under calciumbinding (PDB-koder 3CLN og 1cfd).
selve proteinet er 148 aminosyrer i længden med to kugleformede regioner indeholdende 2 EF-håndmotiver hver, som er karakteristiske steder for calciummedierede polypeptider. Når den er aktiveret, huser calmodulin 4 Ca2 + ioner, der drastisk ændrer proteinets form. Når calmodulin binder sig til calciumionerne, åbnes proteinet fra dets apo-form til dets haloform og udsætter en alfa-spiral, der er kendt som linker-eller central tether-regionen. Opfundet for sin fleksibilitet er den centrale tether-region placeringen af proteinet, som partnerproteiner binder på og bidrager til kaskaden, der er den sekundære besked af calcium. Baseret på dets struktur og dets behov for, at calciumioner fungerer, skal calmodulin være i stand til at vælge for calciumioner i cytoplasmaet, og interaktionerne mellem ion og ligander i EF-hånddomænerne understøtter denne ide om selektivitet (Bertini et. al., 635-638).
dette billede er en skildring af, hvordan et EF-håndmotiv ligner en hånd. Bånddiagrammet til venstre viser et af de fire karakteristiske spiral-sving-spiral EF-håndmotiver af calmodulin. (FBF-kode 3CLN)
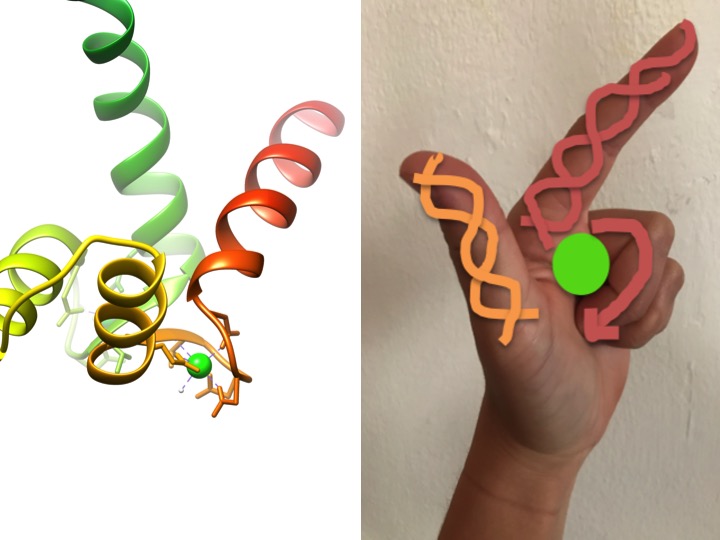
EF-hånd motiver er stærkt konserverede strukturelle regioner af proteiner involveret i binding af calcium. Disse regioner er kendt som” hånd ” -motiver, fordi de ligner en hånd, der er lavet i form af en L, hvor metalionen er placeret i midten af knytnæve, alfa-helices er angivet med den opadrettede pegefinger og indadvendte tommelfinger, og de krøllede fingre repræsenterer sving-eller sløjfeområdet. Dette er demonstreret i figuren ovenfor. I et karakteristisk EF-hånd-motiv binder aminosyrer inklusive glutamater, asparaginer, asparaginsyrer og glutaminsyrer til Ca såvel som vand (Bertini et. al. 639). Den typiske EF-hånd domænebindingssekvens er vist i nedenstående figur.
denne tegneserie illustrerer de koordinerede aminosyrer i et typisk EF-hånddomæne (den nøjagtige aminosyresammensætning varierer!). Den stiplede linje repræsenterer koordinering af Ca til ilt fra en rygradcarbonyl, mens faste linjer indikerer koordination til sidekæder eller vand.
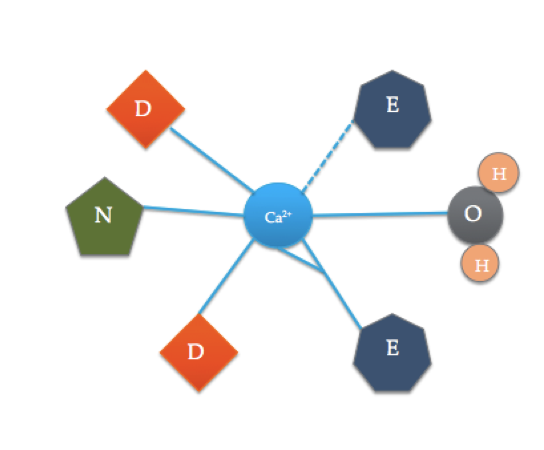
calmodulinbindingsstedet er noget anderledes end det mest typiske EF-hånddomæne vist ovenfor. De 6 ligander af calmodulin inkluderer sidekæderne af tre asparaginsyrer (D), 1 glutaminsyre (E), der danner to koordinatkovalente bindinger med ionen, 1 vandmolekyle fra opløsning og 1 carbonylmolekyle fra rygraden. Bindingsstedet for calmodulin består af en Ca2+ ion omgivet af 6 ligander, mens der dannes 7 bindinger.
man kan bemærke, at EF-motivet i calmodulin indeholder mange af de samme ligander, bare forskellige steder. Denne konformation kan give en ide om, hvorfor calmodulin er selektiv for calcium, og hvordan kun tilstedeværelsen af en calciumion kan tilfredsstille bindingsstedet, der får proteinet til at aktivere. Dette er relateret til termodynamikken af calmodulin i cellen, og hvordan den reagerer på tilstedeværelsen af calciumioner.
for at forstå termodynamikken, der parrer aktiveringen af calmodulin, skal man først forstå koncentrationen af ioner såsom calcium og magnesium i en eukaryot celle, inklusive et menneskes. Koncentrationen af disse ioner skal reguleres nøje. Inde i cellen ledsages calciumsignalering af en midlertidig stigning i koncentrationen af calciumioner, som registreres af proteiner som calmodulin (Bertini et. al., 636). Denne calciumbølge kan skyldes intracellulære G-proteiner, der inducerer det ru og glatte retikulum til at frigive calcium, eller calciumionerne kan bringes ind fra det ekstracellulære rum. I tilfælde af calmodulin reagerer det normalt på, at calcium bringes ind i cellen udefra, hvilket forekommer under processer såsom nervesignalering (Bertini et. al. 637). Før koncentrationen af calcium øjeblikkeligt hæves, er koncentrationen i cellen sædvanligvis mellem 10-100 nm, mens koncentrationen under den korte tilstrømning af ioner stiger til 1.000-100.000 nm. Ændringen i koncentration får calmodulin til at mærke calciumionerne, binde dem og indlede yderligere signaltransduktion (Bertini et. al., 635).
hvordan binder calmodulin definitivt calciumioner og ikke for eksempel magnesiumioner? Mg2 + ioner er faktisk meget lig calciumioner: de ville engagere sig i elektrostatiske interaktioner snarere end kovalente, og de betragtes som hårde atomer. Årsagen til, at calmodulin ser ud til at favorisere calciumioner snarere end magnesiumioner, er relateret til bindingskonstanterne for hver ion. Calmodulin kan eksistere, mens den er bundet til andre ioner, såsom magnesium, men hvis der er en højere koncentration af calcium, vil calciumionerne straks konkurrere magnesiumionerne om at optage calciumbindingssteder. Dette skyldes, at bindingskonstanten for CaM og Ca2+ (Ka) er større end for CaM og Mg2+, som vist i Figur 7. Dette indikerer, at calmodulin, når det er bundet til calciumioner, ville producere flere produkter. Man må overveje alle disse ideer under hensyntagen til, at denne proces sker utallige gange i sekundet, og omsætningen af dette protein ændres for at reagere på den stadigt modulerede calciumkoncentration i cellen.
Hvorfor er calmodulin binding med calciumioner mere gunstig end med andre metaller? Det kan skyldes størrelsen af ionerne i forhold til den steriske hindring induceret af liganderne. Bindingsstedet er kendetegnet ved 6 ligander, der fremstiller 7 koordinatbindinger. Fordi calciumioner er større end magnesiumioner, som vist i figur 8, er det muligt, at calcium er begunstiget, fordi det øger ligandernes afstand fra hinanden, hvilket reducerer steriske interaktioner mellem liganderne. Selve strukturen af selve proteinet kan også udgøre en grund til selektiviteten af calciumioner. Samlet set er det kendt, at calmodulin på grund af termodynamik baseret på varierende cellulær koncentration af calciumioner vil mærke stigningen i ioner, binde dem og hjælpe med at udføre sin funktion.
CaM + Ca2+ <–> Ca2+CaM (KCaM-Ca)
CaM + Mg2+ <–> Mg2+CaM (KCaM-Mg)
Mg2+-CaM + Ca2+ <–> Ca2+CaM + Mg2+
fordi kcam-ca > Kcam-mg
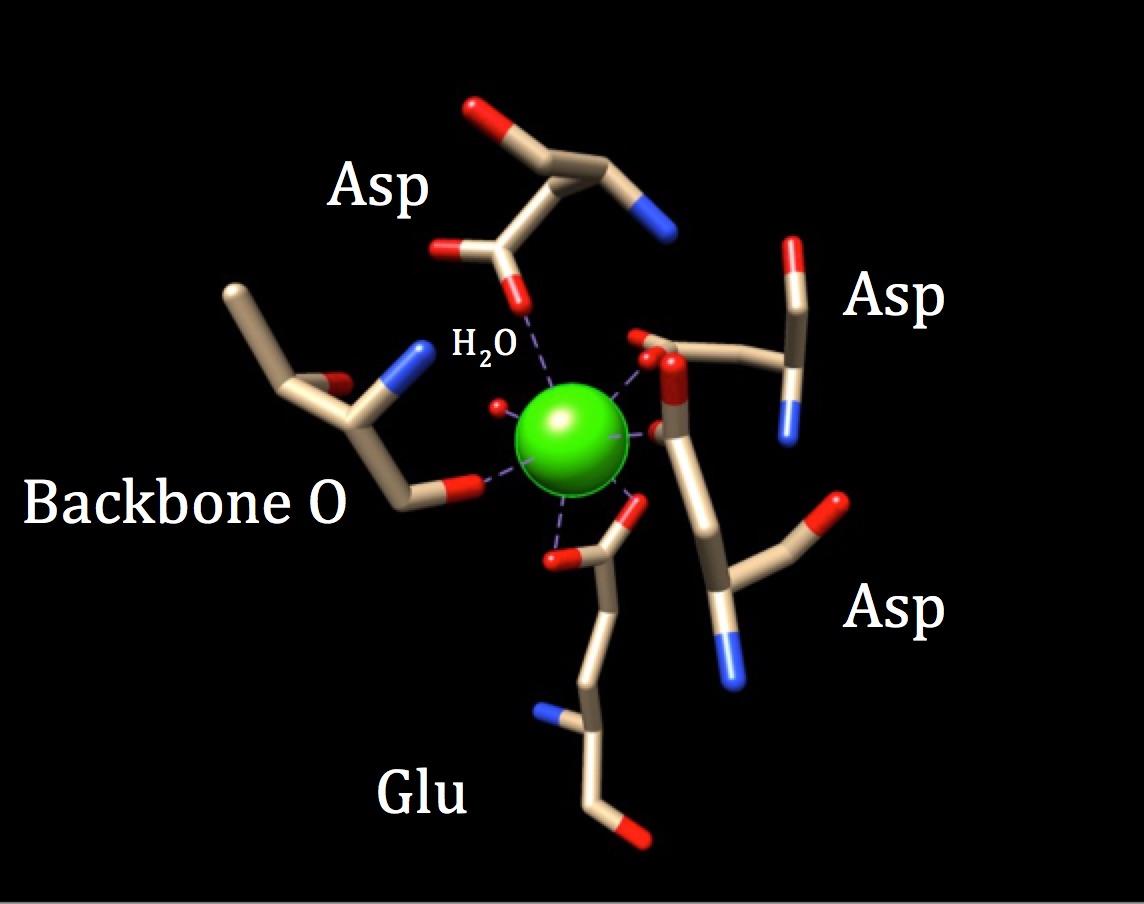
i en yderligere diskussion af kemien på bindingsstedet for calmodulin, bør Koordinationsgeometrien undersøges. Fordi calciumionen interagerer med syv donoratomer, er systemet kendt som et heptadentatsystem. Fordi calmodulin er omgivet af seks ligander, ville man antage en oktaedrisk koordinationsgeometri. Men fordi en af liganderne interagerer på en bidentat måde med ionen—hvilket betyder at den har to koordinatkovalente bindinger, der kommer fra forskellige atomer i en aminosyre—får koordinationskomplekset en forvrænget oktaedrisk form. Den specifikke koordinering er beskrevet i nedenstående figur.
koordinationsgeometrien for calmodulins calciumbindingssted. Den centrale calciummetalion er omgivet af tre asparaginer (Asp), en rygrad ilt, en gluatminsyre (Glu) og et vandmolekyle. (FBF-kode 3CLN)
vi kan også henvise til teorien om chelateffekten for bedre at forstå calmodulins evne til at binde til metalioner med høj affinitet. En chelator er et atom, der er i stand til at binde med mere end et donoratom. Polydentatbinding er relateret til chelateffekt, som siger, at når en ligand binder med mange donorgrupper (poly), er koordinatkovalente bindinger meget stærkere eller mere tæt holdt. Denne teori understøttes af termodynamik, specifikt at polydentatbinding øger entropien i et system, hvilket gør det mere positivt (mere lidelse), hvilket er termodynamisk gunstigt. Anvendelse af denne teori på calmodulin hjælper med at forklare ikke kun vigtigheden af polydendatbinding inden for selve stederne, men også behovet for, at proteinet binder 4 forskellige calciumioner for at aktivere dets funktion. Ved i det væsentlige at kræve binding af fire Ca2+ ioner inden for stederne tilskynder systemet til en stigning i entropi ved at indføre flere substrater/reaktanter for at danne et større antal produkter. Dette sker på grund af det højere antal binding inden for ligandinteraktionerne på hvert bindingssted. Alt i alt understøttes bindingen af calciumionen på polypeptidstederne af chelat-effektteorien og kaster lys over calmodulins effektivitet ved binding af calcium.
EF-håndmotiver har en vis struktur baseret på, at calcium er det centrale metal. Dette gælder også for calmodulin-bindingsstederne. Ca2 + ion binder med lignende atomer i strukturerne af visse aminosyrer baseret på en teori kaldet hård/blød syre-Base teori. Denne teori adskiller metaller og ligander i to kategorier baseret på polariserbarheden og deres forhold mellem ladning og radius. Hårde syrer og baser er mindre ioner, der har et større forhold mellem ladning og størrelse, og dette får dem til at interagere på elektrostatiske måder (hvilket betyder attraktioner mellem + og – ladninger), mens bløde syrer og baser er større i størrelse og derfor har et mindre forhold mellem ladning og radius, hvilket får dem til at skabe bindinger med kovalent karakter. Udtrykket” ligesom binder med lignende ” henviser til det faktum, at hårde syrer og baser har tendens til at interagere med andre hårde atomer, og det samme gælder bløde syrer og baser. Ca2 + er karakteriseret som en hård syre, fordi den, selvom den har en stor radius, interagerer med ligander på en for det meste elektrostatisk måde. Når man ser på kalciumbindingsstedet for calmodulin, kan man se, at calciumionen binder til iltatomer af de 3 asparaginsyrer, glutaminsyre, vand og rygradcarbonyl. Denne binding er i tråd med “like binder med like”, fordi vand og aminosyrerne ligander, glutaminsyre og asparaginsyre binder gennem iltdonorer, der er karakteriseret som hårde baser. Figur 10 reviderer bindingsstederne for calmodulin, mens de også viser de negative sidekæder af aminosyrerne, der ville interagere med calciumionerne betegnet med blåt.
vedrørende donoratomer i de bundne ligander og deres evne til at donere elektronpar til koordineringskomplekset forklarer den spektrokemiske serie, hvordan atomerne interagerer med det centrale metal. I tilfælde af calciumbindingsstedet anses iltene, der interagerer med Ca2+ – ionen, alle for at være Kron-donorer og Kron-donorer, fordi donorens iltegener har 2 eller flere par elektroner. Kategorierne af de spektrokemiske seires, der specificerer elektrontilgængelighed og donation, har konsekvenser for spinbetegnelse (lav eller høj), hvilket angiver, hvordan d-elektroner udfylder deres orbitaler, og delta (Kurt) størrelse mellem metalets d-orbitaler, men dette gør ikke en forskel for calcium, fordi calcium ‘ s d-orbitaler er ubesatte på grund af fravær af valens d-elektroner. Dette gør d-orbitalerne i det væsentlige ubetydelige i de fleste samtaler vedrørende proteinet. En undtagelse er relateret til at overveje labiliteten af calciumionen i systemet.
manglen på elektroner i Ca ‘ S d-orbitaler giver nul ligandfeltstabiliseringsenergi og forklarer den høje labilitet af calciumionen. Labilitet henviser til den hastighed, hvormed ligander kan udskiftes i koordineringskomplekser, og beskriver derfor kinetikken i et system. Atomer er labile, hvis de hurtigt udveksler ligander. På grund af dets relevante funktion i alle eukaryote celler forventes calmodulin at binde og frigive calciumioner millioner af gange i sekundet for at sende og modtage meddelelser fra omgivende celler gennem overførsel af calciumioner. Når det gælder calmodulins evne til at binde og frigive Ca2+ hurtigt, er det vigtigt at overveje belægningen af valence d electron orbitals. Som nævnt har calcium tomme Valens d orbitaler. Disse ubesatte orbitaler kan give anledning til en forklaring på en Ca2+ ions labilitet. Fordi alle calciumionets d-orbitaler er tomme, har den en ligandfeltstabiliseringsenergi (LFSE) på 0. Dette indikerer, at calcium er ustabilt, når man overvejer LFSE på grund af det faktum, at stabile molekyler normalt har en negativ værdi for LFSE. Ustabilitet i dette tilfælde oversættes til en vilje til at reagere hurtigt og bevæge sig til og fra komplekser, hvilket understøtter påstanden om, at Ca2+ ioner tilskynder til hurtige reaktioner og kan karakteriseres som labile. Selvom dette ser ud til at være kontraintuitivt for diskussionen, der involverer chelat-effekt, forstås det, at disse to teorier ikke modsiger hinanden. Stabiliteten af de tæt holdte koordineringsbindinger, der antydes af chelateffekten, tilskynder calmodulin til at forblive stabil længe nok til at binde supplementproteiner. Når det er afsluttet, og koncentrationen af calcium vender tilbage til det normale, er det effektivt at strippe stedet for calciumionerne.
Calmodulin, baseret på dets struktur og sammensætningen af dets vitale bindingssted, spiller en integreret del af utallige processer udført af eukaryote celler. Gennem accept og binding af calciumioner i signaltransduktion fungerer calmodulin som en central komponent i grundlæggende og højt niveau funktion i organismer som mennesker. Ved at anvende bioinorganisk teori og forstå en forståelse af det delikat overvågede miljø i en eukaryot celle, kan man korrekt forstå calmodulins evne til at vælge for calciumioner og tilskynde til yderligere funktion, der involverer mere end 100 partnerproteiner.