Dentinüberempfindlichkeit ist eine der häufigsten Patientenbeschwerden in der Zahnarztpraxis.1 Bei bis zu 57% der Patienten scheint der Höhepunkt im Alter zwischen 20 und 40 Jahren zu liegen.2 Die Prävalenz der Überempfindlichkeit ist bei Frauen etwas höher,3 wobei Eckzähne und Prämolaren beider Bögen am häufigsten betroffen sind.4 Der Schmerz ist oft chronisch und durch akute Episoden gekennzeichnet.5
Nach Holland et al,6 dentinale Überempfindlichkeit ist definiert als „kurzer, scharfer Schmerz, der durch exponiertes Dentin als Reaktion auf Reize entsteht, die normalerweise thermisch, verdunstend, taktil und osmotisch oder chemisch sind und normalerweise keiner anderen Form, keinem Zahndefekt oder keiner anderen Pathologie zugeschrieben werden können.“ Normalerweise ist der Schmerz lokalisiert und von kurzer Dauer. Dies unterscheidet sich von Pulpaschmerzen, die langwierig, dumpf, schmerzhaft, schlecht lokalisiert sind und länger anhalten als der angewendete Reiz.
Die durch Überempfindlichkeit verursachte Belastung kann von gering bis schwerwiegend sein. Patienten mit schwerer Überempfindlichkeit können Schwierigkeiten beim Essen und Trinken haben, insbesondere beim Verzehr heißer oder kalter Substanzen. Der Schmerz, den Personen mit Empfindlichkeit empfinden, ist jedoch sehr subjektiv und die Intensität ist episodischer Natur. Leider sind Patienten selten in der Lage, den relevanten Zahn zu isolieren.7 Um die Ursachen der Empfindlichkeit zu isolieren, verlassen sich Kliniker typischerweise darauf, den vermuteten Zahn einem Luftstoß oder einer heißen oder kalten Flüssigkeit auszusetzen, um eine Reaktion auszulösen. Die Verwendung eines Kofferdamms zur Isolierung des Zahns kann dabei hilfreich sein.
HYDRODYNAMISCHE THEORIE
Die hydrodynamische Theorie ist die am häufigsten vereinbarte Ursache für Dentinüberempfindlichkeit. Kramer8 und Brännström9 bestätigten und erweiterten diese Theorie, die eine Beziehung zwischen angewandtem Druck, Luftblasen und chemischen Reizen zu Dentinflüssigkeitsverschiebungen herstellt, die als Reaktion auf diese Reize auftreten.7 In der ursprünglichen Studie wurde Brännström bei Kindern, deren Zähne für kieferorthopädische Zwecke extrahiert werden sollten, durch den Zahnschmelz in das mittelkoronale Dentin von Prämolaren geschliffen. Die Querschnittsdentintubuli der Kinder wurden eine Woche lang Speichel ausgesetzt, was zu einer erhöhten Empfindlichkeit führte. Anfangs bedeckte eine Schmierschicht diese Zähne, aber am Ende der Woche war sie verschwunden, wodurch das Dentin zunehmend hyperleitfähig wurde.9 Die Dentinpermeabilität variiert und kann schnell abnehmen.10
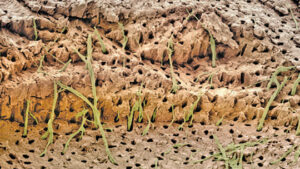
Die Belege für die hydrodynamische Theorie basieren auf In-vivo-Studien an Menschen und Tieren. Die Verteilung der Nerven in den Dentintubuli variiert, wobei etwa 40% über den Pulpahörnern und ein geringerer Prozentsatz im zervikalen Dentin auftreten. Es scheint, dass offene Dentintubuli notwendig sind, damit exponiertes Dentin empfindlich wird (Abbildung 1, Seite 18); Tatsächlich nimmt die Empfindlichkeit eines Patienten proportional zur Anzahl der vorhandenen großen, offenen Tubuli zu. Offene Tubuli weisen eine hohe hydraulische Leitfähigkeit auf; Umgekehrt nimmt der Flüssigkeitsfluss ab, wenn die Tubuli blockiert sind. Dies bietet ein Mittel für verschiedene Behandlungsmöglichkeiten. Magloire et al11 geben an, dass äußere Reize zu einer Bewegung der Dentinflüssigkeit führen und dass Odontoblasten und / oder Nervenkomplexreaktionen ein charakteristisches mechanosensorisches System sein können — eine neue Rolle für Odontoblasten als Sensorzellen. Der Informationstransfer zwischen Odontoblasten und Axonen kann das Ergebnis von Mediatoren im Spaltraum zwischen Odontoblasten und Axonen sein, wie durch noziozeptiv transduzierende Rezeptoren und trigeminale afferente Fasern und die Expression angeblicher Effektoren durch Odontoblasten belegt (Abbildung 2).11
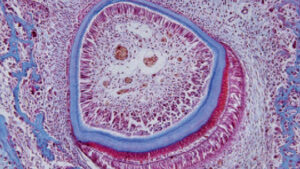
, die das Dentin (dünne blaue Schicht) ablegen, das den größten Teil des Zahns ausmacht. Emaille (dickere blaue Schicht) wird von Ameloblasten gebildet, einer Schicht länglicher Zellen um die Außenseite des Zahnschmelzes.
MÖGLICHE URSACHEN
Parodontitis, Zahnfleischschwund, rissige Zähne, Erosion, Abrieb, Abfraktion und Zahnbruch können Überempfindlichkeit verursachen. Alle diese Bedingungen führen zu exponiertem Dentin, das eine Umgebung schafft, in der Reize eine Bewegung der Dentinrohrflüssigkeit verursachen, die Nervenfasern aktiviert und Schmerzen verursacht. Das freiliegende Dentin kann aus der Entfernung von Zervixzement während der Skalierung und Wurzelhobeln, Finishing und Polieren von Restaurationen oder extreme Zahnbürsten — vor allem nach der Einnahme von sauren Speisen oder Getränken – resultieren. Regurgitation bei Patienten mit Bulimie führt zu einer Säureexposition, und das anschließende Zähneputzen kann zum Verlust der Zahnstruktur führen.1 Schmerzen können lokalisiert oder allgemein sein und eine Vielzahl von Zahnoberflächen betreffen, entweder zusammen oder einzeln.12
Wie bereits erwähnt, unterliegen Patienten mit Parodontitis einer dentinalen Überempfindlichkeit.13 Studien zeigen, dass die Inzidenz von Überempfindlichkeitsreaktionen eine Woche nach der Parodontalchirurgie zunimmt und nach acht Wochen abklingt.14,15 Jüngere Patienten zeigen eine höhere Sensitivität im Vergleich zu älteren Erwachsenen, bei denen die Sensitivität länger dauert. Skalierung und Wurzelhobeln können auch mehrere Tage nach der Behandlung zu Empfindlichkeit führen.
Zahnfleischrezession führt zur Freilegung von Wurzeloberflächen und möglicher Empfindlichkeit. Bukkaler Knochen liefert den größten Teil der Blutversorgung für die bukkale Gingiva, und jeder Verlust von bukkalem Knochen führt zu einer Abnahme der Gingiva.14 Dünner oder fenestrierter Knochen, Zahnanatomie, Zahnposition oder kieferorthopädische Bewegung können zu einer Rezession führen. Übermäßiges Zähneputzen mit Zahnputzmitteln kann ebenfalls zu einer Rezession führen.15 Die Anzeichen und Symptome von rissigen Zähnen können je nach Schweregrad variieren. Die Patienten werden in der Regel akute Schmerzen beim Kauen verspüren, aber nach Entfernung des Reizes klingen die Schmerzen ab. Wenn sich der Schmerz auf die Pulpa oder das Parodontalband ausdehnt, bleibt er bestehen.16
Erosion ist definiert als Verlust des Zahnschmelzes durch chemische Auflösung durch Säuren, die nicht bakteriellen Ursprungs sind. Es gibt drei Arten von Erosion: extrinsische (z. B. Ernährung, Lebensstil oder Umwelt), intrinsische (z. B. Magensäure) und idiopathische.17 Die unionisierte Säure diffundiert in die interprismatischen Bereiche des Zahnschmelzes und löst das Mineral im Untergrund auf.18 Im Anfangsstadium ist die Zahnoberfläche aufgrund der Demineralisierung stumpf, der Zahn ist jedoch nicht überempfindlich, da das Dentin mit offenen Tubuli nicht freiliegt. Komposit kann verwendet werden, um den Zahnschmelz zu versiegeln, um die normale Kontur wiederherzustellen und die Dentinexposition zu verhindern.19 Die Wiederherstellung des Zahnes verbessert die Mundhygiene und reduziert mögliche Pulpabeteiligung, Zahnbürsten- / Zahnputzmittelabrieb und Säureerosion.20
Abrieb ist der Verlust der Zahnstruktur durch mechanische Kräfte von einem fremden Element, und es kann Empfindlichkeit verursachen.21 Abrieb ist ein Zahn-zu-Zahn-Kontakt, der aus einer okklusalen Funktion oder Parafunktion — wie Bruxismus — resultiert und zu einem Verlust der Zahnstruktur an den okklusalen Oberflächen und Inzisalkanten führen kann.22
Die Rolle der Abfraktion in der Ätiologie der Dentinüberempfindlichkeit ist umstritten. Eine Abfraktion kann auftreten, wenn eine unverhältnismäßige zyklische, nichtaxiale Zahnbelastung zu einer Beugung der Höcker und einer Konzentration von Spannungen im anfälligen zervikalen Bereich der Zähne führt. Diese durch okklusale Belastungen verursachten zervikalen Läsionen führen zu einer Schwächung der zervikalen Zahnstruktur und können dazu führen, dass Zahnschmelz, Zement oder Dentin vom zervikalen Aspekt abplatzen.23 Lee und Eakle24 beschrieben zuerst Läsionen, die aus Zugspannungen resultieren können. Sie stellten fest, dass sich eine Abfraktionsläsion häufig am oder in der Nähe des Drehpunkts im Bereich mit der größten Zugspannungskonzentration befindet; Es ist typischerweise keilförmig und zeigt eine Größe, die proportional zum Grad und zum Auftreten der aufgebrachten Zugkraft ist.
Andere behaupten jedoch, dass es nur begrenzte Beweise gibt, die die Abfraktion als Hauptursache für das, was heute als nichtkariöse zervikale Läsionen bezeichnet wird, unterstützen. Die nichtkaren Prozesse, die zum Verlust von hartem Gewebe im zervikalen Bereich führen, scheinen multifaktoriell zu sein und können Abrieb, saure Prozesse und möglicherweise Abfraktion umfassen.23 Während die verfügbaren Beweise darauf hindeuten, dass sich diese Läsionen aus Kräften, einschließlich Okklusionskräften, entwickeln können, die allein oder in Kombination wirken,23 sind zusätzliche Studien gerechtfertigt, um die genaue Rolle der Abfraktion bei nichtkariösen Läsionen und die damit verbundene Empfindlichkeit zu bestimmen.
Zusätzlich zu diesen Quellen verursacht Zahnaufhellung häufig eine Dentinüberempfindlichkeit. Die Verwendung von Wasserstoffperoxid oder Carbamidperoxid kann durch Schmelz und Dentin in die Pulpa eindringen. Die Glutathionperoxidase und Katalase in der Pulpa haben nicht genug Zeit, um das Wasserstoffperoxid zu inaktivieren, was zu Empfindlichkeit führen kann. Es sollte auch beachtet werden, dass alle Bleichgele hypertonisch sind und osmotisch Wasser aus der Pulpa durch das Dentin und den Zahnschmelz zum Aufheller ziehen. Dies kann möglicherweise intradent Nerven stimulieren.25
BEHANDLUNGSOPTIONEN
Ärzte können eine Vielzahl von Behandlungen für den Heimgebrauch oder im Büro empfehlen (siehe Tabelle 1 für ein Flussdiagramm der Behandlungsoption).26 Der Wirkungsmechanismus ist typischerweise die Desensibilisierung von Nerven, die Proteinfällung, das Verstopfen von Dentintubuli, das Versiegeln von Dentin oder das Abtragen von Dentin mit einem Laser. Die am häufigsten verwendeten Therapien umfassen entzündungshemmende Mittel, Proteinfällungsmittel, Tubulusverschlussmittel und Tubulusverdichtungsmittel. Der konservativste Ansatz sollte zunächst umgesetzt werden, wobei aggressivere Behandlungen vorgeschlagen werden, wenn keine Linderung erreicht wird.27
TABELLE 1. Strategien zur Behandlung der dentinalen Überempfindlichkeit26 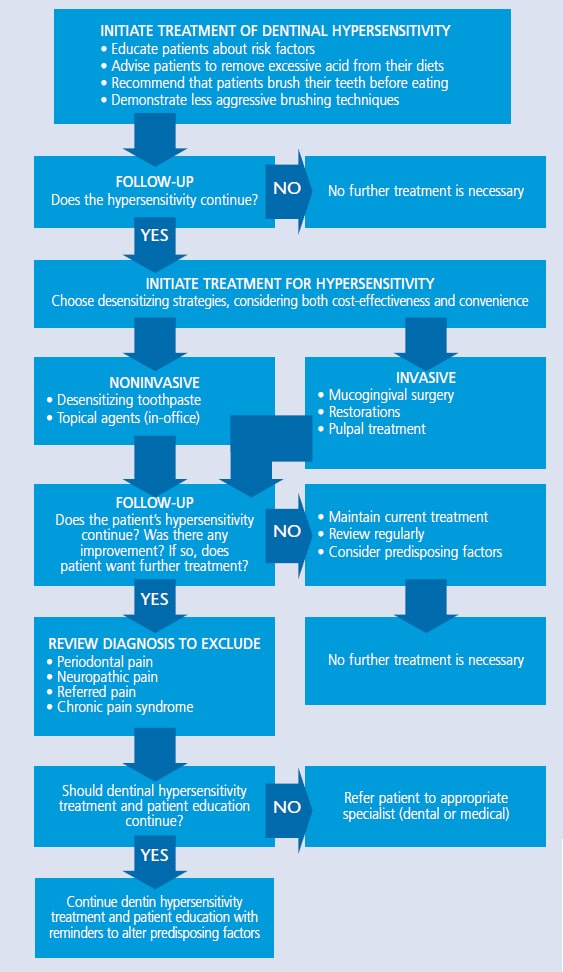 Als erste Verteidigungslinie gegen Empfindlichkeit können Kliniker ein Zahnpflegemittel mit Kaliumsalzen (z. B. Kaliumnitrat, Kaliumchlorid oder Kaliumcitrat), Strontiumsalzen (z. B. Strontiumchlorid oder Strontiumacetat) oder Fluorid empfehlen. Kaliumionen diffundieren entlang der Dentintubuli, die die Nervenwirkung blockieren und die mit Überempfindlichkeit verbundenen Schmerzen dämpfen. Kaliumsalz-Zahnputzmittel sind wirksam, erfordern jedoch möglicherweise zwei Wochen konsequente Anwendung, damit die Patienten die Auswirkungen spüren.28 Im Vergleich dazu ist die Wirkungsweise von Strontiumsalz-Zahnpflegemitteln oder Fluorid die Tubulus-Okklusion. Fluorid in verschiedenen Formen ist eine wirksame Strategie zur Linderung der Empfindlichkeit zu Hause. Natriumfluorid, Zinnfluorid und Natriummonofluorophsophat blockieren alle Dentintubuli und verringern die Empfindlichkeit. Verschreibungspflichtige Fluorid-Zahnputzmittel und Tray-Anwendung können ebenfalls hilfreich sein.29calciumphosphat-Technologien sind eine weitere Option zur Behandlung von Überempfindlichkeit. Amorphes Calciumphosphat stellt Calcium- und Phosphationen im Speichel zur Verfügung, um die Remineralisierung zu beschleunigen, und kann dazu beitragen, die durch Bleichen verursachte Empfindlichkeit zu minimieren. Es ist in Gel- und Whitening-Produkten erhältlich.29 Darüber hinaus können Produkte, die Caseinphosphopeptid-amorphes Calciumphosphat (CPP-ACP) enthalten, verwendet werden, um Dentintubuli teilweise zu verschließen. Obwohl die Vorbehandlung mit einem Desensibilisierungsmittel manchmal die restaurative Bindung beeinträchtigt, ergab eine Studie von Borges et al30, dass eine Paste mit CPP-ACP die Haftfestigkeit nicht negativ beeinflusste und in einigen Fällen verbesserte. Calcium-Natrium-Phosphosilikat kann ebenfalls bei der Infiltration und Remineralisierung von Tubuli helfen. Das Siliciumdioxid im Material dient als Keimbildungsposition für die Ausfällung von Calcium und Phosphat.31 Tricalciumphosphat (TCP) ist die jüngste Ergänzung der Familie der Calciumphosphattechnologien. TCP sorgt für eine langsame Freisetzung von Kalzium an die Zahnoberfläche und soll die remineralisierende Wirkung von Fluorid verstärken, was auch die Empfindlichkeit verringern kann. Es ist in einem verschreibungspflichtigen Zahnpflegemittel und Fluoridlack erhältlich.32
Als erste Verteidigungslinie gegen Empfindlichkeit können Kliniker ein Zahnpflegemittel mit Kaliumsalzen (z. B. Kaliumnitrat, Kaliumchlorid oder Kaliumcitrat), Strontiumsalzen (z. B. Strontiumchlorid oder Strontiumacetat) oder Fluorid empfehlen. Kaliumionen diffundieren entlang der Dentintubuli, die die Nervenwirkung blockieren und die mit Überempfindlichkeit verbundenen Schmerzen dämpfen. Kaliumsalz-Zahnputzmittel sind wirksam, erfordern jedoch möglicherweise zwei Wochen konsequente Anwendung, damit die Patienten die Auswirkungen spüren.28 Im Vergleich dazu ist die Wirkungsweise von Strontiumsalz-Zahnpflegemitteln oder Fluorid die Tubulus-Okklusion. Fluorid in verschiedenen Formen ist eine wirksame Strategie zur Linderung der Empfindlichkeit zu Hause. Natriumfluorid, Zinnfluorid und Natriummonofluorophsophat blockieren alle Dentintubuli und verringern die Empfindlichkeit. Verschreibungspflichtige Fluorid-Zahnputzmittel und Tray-Anwendung können ebenfalls hilfreich sein.29calciumphosphat-Technologien sind eine weitere Option zur Behandlung von Überempfindlichkeit. Amorphes Calciumphosphat stellt Calcium- und Phosphationen im Speichel zur Verfügung, um die Remineralisierung zu beschleunigen, und kann dazu beitragen, die durch Bleichen verursachte Empfindlichkeit zu minimieren. Es ist in Gel- und Whitening-Produkten erhältlich.29 Darüber hinaus können Produkte, die Caseinphosphopeptid-amorphes Calciumphosphat (CPP-ACP) enthalten, verwendet werden, um Dentintubuli teilweise zu verschließen. Obwohl die Vorbehandlung mit einem Desensibilisierungsmittel manchmal die restaurative Bindung beeinträchtigt, ergab eine Studie von Borges et al30, dass eine Paste mit CPP-ACP die Haftfestigkeit nicht negativ beeinflusste und in einigen Fällen verbesserte. Calcium-Natrium-Phosphosilikat kann ebenfalls bei der Infiltration und Remineralisierung von Tubuli helfen. Das Siliciumdioxid im Material dient als Keimbildungsposition für die Ausfällung von Calcium und Phosphat.31 Tricalciumphosphat (TCP) ist die jüngste Ergänzung der Familie der Calciumphosphattechnologien. TCP sorgt für eine langsame Freisetzung von Kalzium an die Zahnoberfläche und soll die remineralisierende Wirkung von Fluorid verstärken, was auch die Empfindlichkeit verringern kann. Es ist in einem verschreibungspflichtigen Zahnpflegemittel und Fluoridlack erhältlich.32
IN-OFFICE-ANWENDUNG
Einfache In-Office-Therapien können bei der Bewältigung der Empfindlichkeit hilfreich sein. Kliniker können eine desensibilisierende Prophylaxepaste auftragen, die mit 8% Arginin und Calciumcarbonat formuliert ist, um Tubuli mit Pfropfen aus Arginin, Calcium, Phosphat und Carbonat zu verschließen. Es hat sich gezeigt, dass es normalen Pulpadruck und sauren Herausforderungen standhält, erfolgreich Minimieren des Dentintubulusflüssigkeitsflusses und, somit, Empfindlichkeit,33 ohne die Haftfestigkeit zu beeinträchtigen.34
Fluoridlack ermöglicht die langsame und kontinuierliche Freisetzung von Fluorid. Lacke bieten ein natürliches Vehikel auf Harzbasis für Fluorid. Calciumfluorid lagert sich auf der Zahnoberfläche ab, was zur Bildung von Fluorapatit führt. Die Zugabe von Kaliumoxalat bewirkt die Bildung von säurebeständigem Calciumoxalat nach Reaktion mit dem Calcium von Dentin.35 Extended-Contact Varnish ist ein photohärteter Fluoridlack, der zur Verringerung der Dentinüberempfindlichkeit eingesetzt werden kann. Es besteht aus einem harzmodifizierten Glasionomer, das Glycerophosphat mit Fluoridfreisetzung enthält. Es fördert auch die Bildung von Harzmarken und ermöglicht einen sofortigen und langfristigen Verschluss der Tubuli. Ein weiteres Lackprodukt kombiniert 5% Glutaraldehyd und 35% Hydroxyethylmethacrylat. Es wirkt als biologisches Fixiermittel und erzeugt eine Koagulation von Plasmaproteinen in den Tubuli, wodurch die Öffnungen blockiert werden. Kann die Empfindlichkeit für mindestens drei Monate verringern,,sup>36 es kann säuregeätztes und feuchtes Dentin infiltrieren. Diese Lacke sind mit Klebstoffen, Zementen sowie Restaurations- und Kernaufbaumaterialien kompatibel.37
Chlorhexidinlack bildet nach dem Trocknen eine mechanische Barriere, die die Empfindlichkeit verringert und gleichzeitig eine antiplake und antibakterielle Wirkung bietet.38
Es wurde auch gezeigt, dass Oxalate die Dentinpermeabilität verringern und Tubuli blockieren.39 Das Oxalat reagiert mit den Calciumionen im Dentin unter Bildung von Calciumoxalatkristallen in Tubuli und an der Oberfläche. Der Effekt wird jedoch mit der Zeit reduziert, da die Kristalle durch Bürsten und diätetische Säuren entfernt werden. Ätzen verbessert die Infiltration von Calciumoxalatkristallen in die Tubuli.39
Kliniker können auch einen lichthärtenden Desensibilisator verwenden, der die Empfindlichkeit durch die Reaktion des Monomers mit Kalzium im Zahn und die Bildung von Harzmarkierungen verringert, was zu einem Tubulusverschluss führt. Ein Aushärtelicht polymerisiert anschließend die Harzschicht. Es kann zur sofortigen Dentinversiegelung präparierter Zähne verwendet werden.
INVASIVE BEHANDLUNGSOPTIONEN
Wenn weniger invasive Therapien nicht wirksam sind, können Verklebungen, Transplantationen und Laserbehandlungen eine Linderung der Dentinüberempfindlichkeit bewirken. Bindemittel können verwendet werden, um gleichzeitig zu desensibilisieren und zu binden.40 Je nach verwendetem Produkt ist ein potenzieller Nachteil dieses Ansatzes die Notwendigkeit von Phosphorsäure vor dem Einbringen des Bindemittels, was die Verwendung von Anästhesie erfordern kann.
Alternativ kann ein selbstätzender Klebstoff verwendet werden. Ein weiteres verfügbares Bindemittel blockiert Dentintubuli und enthält Triclosan, um die Plaquebildung zu minimieren.41 Eine alternative Art der Desensibilisierung besteht darin, freiliegende Wurzeloberflächen mit Pfropfen zu bedecken. Dies sollte jedoch vor den Verbindungstechniken in Betracht gezogen werden, da verbundene Restaurationen ein erfolgreiches Transplantat ausschließen können.42 Die Verwendung von Nd:YAG-Laser bieten Wärmeenergieabsorption auf Dentin, was zu Okklusion oder Verengung der Dentintubuli führen kann.39,43
ZUSAMMENFASSUNG
Dentinale Überempfindlichkeit wird durch exponiertes Dentin verursacht, in dem Reize eine Bewegung der Dentintubulusflüssigkeit auslösen, die Nervenfasern aktiviert, um Schmerzen zu verursachen. Die Beziehung zwischen oberflächen- und intratubulärer Präzipitation und Mäßigung der Empfindlichkeit ist nicht einfach. Es ist nicht die Menge des Niederschlags, sondern die Qualität, Dichte, Porosität, Eindringtiefe und Stärke der Befestigung am Dentin, die die Ergebnisse beeinflussen.40 Letztendlich hängt die Wirksamkeit der Behandlung davon ab, wie lange die Verminderung oder Elimination anhält.
Behandlungsentscheidungen sollten auf dem Schweregrad und der Ätiologie der Dentinüberempfindlichkeit beruhen. Einige Behandlungen im Büro bringen sofortige Linderung, die mit einer Vielzahl von Hausmitteln verfolgt werden kann. Eine Kombination von Techniken kann gerechtfertigt sein, um eine langfristige Linderung zu erzielen.
WICHTIGE ERKENNTNISSE
-
- Die hydrodynamische Theorie ist die am häufigsten vereinbarte Ursache für Dentinüberempfindlichkeit.
- Offene Dentintubuli weisen eine hohe hydraulische Leitfähigkeit auf und tragen so zur Empfindlichkeit bei; umgekehrt nimmt der Flüssigkeitsfluss ab, wenn die Tubuli blockiert sind. Dies bietet ein Mittel für verschiedene Behandlungsansätze.
- Die Prävalenz dieser Erkrankung ist bei Frauen etwas höher,3 wobei Eckzähne und Prämolaren beider Bögen am häufigsten betroffen sind.4
- Typischerweise sind Schmerzen durch Überempfindlichkeit lokalisiert und von kurzer Dauer; Dies unterscheidet sich von Pulpaschmerzen, die langwierig, dumpf, schmerzend, schlecht lokalisiert sind und länger anhalten als der angewendete Reiz.
- Die Verwendung eines Kofferdam kann hilfreich sein, wenn versucht wird, den oder die Zähne, die einer Überempfindlichkeit unterliegen, zu isolieren.
- Ärzte können eine Vielzahl von Therapien für den Heimgebrauch oder die Anwendung im Büro empfehlen. Die häufigsten Behandlungen umfassen entzündungshemmende Mittel, Proteinfällungsmittel, Tubulusverschlussmittel und Tubulusverdichtungsmittel.
- Behandlungsentscheidungen sollten auf dem Schweregrad und der Ätiologie der Empfindlichkeit basieren, und eine Kombination von Techniken kann gerechtfertigt sein, um eine wirksame Linderung zu erzielen.
-
-
- Addy M. Dentinüberempfindlichkeit: Neue Perspektiven auf ein altes Problem. Int Dent J.2002;52:367-375.
- Addy M. Ätiologie und klinische Implikationen der Dentinüberempfindlichkeit. Dent Clin Norden Am. 1990;34:503–514.
- Flyn J, Galloway R, Orchardson R. Die Inzidenz von überempfindlichen Zähnen im Westen Schottlands. J Dent. 1985;13:230–236.
- Addy M, Mostafa P, Newcombe RG. Dentinüberempfindlichkeit: Die Verteilung von Rezession, Empfindlichkeit und Plaque. J Dent. 1987;15:242–248.
- Dababneh RH, Khouri AT, Addy M. Dentinüberempfindlichkeit – ein Rätsel? Eine Überprüfung der Terminologie, Mechanismen, Ätiologie und Management. Br Dent J.1999;187:606-611.
- Holland GR, Narhi MN, Addy M, Gangarosa L, Orchardson R. Richtlinien für das Design und die Durchführung klinischer Studien zur Dentinüberempfindlichkeit. In: J Clin Periodontol. 1997;24:803–813.
- Li Y. Innovationen zur Bekämpfung der Dentinüberempfindlichkeit: aktueller Stand der Technik. Compend Contin Educ Dent. 2012;33(Ergänzung): 10-16.
- Kramer IRH. Die Beziehung zwischen Dentinempfindlichkeit und Bewegungen im Inhalt der Dentintubuli. Br Dent J. 1955;98: 391-392.
- Brännström M. Die Auslösung von Schmerzen in menschlichem Dentin und Pulpa durch chemische Reize. In: Arch Oral Biol. 1962;7:59–62.
- Pashley DH. Dentin-Predentin-Komplex und seine Permeabilität: physiologischer Überblick. J Dent Res. 1985;64(Ergänzung): 613-620.
- Magloire H, Maurin JC, Couble ML, et al. Aktuelle Überprüfung. Zahnschmerzen und Odontoblasten: fakten und Hypothesen. J Orofacial. 2010;24:335–349.
- Camilotti V, Zilly J, Nassar CA, Nassar PO. Desensibilisierungsbehandlungen bei Dentinüberempfindlichkeit: eine randomisierte klinische Studie mit geteiltem Mund. Braz Oral Res. 2012;26:263-268.
- Chabanski MB, Gillam DG, Bulman JS, Newman HN. Prävalenz der zervikalen Dentinempfindlichkeit in einer Population von Patienten, die an eine spezialisierte parodontologische Abteilung überwiesen wurden. In: J Clin Periodontol. 1996;23:989–992.
- Uchida A, Wakano Y, Fukuyama O, Miki T, Iwayama Y, Okada H. Kontrollierte klinische Bewertung eines 10% igen Strontiumchlorid-Zahnpflegemittels zur Behandlung von Dentinüberempfindlichkeit nach Parodontalchirurgie. In: J Periodontol. 1980;51:578–581.
- Absi EG, Addy M, Adams D. Dentinüberempfindlichkeit – die Wirkung von Zahnbürsten und diätetischen Verbindungen auf Dentin in vitro: eine SEM-Studie. In: J Oral Rehabil. 1992;19:101–110.
- Kahler W. Das Rätsel der gebrochenen Zähne: Terminologie, Klassifizierung, Diagnose und Management. Bin J Dent. 2008;21:275–282.
- Bartlett DW. Die Rolle der Erosion beim Zahnverschleiß: Ätiologie, Prävention und Management. Int. J. 2005;55(Ergänzung): 277-284.
- Zero DT, Lussi A. Erosion – chemische und biologische Faktoren von Bedeutung für den Zahnarzt. Int Dent J. 2005;55:285-290.
- Lambrechts P, Van Meerbeek B, Perdigão J, Gladys S, Braem M, Vanherle G. Restaurative Therapie für die erosive Läsion. In: Eur J Oral Sci. 1996;104:229–240.
- Grippo JO. Noncarious zervikale Läsionen: die Entscheidung zu ignorieren oder wiederherzustellen. J Esthet Dent. 1992;4:55–64.
- Abrahamsen TC. Das abgenutzte Gebiss – pathognomonische Muster von Abrieb und Erosion. Int. J. 2005;55(Ergänzend):268–276.
- McIntyre F. Wiederherstellung der Ästhetik und Frontzahnführung bei abgenutzten Frontzähnen. Ein konservativer multidisziplinärer Ansatz. J Am Dent Assoc. 2000;131:1279–1283.
- Michael JA, Townsend GC, Greenwood LF, Kaidonis JA. Abfraktion: Fakt von Fiktion trennen. Aust, J. 2009;54:2-8.
- Lee WC, Eakle WS. Mögliche Rolle der Zugspannung in der Ätiologie der zervikalen erosiven Läsionen der Zähne. J Prosthet Dent. 1984;52:374–380.
- Swift EJ Jr. Zahnempfindlichkeit und Zahnaufhellung. Compend Contin Dent Educ Dent.2005;26(Ergänzung): 4-10.
- Kanadischer Beirat für Dentinüberempfindlichkeit. Konsensbasierte Empfehlungen für die Diagnose und Behandlung von Dentinüberempfindlichkeit. J Kann Assoc Dent. 2003;69:221–226.
- Al-Saud LM, Al-Nahedh HN. Okkludierende Wirkung von Nd: YAG-Lasern und verschiedenen Dentin-Desensibilisierungsmitteln auf humane Dentintubuli in vitro: eine rasterelektronenmikroskopische Untersuchung. Oper Dent. 2012;37:340–355.
- Poulsen S, Errboe M, Hovgaard O, Worthington HW. Kaliumnitrat Zahnpasta für Dentin Überempfindlichkeit. Cochrane Database Syst Rev. 2001;2:CD001476.
- Orchardson R, Gillam DG. Verwalten von Dentin Überempfindlichkeit. J Dent Assoc. 2006;137:990–998.
- Borges B.C., Souza-Junior E.J., da Costa G.D., et al. Wirkung der Dentinvorbehandlung mit einer Casein phosphopeptideamorphen Calciumphosphat (CPP-ACP) Paste auf die Dentinbindungsfestigkeit in dreidimensionalen Kavitäten. In: Acta Odontol Scand. 2013;71:271–277.
- Forsback AP, Areva S, Salonen JI. Mineralisierung von Dentin induziert durch Behandlung mit bioaktivem Glas S53P4 in vitro. In: Acta Odontol Scand. 2004;62:14–20.
- Karlinsey RL, Mackey AC. Festkörperpräparation und dentale Applikation eines organisch modifizierten Calciumphosphats. J Mater Sci. 2009;44:346–349.
- Panagakos F, Schiff T, Guignon A. Dentinüberempfindlichkeit: wirksame Behandlung mit einer Desensibilisierungspaste im Büro, die 8% Arginin und Calciumcarbonat enthält. Bin J Dent. 2009;22(Suppl): 3A–7A.
- García-Godoy A, García-Godoy F. Wirkung einer 8,0% igen Arginin- und Calciumcarbonat-In-Office-Desensibilisierungspaste auf die Scherbindungsfestigkeit von Kompositen an menschlichem Zahnschmelz. Bin J Dent. 2010;23:324–326.
- Camilotti V, Zilly J, Busato G.u. M, Nassar CA, Nassar PO. Desensibilisierungsbehandlungen bei Dentinüberempfindlichkeit: eine randomisierte klinische Studie mit geteiltem Mund. Braz Oral Res. 2012;26:263-268.
- Sethna GD, Prabhulji MLV, Karthikeyan BV. Vergleich von zwei verschiedenen Formen von Lacken bei der Behandlung von Dentinüberempfindlichkeit: eine probandenblinde randomisierte klinische Studie. Mundgesundheit Prev Dent. 2011;9:143–150.
- Dijkman GE, Jongebloed WL, de Vries J, Ogaard B, Arends J. Schließen von Dentintubuli durch Glutaraldehydbehandlung, eine rasterelektronenmikroskopische Studie. Scand J Dent Res. 1994;102:144-150.
- Sköld-Larsson K, Sollenius O, Petersson LG, Twetman S. Wirkung topischer Anwendungen einer neuen Chlorhexidin-Thymol-Lackformel auf Mutans-Streptokokken und Kariesentwicklung in okklusalen Fissuren permanenter Molaren. J Clin Dent. 2009;20:223–226.
- Lan WH, Lee BS, Liu HC, Lin CP. Morphologische studie von Nd: YAG laser verwendung in der behandlung von dentin überempfindlichkeit. J Endod. 2004;30:131–134.
- Ide M, Morel Anzeige, Wilson RF, Ashley FP. Die Rolle eines Dentinbindemittels bei der Verringerung der Empfindlichkeit des zervikalen Dentins. In: J Clin Periodontol. 1998;25:286–290.
- Yu X, Liang B, Jin X, Fu B, Hannig M. Vergleichende In-vivo-Studie zur Desensibilisierungswirksamkeit von Dentindesensibilisatoren und selbstätzenden Klebstoffen mit einer Flasche. Oper Dent. 2010;35:279–286.
- Douglas von Oliveira DW, Marques DP, Aguiar-Cantuária IC, Flecha OD, Gonçalves PF. Wirkung der chirurgischen Defektabdeckung auf zervikale Dentinüberempfindlichkeit und Lebensqualität. In: J Periodontol. 2013;84:768–775.
- Orhan K, Aksoy U, Can-Karabulut DC, Kalender A. Low-Level-Lasertherapie bei Dentinüberempfindlichkeit: eine kurzfristige klinische Studie. Laser Med Sci. 2011;26:591–598.
-