Ionische Elektrolyte
Wasser und andere polare Moleküle werden von Ionen angezogen, wie in Abbildung \(\pageIndex{2}\) gezeigt. Die elektrostatische Anziehung zwischen einem Ion und einem Molekül mit einem Dipol wird als Ionen-Dipol-Anziehung bezeichnet. Diese Verbindungen spielen eine wichtige Rolle bei der Auflösung ionischer Verbindungen in Wasser.
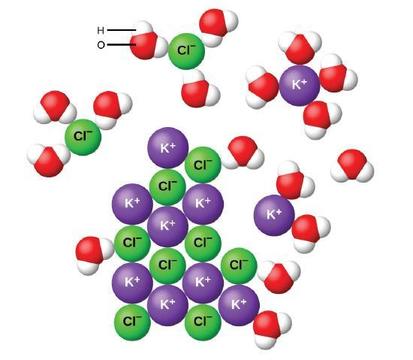
Wenn sich ionische Verbindungen in Wasser auflösen, trennen sich die Ionen im Feststoff und verteilen sich gleichmäßig in der Lösung, da Wassermoleküle die Ionen umgeben und lösen, wodurch die starken elektrostatischen Kräfte zwischen ihnen verringert werden. Dieser Prozess stellt eine physikalische Veränderung dar, die als Dissoziation bekannt ist. Unter den meisten Bedingungen dissoziieren ionische Verbindungen beim Auflösen fast vollständig und werden daher als starke Elektrolyte eingestuft.
Betrachten wir, was auf mikroskopischer Ebene passiert, wenn wir festes KCl zu Wasser geben. Ionendipolkräfte ziehen das positive (Wasserstoff-) Ende der polaren Wassermoleküle zu den negativen Chloridionen an der Oberfläche des Festkörpers und sie ziehen die negativen (Sauerstoff-) Enden zu den positiven Kaliumionen an. Die Wassermoleküle dringen zwischen einzelne K+ − und Cl- -Ionen ein und umgeben sie, wodurch die starken interionischen Kräfte, die die Ionen miteinander verbinden, reduziert werden und sie als solvatisierte Ionen in Lösung gehen, wie Abbildung zeigt. Die Verringerung der elektrostatischen Anziehung ermöglicht die unabhängige Bewegung jedes hydratisierten Ions in einer verdünnten Lösung, was zu einer Zunahme der Unordnung des Systems führt, wenn die Ionen von ihren festen und geordneten Positionen im Kristall in bewegliche und viel ungeordnetere Zustände in Lösung übergehen. Diese erhöhte Störung ist verantwortlich für die Auflösung vieler ionischer Verbindungen, einschließlich KCl, die sich unter Wärmeaufnahme auflösen.
In anderen Fällen sind die elektrostatischen Anziehungen zwischen den Ionen in einem Kristall so groß, oder die Ionendipolanziehungskräfte zwischen den Ionen und den Wassermolekülen sind so schwach, dass die Zunahme der Unordnung die Energie nicht ausgleichen kann, die erfordert wird, um die Ionen zu trennen, und der Kristall unlöslich ist. Dies ist der Fall für Verbindungen wie Calciumcarbonat (Kalkstein), Calciumphosphat (die anorganische Komponente von Knochen) und Eisenoxid (Rost).