Reaktionen in Lösung, die nicht katalysiert werden, sind langsam, da Ladungsentwicklung und -trennung im Übergangszustand auftreten. Wenn Bindungen hergestellt oder gebrochen werden, werden häufig geladene Zwischenprodukte gebildet, deren Energie höher ist als die der Reaktanten. Da das Zwischenprodukt eine höhere Energie aufweist als die Reaktanten, wäre der Übergangszustand noch energiereicher und ähnelt daher eher dem geladenen Zwischenprodukt. Alles, was die Ladungen auf dem Zwischenprodukt und damit die sich entwickelnden Ladungen in den Übergangszuständen stabilisieren kann, senkt die Energie des Übergangszustands und katalysiert die Reaktion. In diesem Abschnitt werden wir den Mechanismus untersuchen, der der Katalyse chemischer Reaktionen durch kleine Moleküle zugrunde liegt. Vermutlich werden biologische makromolekulare Katalysatoren (wie Proteinenzyme) ähnliche Mechanismen in ihren katalytischen Wirkungen verwenden (was im nächsten Abschnitt besprochen wird).
Katalysatoren, einschließlich Enzyme, können mindestens 5 verschiedene Wege zur Stabilisierung von Übergangszuständen anwenden.
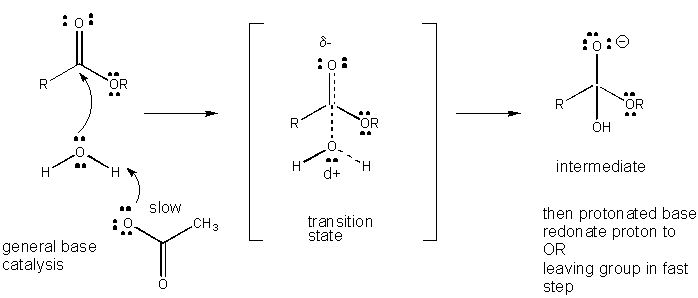
Die Ladungsentwicklung im TS kann entweder durch Spende eines Protons von allgemeinen Säuren (wie Essigsäure oder einem protonierten Indolring) an ein Atom wie ein Carbonyl-O verringert werden, das eine teilweise negative Ladung im TS entwickelt, wenn es durch ein Nukleophil gebunden wird. Die Protonenspende verringert das sich entwickelnde Negativ im TS. Alternativ kann ein Nukleophil wie Wasser, das eine teilweise positive Ladung im TS entwickelt, wenn es beginnt, eine Bindung an ein elektrophiles C in einem Carbonyl zu bilden, durch die Anwesenheit einer allgemeinen Base (wie Acetat oder der deprotonierte Indolring) stabilisiert werden. Protonenabstraktion verringert die sich entwickelnde positive Ladung
Abbildung: LADUNGSENTWICKLUNG IM ÜBERGANGSZUSTAND DER ESTERHYDROLYSE
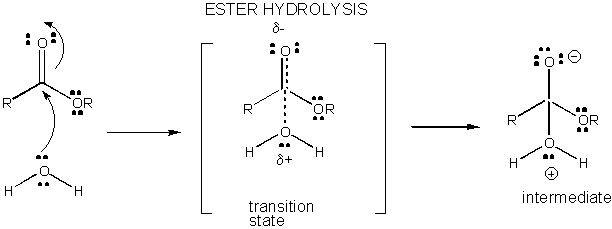
Abbildung: MECHANISMUS DER ALLGEMEINEN SÄUREKATALYSE
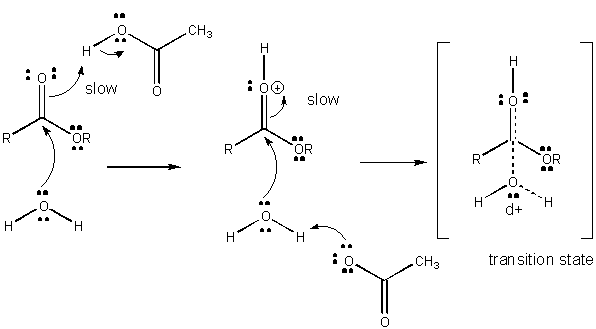
Abbildung: MECHANISMUS DER ALLGEMEINEN BASISKATALYSE
Mitwirkende und Zuschreibungen
- Prof. Henry Jakubowski (College of St. Benedict/St. John’s University)