Dimethyl Sulfoxide Oxidations
Dimethyl sulfoxide-based oxidation of primary alcohols to aldehydes or secondary alcohols to ketones is a mild method that does not depend upon heavy metal oxidants. Here is a brief, chronological history of the procedure.
Index:
-
Swern Oxidation (trifluoroacetic anhydride)
-
Swern Oxidation (oxalyl chloride)
Kornblum Oxidation: (1959) Ein primäres Tosylat wird bei 150o erhitzt, um eine SN2-Verdrängung durch den Sauerstoff von Dimethylsulfoxid (DMSO) in Gegenwart von NaHCO zu verursachen3. Der damals akzeptierte Mechanismus war eine E2-Eliminierung, wie gezeigt. Dimethylsulfid (DMS) ist das Reduktionsprodukt der Reaktion. Diese Arbeit bildete das Tosylat aus dem Alkyliodid mit Silbertosylat. Vermutlich kann das Tosylat aus dem Alkohol hergestellt werden, was ein direkterer Weg ist. Der Nachteil des Verfahrens ist die erhöhte Temperatur, obwohl die Kontaktzeit nur wenige Minuten beträgt. Das wesentliche Problem besteht darin, eine Methode zur Erzeugung des Sulfenatsalzes zu finden.

Barton-Modifikation: (1964) Barton und Mitarbeiter konnten Sulfenatsalze erzeugen, indem sie Chlorameisensäurealkylester mit DMSO unter Verlust von CO2 behandelten. Die Zugabe von Triethylamin erzeugt das Oxidationsprodukt. Dieses Verfahren verbesserte die harten Bedingungen des Kornblum-Verfahrens. Außerdem ist das Chlorameisensäureester durch Behandlung des zu oxidierenden Alkohols mit überschüssigem Phosgen leicht zugänglich.

Moffatt-Pfitzner Oxidation: (1963) Diese Variante einer Dimethylsulfoxid-basierten Oxidation wurde bei Syntex entwickelt. Der Aktivator wird durch Protonierung von Dicyclohexylcarbodiimid (1, DCC) hergestellt, das von Dimethylsulfoxid angegriffen wird. Zwischenprodukt 2 wird wieder protoniert, um die Addition des Alkoholsauerstoffs an das Schwefelatom zu erleichtern. Zusammen mit dem Sulfenatsalz 3 wird stabiler Dicyclohexylharnstoff 4 gebildet. Diese Spezies erleidet unter dem Einfluss des Dihydrogenphosphatanions eine Reaktion auf die Carbonylverbindung. Obwohl Phosphorsäure ein wirksamer saurer Katalysator für diese Reaktion ist, sind Schwefelsäure, Chlorwasserstoff und Trifluoressigsäure dies nicht. Pyridiniumtrifluoracetat ist jedoch ein wirksamer Katalysator. Es ist entscheidend, dass die konjugierte Base der Säure basisch genug ist, um den letzten Schritt der Reaktion zu bewirken.

Torrsell-Mechanismus: (1966) Der schwedische Chemiker Torrsell zeigte, dass der Mechanismus dieser DMSO-basierten Oxidationen nicht über eine intermolekulare β-Elimination abläuft. Die Elimination ist ein intramolekularer Prozess. Sulfenatsalz 5 wurde nach der Moffatt-Pfitzner-Vorschrift (s.o.) hergestellt. Bei Anwendung des Kornblum-Mechanismus wäre das erhaltene Dimethylsulfid frei von Deuterium (Versuch 1). Es wurde jedoch Dimethylsulfid-d1 (7) erhalten. Dieses Ergebnis stimmt mit einer Base überein, die die Methylgruppe deprotoniert, die an Schwefel gebunden ist und Ylid 6 bildet. Das Ylid zersetzt sich durch intramolekulare Deprotonierung zu den beobachteten Produkten.
Experiment 1:

Um diesen Mechanismus zu bestätigen, wurde das Deuterium als DMSO-d6 in DMSO eingebaut. Die Reaktion ergab demnach Dimethylsulfid-d5(12) und unduterierten Aldehyd 11 (Versuch 2).
Experiment 2:

Parikh-Doering-Oxidation: (1967) Diese Oxidation nutzt den Pyridin-Schwefeltrioxid-Komplex (13) als Aktivator von Dimethylsulfoxid. Sulfat ist die Abgangsgruppe in der Verdrängung durch den Alkohol (primär oder sekundär) in Intermediat 14. Sulfenat 15 wird durch den intramolekularen Mechanismus (vide supra) zu einem Aldehyd oder Keton zersetzt.

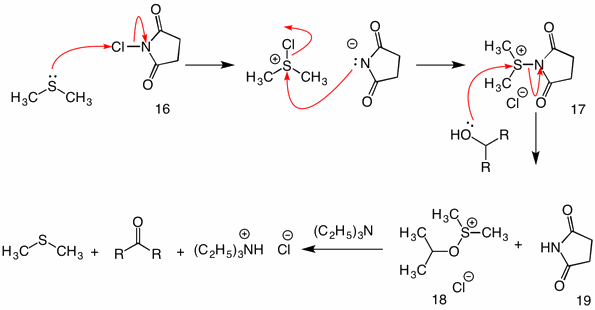
Corey-Kimberly: (1972) Bei diesem Verfahren wird Dimethylsulfid mit N-Chlorsuccinimid (16) aktiviert (oxidiert), um Reagenz 17 bereitzustellen. Bei der Reaktion dieser Spezies mit einem Alkohol fungiert die Succinimidylgruppe als Abgangsgruppe. Das übliche Sulfenat-Intermediat 18 kollabiert durch den intramolekularen Mechanismus bei der Zugabe von Triethylamin.
Swern-Oxidation: (1976) Diese frühe Swern-Oxidation verwendet Trifluoressigsäureanhydrid (20) bei -50oC, um Dimethylsulfoxid zu aktivieren. Die Zugabe des Alkohols zum Zwischenprodukt 21 liefert das gewünschte Sulfenat 22. Das Keton oder Aldehyd wird in üblicher Weise mit Triethylamin hergestellt.

Swern-Oxidation: (1978) Dieses spätere Swern-Verfahren ist eine bequeme Methode zur Herstellung von Reagenz 24 ohne Verwendung von Dimethylsulfid und Chlor. Dimethylsulfoxid, das sich auf dem gleichen Oxidationsniveau wie Salz 24 befindet, reagiert mit Oxalylchlorid (23) unter Freisetzung von Kohlenmonoxid, Kohlendioxid und Reagenz 24. Die Zugabe des primären oder sekundären Alkohols mit anschließender Deprotonierung von Sulfenat 25 mit Triethylamin führt zum gewünschten Aldehyd bzw. Keton.
