- Protokolle
- Hybridomproduktion
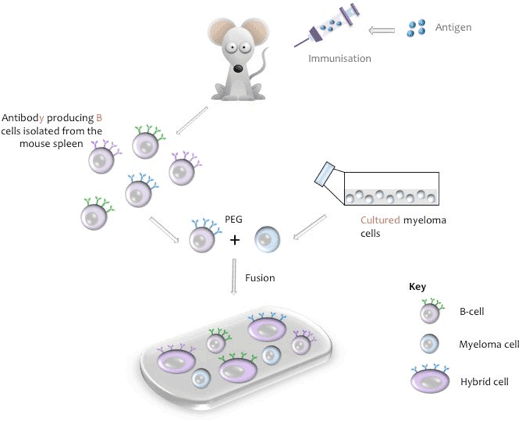
- Schematische Darstellung der Zellfusion
- Benötigte Ausrüstung
- Medium und andere Reagenzien (Siehe Anhang A für weitere Details)
- Bevor Sie beginnen (siehe Anhang A für weitere Details)
- Auftauen und wachstum der myelom zellen
- Der Fusionsprozess
- Drei Tage vorher – Bereiten Sie die Myelomzellen für die Fusion vor
- Einen Tag vorher – das Medium vorbereiten
- Tag der Fusion
- Tag nach der Fusion
- Anhang I
Protokolle
Hybridomproduktion
Ein Hybridom ist eine Zelllinie, die aus einer Hybridzelle hervorgeht und in der Lage ist, einen monoklonalen Antikörper, der für ein Epitop Ihres Antigens spezifisch ist, dauerhaft in Kultur abzusondern. Die Hybridzelle wird durch die Fusion spezifischer Antikörper produzierender B-Zellen eines immunisierten Tieres (üblicherweise Maus, Ratte oder Kaninchen) mit einer Zelle aus einer „unsterblichen“ kultivierten Myelomzelllinie (z.B. Maus NS-1 oder NS-0) hergestellt.
Herstellung einer Maushybridzelle
Während des Fusionsprozesses werden B-Zellen aus der Mausmilz isoliert, mit der Mausmyelomzelllinie vermischt und die Fusion mit Polyethylenglykol (PEG, siehe Anhang I) induziert. (Die relevante Myelomlinie wird verwendet, wenn B-Zellen aus anderen Tierarten verwendet werden). Die resultierenden Hybridome werden dann in Gewebekulturmedium kultiviert, das Hypoxathin, Aminopterin, Thymidin (HAT) enthält, ein Schritt, der alle nicht fusionierten Myelomzellen abtötet, die den anderen schwächeren Hybridomzellen entwachsen könnten. Unfusionierte B-Zellen haben eine begrenzte Teilungsfähigkeit und sterben in der Kultur auf natürliche Weise ab. Zehn Tage nach dem Fusionsprozess wird Kulturüberstand gesammelt und auf das Vorhandensein des gewünschten Antikörpers getestet.
Schematische Darstellung der Zellfusion
Benötigte Ausrüstung
- Eine sterile Umgebung zur Vorbereitung und Handhabung von Zellen (Laminar Flow oder Klasse II-Schrank)
- Ein Inkubator auf 37ºC mit 5% CO2 und einer Luftfeuchtigkeit von 95%
- Ein invertiertes Mikroskop
- Ein 37ºC-Wasserbad, das in den Schrank gestellt werden kann
- Eine Zentrifuge mit ausschwenkbarem Rotor
- Sterile Sezierinstrumente – idealerweise zwei Sätze – jeweils bestehend aus zwei Scheren- und Pinzettenpaaren (eines gebogen und eines stumpf).
- 75 ml Gewebe Corning Kulturflaschen – Ref. 15430641
- 24 well Falcon Platten – Ref. 353047
- Sterile Pipetten
- Pipettenfüller
- Sterile Pasteur-Pipetten
- A Timer
Medium und andere Reagenzien (Siehe Anhang A für weitere Details)
- RPMI 1640 Bicarbonat gepuffert, mit L-Glutamin (Lonza Ref. BE12-702F)
- RPMI 1640 Hepes gepuffert, ohne L-Glutamin
- Gute Qualität (chargengeprüft) Fetales Rinderserum (Genycell Ref. GCS0101-500)
- Penicillin/Streptomycin (Gibco Ref. 15070-063)
- Ultroser G (Pall Ref. 15950-017)
- HAT (Hypoxathin, Aminopterin, Thymidin) (Gibco Ref. 21060-017)
- PEG 1500 (Roche Ref. 10783641001)
Bevor Sie beginnen (siehe Anhang A für weitere Details)
- Machen 500 ml von A
- Machen 500 ml von medium A +
- Machen 100 ml von medium B
- Machen 100 ml von medium C
- Machen 500 ml von medium D
Auftauen und wachstum der myelom zellen
Die Myelomzelllinie auftauen und in Medium A wachsen. Verwenden Sie die folgende Methode, um die Myelomzelllinie aufzutauen und zu kultivieren.
- Entfernen Sie die gefrorene Durchstechflasche mit Myelomzellen aus dem LN2-Speicher.
- Legen Sie die Zellen in ein 37ºC Wasserbad.
- Halten Sie den Deckel der Gefrierfläschchen über der Wasseroberfläche, um die Wahrscheinlichkeit einer Kontamination zu verringern.
- Wenn die Zellen fast aufgetaut sind (nur ein kleiner Eisbrocken bleibt übrig), bewegen Sie sich zur Gewebekulturhaube.
- Wischen Sie die Außenseite der Durchstechflasche mit 70% igem Ethanol ab und entfernen Sie die Oberseite.
- Entfernen Sie die Zellsuspension vorsichtig mit einer sterilen Pasteur-Pipette.
- Übertragen Sie den Inhalt in ein Zentrifugenröhrchen mit 10 ml Medium A (siehe Anhang A)
- Drehen Sie die Zellsuspension vorsichtig bei 300 g für 5 min.
- Entfernen Sie den Überstand und resuspendieren Sie die Zellen in 10 ml frischem Medium A und geben Sie sie in einen kleinen (25 cm2) Kolben.
- Nehmen Sie 1 ml der Suspension aus dem ursprünglichen Kolben und geben Sie sie in einen zweiten mit 9 ml Medium A. Dadurch wird sichergestellt, dass bei zu hoher Konzentration im ersten Kolben eine zweite (niedrigere) Zellkonzentration verfügbar ist.
- Stellen Sie die Kolben in den CO2-Inkubator. Denken Sie daran, die Flaschendeckel leicht geöffnet zu lassen, um einen Gasaustausch zu ermöglichen.
Der Fusionsprozess
Drei Tage vorher – Bereiten Sie die Myelomzellen für die Fusion vor
Die Myelomzellen müssen sich in einer exponentiellen Wachstumsphase befinden, wenn Sie sie verwenden, und dies erfordert Erfahrung. Wenn Sie jedoch zwei 75 cm2-Flaschen Ihrer Myelomzellen aufstellen, eine mit einer Verdünnung von 1:40 und eine mit 1:60 (siehe unten), sollte 3 Tage vor der Fusion eine der Flaschen am Tag der Fusion ideal sein. (Das anfängliche Aufstellen zusätzlicher Kolben in Verdünnungen oberhalb und unterhalb der hier angegebenen Verdünnungen sollte Ihnen die Erfahrung vermitteln, die zur Beurteilung der Wachstumsrate der Myelomzellen für nachfolgende Fusionen erforderlich ist).
Einen Tag vorher – das Medium vorbereiten
Folgendes muss hergestellt und auf 37ºC vorgewärmt werden (Sie können es über Nacht in Ihren Inkubator stellen).
- Zwei x 200ml Medium A+ in zwei 75cm2 Flaschen
- 100ml Medium B
- 100ml Medium C
- 1x4ml PEG 1500 übertragen auf eine Folie eingewickelt (PEG ist lichtempfindlich) steril universal
- Ein Mini- wasserbad, hergestellt aus einem 200-ml-Becherglas mit etwa 100 ml destilliertem Wasser und gekreuzt mit Klebeband, das breit genug ist, um eine Öffnung für ein 50-ml-Falkenröhrchen aufrecht zu halten
Tag der Fusion
- Töten Sie die Maus (gemäß den institutionellen Richtlinien), extrahieren Sie die Milz und legen Sie sie in einen sterilen Behälter mit 5 ml medium C.
- Alle nachfolgenden Schritte müssen in einer Laminar-Flow-Haube durchgeführt werden.
- Milz und Medium in eine Petrischale geben.
- Bewegen Sie die Milz mit einer sterilen Pinzette, um sie zu waschen. Entfernen Sie alle Verwachsungen und übertragen Sie die Milz in eine zweite Petrischale
- Schneiden Sie die Milz in zwei Teile. Halten Sie eine Hälfte mit einer stumpfen Pinzette und ziehen Sie die Zellen mit einer anderen gebogenen Pinzette vorsichtig aus der Milzkapsel, wobei Sie darauf achten, so viele Zellen wie möglich zu entfernen. Wiederholen Sie dies mit der zweiten Hälfte der Milz
- Entfernen Sie die Milzkapselreste und mischen Sie die Zellen mit einer sterilen Pasteur-Pipette gut, aber sehr vorsichtig.
- Übertragen Sie die Zellsuspension in ein 15-ml-Röhrchen und spülen Sie die Petrischale mit weiteren 5 ml Medium C aus und geben Sie sie zu den Milzzellen im Röhrchen.
- Zähle die Myelom- und Milzzellen.
- Sie benötigen ein Verhältnis von 1 Myelomzelle zu je 10 Milzzellen
- Geben Sie die Myelomzellen in ein konisches 50-ml-Röhrchen.
- Zentrifugieren Sie sowohl die Milzzellen (15-ml-Röhrchen) als auch die Myelomzellen in (50-ml-Röhrchen) für 300 g für 10 Minuten.
- Gießen Sie den Überstand beider Röhrchen sehr vorsichtig ab und resuspendieren Sie die Pellets vorsichtig in jeweils 10 ml Medium B. Das Fehlen von FBS bis zum Abschluss des Fusionsprozesses ist äußerst wichtig, da die Zellen nicht verschmelzen, wenn FBS vorhanden ist)
- Kombinieren Sie die resuspendierte Milzzelle und Myelom Pellets in einem 50ml Zentrifugenröhrchen.
- 5 Minuten bei 300g zentrifugieren.
- Sehr vorsichtig so viel Überstand wie möglich abgießen.
- Resuspendieren Sie das Pellet, indem Sie sanft auf das Röhrchen auf der Bank klopfen. Schlagen Sie das Pellet nicht um oder pipettieren Sie es nicht, da dies die Zellen um das Röhrchen verteilt und die Zellzahlen reduziert, die für die Verschmelzung verfügbar sind.
- Legen Sie das Röhrchen in das hausgemachte Wasserbad.
- Innerhalb einer Minute tropfenweise 1,2 ml PEG zugeben und alle paar Tropfen vorsichtig umrühren.
- Fügen Sie 1 ml Medium B tropfenweise über eine Minute hinzu und rühren Sie alle paar Tropfen vorsichtig um.
- Fügen Sie weitere 2 ml Medium B tropfenweise über zwei Minuten hinzu und rühren Sie alle paar Tropfen vorsichtig um.
- Fügen Sie weitere 4 ml Medium B tropfenweise über vier Minuten hinzu und rühren Sie alle paar Tropfen vorsichtig um.
- Am Ende der Zeit 8 ml Medium C hinzufügen.
- Zentrifugieren Sie das Röhrchen mit den Zellen für 5 Minuten 300 g.
- Dekantieren Sie den Überstand sehr vorsichtig und resuspendieren Sie das Zellpellet für 1 Minute mit 10 ml Medium A +. Fügen Sie dazu einige ml des Mediums hinzu, um das Pellet aufzubrechen. Saugen Sie diese Zellklumpen sehr sanft auf und bewegen Sie sich in der Pipette auf und ab. Vertreibe diese Zellen und wiederhole den Vorgang. Seien Sie sehr sanft, zwingen Sie das Pellet nicht auseinander, Sie können kleine Zellklumpen haben, wenn Sie fertig sind. Die Zellen sind in diesem Stadium extrem zerbrechlich.
- Geben Sie die 10 ml resuspendierte Fusionsmischung in 190 ml warmes Medium A +
- Das Endvolumen beträgt 200 ml
- Geben Sie 1 ml dieser Suspension in jede Vertiefung von 8 x 24 well (2 ml) Platten. (insgesamt 192 Vertiefungen)
- Lassen Sie die Platten über Nacht (ungefähr 24 Stunden) im Inkubator.
Tag nach der Fusion
- 8 ml HAT in 200 ml Medium A+ geben.
- Geben Sie 1 ml dieses selektiven Mediums in jede Vertiefung der 8 Platten.
- Lassen Sie die Platten im Inkubator. Die Kolonien erscheinen zwischen 7 und 10 Tagen

Anhang I
Kulturmedium A:
RPMI 1640 Medium mit L-Glutamin (Bicarbonat gepuffert) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100 U / ml) / Streptomycin (100 mg / l) (Gibco Ref. 15070-063)
Kulturmedium A+:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
Culture Medium B (no FBS):
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium C:
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium D:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
+ HAT (Hypoxathine, Aminopterin, Thymidine) supplement which is usually 50X (dilute 10ml in 500mls of medium) (Gibco Ref. 21060-017)