Die Mehrfarbenfärbung mit Fluoreszenzfarbstoffen wird aktiv zur Beobachtung der Verteilung biologischer Materialien (wie Proteine, Lipide, Nukleinsäuren und Ionen) im Bereich der Gewebe- und Zellforschung eingesetzt. Die Detektionstechnologie zur Fluoreszenzbeobachtung ist so weit fortgeschritten, dass ein einzelnes Fluoreszenzfarbstoffmolekül unter den besten Umständen nachgewiesen werden kann. In diesem Abschnitt werden einige der wichtigen Aspekte der Fluoreszenz-Lifetime-Imaging-Mikroskopie (FLIM), einer neuen Fluoreszenzmikroskopietechnologie, behandelt. Zusätzlich zur Mehrfarbenfärbung kann die Fluoreszenzlebensdauerbildgebung auch verwendet werden, um die Faktoren zu visualisieren, die die Fluoreszenzlebensdauereigenschaften des Farbstoffmoleküls beeinflussen, dh den Zustand der Umgebung um das Molekül herum.
Wellenlängenspektroskopie
Die konventionelle Fluoreszenzmikroskopie macht sich die Farbeigenschaften von Fluoreszenzfarbstoffen zunutze, d. h. Die Identifizierung basiert auf Unterschieden in den Fluoreszenzspektraleigenschaften zwischen Farbstoffen. Mit dieser Technik können fünf oder sechs Farbstoffe im Wellenlängenbereich von Ultraviolett bis Nahinfrarot gleichzeitig unter der Mikroskopie ohne Verwechslung zwischen den Farben verwendet werden.
Lebensdauerspektroskopie
Jeder Fluoreszenzfarbstoff hat seine eigene Lebensdauer im angeregten Zustand. Durch den Nachweis von Lebensdauerunterschieden ist es möglich, auch Farbstoffe mit gleicher Fluoreszenzfarbe zu unterscheiden sowie Autofluoreszenz zu identifizieren. Darüber hinaus können hohe Signal-Rausch-Bilder erhalten werden, indem eine Sonde mit einer sehr langen Lebensdauer im Vergleich zu der der normalerweise verwendeten Fluoreszenzfarbstoffe verwendet wird. Zum Beispiel hat Platincoproporphyrin eine Lebensdauer von Millisekunden, während die Lebensdauer gewöhnlicher Fluoreszenzfarbstoffe in Nanosekundenordnung liegt. Solche relativ langlebigen Fluoreszenzfarbstoffe werden bald als Sonden für den DNA-Nachweis auf Chips verwendet.
Fluorescence Lifetime Imaging ermöglicht es auch, Informationen über die Moleküle zu erhalten, während eine lebende Zelle beobachtet wird. Zu den Faktoren, die die Fluoreszenzlebensdauer beeinflussen, gehören Ionenintensität, hydrophobe Eigenschaften, Sauerstoffkonzentration, molekulare Bindung und molekulare Wechselwirkung durch Energieübertragung, wenn sich zwei Proteine nähern. Die Lebensdauer ist jedoch unabhängig von Farbstoffkonzentration, Photobleichung, Lichtstreuung und Anregungslichtintensität. Daher ermöglicht uns die Fluoreszenzlebensdauerbildgebung eine genaue Ionenkonzentrationsmessung und eine Fluoreszenzresonanzenergietransferanalyse (FRET).
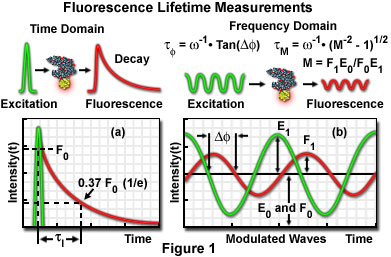
Es gibt zwei Methoden der Fluoreszenzlebensdauerbildgebung: die Zeitbereichsmethode und die Frequenzbereichsmethode.
- Zeitbereichsflim – In einigen Fällen von Verzögerung nach Anregung durch einen Pulslaser kann das Fluoreszenzbild durch die Gate-Operation des Bildverstärkers erhalten werden. Die Lebensdauer wird von einem Laser mit einer Pulsdauer von einigen hundert Pikosekunden und einem Shutter auf Nanosekundenebene in Nanosekunden gemessen, da die Lebensdauer eines Anregungszustands üblicherweise 1 bis 20 Nanosekunden beträgt. Ein Hochgeschwindigkeits-Gate-Bildverstärker ist kommerziell von der Firma Hamamatsu Photonics K.K. (Hamamatsu, Japan) erhältlich. Die Fluoreszenzlebensdauer an jedem Pixel kann auch durch Messen unter Variation der Verzögerungszeit bis zum Öffnen eines Gatters erhalten werden. Fluoreszenzlebensdauerbilder werden in Pseudofarbe entsprechend ihrer Lebensdauer angezeigt.
- Die FLIM – Fluoreszenzlebensdauer im Frequenzbereich wird berechnet, indem die Phasenverschiebung der Fluoreszenz und die Verringerung ihrer Amplitude unter Verwendung eines Detektors mit einem Verstärkungsmodulator gemessen wird, wenn der als Anregungslichtquelle verwendete Laser moduliert wird (1 bis 200 Megahertz). Die Messung kann entweder mittels Laserscanning (Photomultiplier) oder mit einem Charge-Coupled Device (CCD) erfolgen.
Anwendungen
Die Umgebung der Sonde wird aufgrund der Tatsache erkannt, dass die Fluoreszenzlebensdauer empfindlich auf Wasserstoffionenkonzentration (pH), Sauerstoff- und Calciumionenkonzentrationen reagiert. Die Bindung oder die Wechselwirkung zwischen Molekülen kann auch in Kombination mit FRET gemessen werden.
Bildgebung der Calciumionenkonzentration
Wenn das Calciumion an eine Fluoreszenzsonde wie Fura-2, Fluo-3 oder Calciumgrün bindet, ändern sich sowohl die Fluoreszenzlebensdauer als auch die Fluoreszenzintensität. Das herkömmliche Verfahren zur Ionenkonzentrationsmessung konzentriert sich auf die Intensitätsänderung. Entsprechend der Änderung der Calciumionenkonzentration ändert sich das Verhältnis der Farbstoffe zwischen gebundenem und ungebundenem Calciumion, was in der Folge zu einer Änderung der Fluoreszenzlebensdauer des Messflecks in der Probe führt. Neben der Calciumionensonde ist diese Technik auch für die Messung von pH-Wert und anderen Ionen wie Natriumionen und Magnesiumionen anwendbar.
Fluoreszenz-Resonanz-Energieübertragung (FRET)
Derzeit wird an FRET durch grün fluoreszierende Proteinvarianten (GFP) geforscht (GFP mit einer anderen Fluoreszenzfarbe). FRET ermöglicht es, die Wechselwirkungen (Assoziation oder Dissoziation) zwischen zwei Proteinen zu messen, die mit einem Paar Fluoreszenzfarbstoffen markiert sind. Ein Donorfluoreszenzfarbstoff hat kürzere Anregungs- / Emissionswellenlängen, die einem Akzeptorfluoreszenzfarbstoff Energie zuführen. Die Lebensdauer des Anregungszustands des Donorfarbstoffs ist variabel, abhängig davon, ob der Akzeptor (der Farbstoff, der die Energie empfängt) existiert oder nicht. Die Messung anhand der Lebensdauer erlaubt eine bessere Quantifizierung, da die Fluoreszenzüberlappung beim Nachweis nicht berücksichtigt werden muss.
Klinische Bildgebung
Da einige gewebe- und zytodiagnostische Proben eine starke Autofluoreszenz aufweisen, wurde versucht, Sonden mit langer Lebensdauer (bis zu Millisekunden) zu verwenden. Langlebige Sonden sind auch bei der Fluoreszenz-in-situ-Hybridisierung (FISH) nützlich, da die Anzahl der Farben, die gleichzeitig verwendet werden können, bei dieser Technik begrenzt ist. Die Wasserstoffionenkonzentration im Blut sowie der Sauerstoff- und Kohlendioxiddruck wurden bereits anhand der Fluoreszenzlebensdauer gemessen, obwohl solche Messungen unter der Mikroskopie noch nicht möglich sind.
Internetquellen
- Zentrum für Fluoreszenzspektroskopie – Veranstaltet von Professor Joseph R. Lakowicz an der University of Maryland, Diese Website ist eine hervorragende Ressource für Informationen über Fluoreszenz-Lifetime-Imaging und andere Aspekte der Fluoreszenzspektroskopie und Mikroskopie.
- Kentech Instruments – Kentech fertigt Hochspannungs-Festkörperpulsgeneratoren und optische Gated Imaging-Systeme für Fluoreszenz-Lifetime-Imaging.
- Hamamatsu Photonics – Hamamatsu stellt neben seiner hervorragenden Produktpalette an Digitalkamerasystemen auch Photomultiplier, Avalanche-Fotodioden und Hochgeschwindigkeits-Gate-Bildverstärker her.
- PRS BioSciences – Spezialisiert auf biologische Fluoreszenzmikroskopie stellt PRS BioSciences ein Aftermarket-zeitgesteuertes System her, das an viele Forschungsmikroskope angepasst werden kann.