- Plastizität von VSMCs in Physiologie und Krankheit
- VSMCs beeinflussen Adventitia Immunantworten in hyperlipidämischen Mäusen
- Altern oder Chronizität oder beides?
- Neu gebildete Adventitia-Strukturen nehmen an der Atlo-Funktion teil, indem sie die Lymphozytenrezirkulation fördern
- Die Atlo-Bildung ist stark territorialisiert, was darauf hindeutet, dass Signale von Plaques über Organisator-ähnliche VSMCs des lymphatischen Gewebes an die Adventitia übertragen werden
- VSMCs tragen direkt zur Adventitia-Immunität bei Atherosklerose bei
- Schlussfolgerung
- Autorenbeiträge
- Finanzierung
- Interessenkonflikterklärung
Plastizität von VSMCs in Physiologie und Krankheit
Vaskuläre glatte Muskelzellen (VSMCs) sind die Hauptbestandteile mittelgroßer und großer Arterien. Obwohl die Mechanismen der Atherogenese noch weitgehend definiert werden müssen, haben Studien gezeigt, dass das Fortschreiten der Krankheit ein Übersprechen zwischen Immunzellen sowohl mit ECs als auch mit VSMCs beinhaltet. Einige dieser Wechselwirkungen fördern das Plaquewachstum, während andere die Größe, zelluläre Zusammensetzung und Stabilität von atherosklerotischen Plaques abschwächen (1, 2) (Abbildung 1, Tabelle 1). VSMCs zeigen eine bemerkenswerte Plastizität als Reaktion auf Gefäßverletzungen, Entzündungen und Lipoproteinakkumulation während des Fortschreitens der Krankheit durch Umprogrammierung der Genexpression und eine Verschiebung zu einem proliferativen, promigratorischen und aktivierten Phänotyp, d. H. Phänotypwechsel (5). In Abbildung 1 zeigen wir kritische molekulare Schalter, die als wichtige Regulatoren des Krankheitsverlaufs vorgeschlagen wurden (3, 6, 8, 11). Während der Atherosklerose Initiierung, Blut-abgeleitete Monozyten, die in die Intima rekrutiert wurden, akkumulieren Lipid, das ihnen ein schaumiges Aussehen verleiht. Diese Schaumzellen tragen zur Bildung von Fettstreifen bei, die das früheste und möglicherweise reversible Stadium atherosklerotischer Plaques darstellen. Fettstreifen entwickeln sich allmählich zu Atheromen / Plaques, die letztendlich zu ausgedehnten Plaques führen, die VSMCs, T-Zellen und myeloische Zellen enthalten (Abbildung 1) (33). Interessanterweise bestimmt die Zusammensetzung einer atherosklerotischen Plaque und nicht ihre Größe ihre Stabilität, da die Dicke der Faserkappe und die Größe des nekrotischen Kerns potenzielle Merkmale einer stabilen bzw. einer instabilen Plaque sind (4, 9). VSMCs in der Intimaschicht werden traditionell als vorteilhaft während der Atherogenese angesehen, da sie extrazelluläre Matrixkomponenten produzieren, wodurch die Bildung stärkerer Faserkappen gefördert wird, was zu einem Schutz vor Plaquebruch führt (4, 9). Es wird immer offensichtlicher, dass VSMCs eine Vielzahl von strukturellen und funktionellen phänotypischen Transformationen durchlaufen und sogar ihre nativen Merkmale vollständig verlieren können, um Eigenschaften anderer Zelltypen einschließlich Makrophagen zu erwerben. Die Daten deuten darauf hin, dass VSMCs dichotome Phänotypen mit Janus-Kopf-Typ erwerben können, d. H. Pro- vs. anti-atherogene Eigenschaften, abhängig von der Gewebeumgebung und der Wirkung von Risikofaktoren (3). VSMCs setzen Zytokine frei, um benachbarte ECs zu stimulieren, Adhäsionsmoleküle zu exprimieren und Zytokine freizusetzen und / oder die Chemotaxis von Monozyten / Makrophagen in die Plaque zu verstärken (3, 34, 35) (Tabelle 1). Diese Daten zeigen, dass die Akkumulation von VSMCs in der fibrösen Kappe oder Intima vorteilhaft ist, während ihr Verlust oder Übergang in einen entzündlichen Phänotyp schädlich ist und dass das Gleichgewicht zwischen VSMCs Proliferation / Migration vs. Tod / Seneszenz bestimmt Atheroprogression vs. Plaquestabilität (3). Verschiedene zusätzliche Aspekte der VSMC-Biologie in Gesundheit und Krankheit wurden kürzlich in einer Reihe exzellenter Rezensionen behandelt (https://academic.oup.com/cardiovascres/issue/114/4) und werden hier nicht behandelt. Im Folgenden konzentrieren wir uns daher auf die Rolle der Adventitia und die möglichen Auswirkungen von VSMCs auf die ATLO-Bildung.

Abbildung 1. Phänotypen von VSMCs während des Fortschreitens der Atherosklerose zeigen eine außergewöhnliche Plastizität. ECs und VSMCs in atherosklerotischen Plaques zeigen aktivierte Phänotypen (➊) (3, 4). Einige der VSMCs stammen aus den Medien nach der Rekrutierung in die Intima; andere VSMCs können aus dem Knochenmark stammen oder aus myeloischen Zellen im Kreislauf stammen (➋) (3). Ein Bruchteil der VSMCs proliferiert (➌) (3, 5). VSMCs sezernieren extrazelluläre Matrixkomponenten; Der pluripotente Transkriptionsfaktor, d. H. Klf4, kann eine wichtige Rolle in einem Prozess spielen, der als Phänotypumschaltung (➍) bezeichnet wird (6, 7). Bei Versuchen, die atherosklerotische Plaque vor einem tödlichen Bruch zu schützen, kann Oct4 einen Prozess steuern, der als Remigration bezeichnet wurde, um eine faserige Kappe (➎) zu bilden (4, 8-10). Seneszenz und Apoptose lösen die Bildung zusätzlicher entzündlicher Zytokine aus, die einen nekrotischen Kern bilden und einen Teufelskreis mit tödlichen klinischen Folgen in den späten Stadien der Krankheit auslösen (➏) (3, 4, 11).
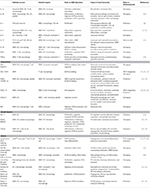
Tabelle 1. Wichtige Entzündungsmediatoren, die an der VSMC-vermittelten Atherosklerose-Immunität beteiligt sind.
VSMCs beeinflussen Adventitia Immunantworten in hyperlipidämischen Mäusen
In den letzten zwei Jahrzehnten wurde immer deutlicher, dass die Adventitia ein hochkomplexes und immunologisch aktives Gewebe ist, das Zellen beherbergt, die so vielfältig sind wie Stromazellen, Nerven, Lymphgefäße, Vasa vasora und residente Leukozyten / Vorläuferzellen, die alle den Krankheitsverlauf beeinflussen können (36, 37). Wir beobachteten, dass die Adventitia von ApoE- / – Mäusen während aller Stadien der Atherosklerose großen Umstrukturierungsereignissen unterliegt: Sowohl angeborene als auch adaptive Immunzellen akkumulieren benachbart zu den benachbarten atherosklerotischen Plaques (Abbildung 2). Darüber hinaus wurden unsere Studien an experimentellen Mäusen in menschlichen erkrankten Arterien bestätigt: Wir und andere beobachteten ATLO-ähnliche Strukturen in der Adventitia von Patienten mit atherosklerotischen Aortenaneurysmen (38, 39) und in jüngerer Zeit Akhavanpoor et al. beobachtete gut entwickelte ATLOs in der Adventitia eines beträchtlichen Prozentsatzes von Patienten mit ischämischer Herzkrankheit (40). Bei der murinen Atherosklerose sind Lymphgefäß-, High Endothelial Venule (HEV) – und Blutgefäßneogenese herausragende Merkmale dieses Umstrukturierungsprozesses (16, 41).
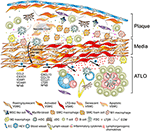
Abbildung 2. Vaskuläre glatte Muskelzellen (VSMC) sind an der Adventitia-Immunität während der Plaquebildung beteiligt. VSMCs, die zwischen atherosklerotischen Plaques und der Adventitia angeordnet sind, nehmen nach Aktivierung über Plaque-abgeleitete Signale (➊) einen Organisator-ähnlichen Phänotyp des lymphatischen Gewebes an und transdifferenzieren anschließend in LTo-ähnliche Zellen (➋). Durch ihren proliferativen und zytokinexprimierenden Phänotyp beeinflussen sie die Umstrukturierung und Formung der Adventitia einschließlich Angiogenese, HEV-Bildung und Lymphgefäßneogenese (➌). Die Phänotypumschaltung führt auch zur Expression und Sekretion von lymphorganogenen Chemokinen, d. H. CXCL13 und CCL21, wodurch die ATLO-Bildung gefördert wird, die schematisch im unteren Teil des Diagramms (➍) dargestellt ist.
Altern oder Chronizität oder beides?
Es wurde festgestellt, dass das Altern eine wichtige Determinante für die Umstrukturierung und Bildhauerei von Adventitia ist. Voll entwickelte ATLOs bilden sich in fortgeschrittenen Stadien der Atherosklerose, aber Ihre frühen Stadien, d. H. T / B-Zellaggregate, treten parallel zur Bildung von atherosklerotischen Plaques auf (16, 27, 41, 42). Tatsächlich bilden sich diese frühen ATLOs im Alter von ~ 30 Wochen und erreichen nach etwa 52 Wochen fortgeschrittenere Stadien, um nach 78 Wochen ihren Höhepunkt zu erreichen (16, 41). Ähnliche altersabhängige Entwicklungsstadien von TLOs wurden bei anderen chronischen unlösbaren Erkrankungen beobachtet (1, 42). Diese Daten zeigen, dass die ATLO-Entwicklung altersabhängig ist und das Altern positiv mit der adventitiellen Bildhauerei assoziiert ist (Abbildung 2). Die Beziehung zwischen Alterung und Chronizität ist jedoch bei muriner Atherosklerose schwer zu untersuchen, da die atherosklerotische Plaqueentwicklung im Aortenbogen beginnt und dann in späteren Krankheitsstadien durch die Aorta gesät wird, um die Bauchaorta zu erreichen, wodurch längere Zeiträume in Anspruch genommen werden. Weitere Arbeiten sind erforderlich, um die wichtige Frage zu klären, ob die Seneszenz von Immunzellen und / oder VSMC zur ATLO-Bildung beiträgt und welche Zelltypen, d.h., VSMCs, ECs und / oder Immunzellen beteiligt sind. Studien zu anderen Formen der TLO-Bildung, wie sie in der Lunge und im Magen-Darm-Trakt auftreten, würden darauf hindeuten, dass die Chronizität einer anhaltenden entzündlichen Gewebereaktion und nicht die echten Alterungsereignisse des Immunsystems entscheidend zur Bildung von ATLOs beitragen (43, 44).
Neu gebildete Adventitia-Strukturen nehmen an der Atlo-Funktion teil, indem sie die Lymphozytenrezirkulation fördern
Fortgeschrittene ATLO-Stadien umfassen T / B-Zellaggregate, Keimzentren innerhalb aktivierter B-Zellfollikel, Lymphgefäße, HEVs in T-Zellbereichen und extrazelluläre Leitungsnetze (16). Diese großen Veränderungen ähneln Strukturen, die an solche in sekundären lymphoiden Organen erinnern, wo sie grundlegende Aspekte der Immunantwort auf Antigen fördern, einschließlich der Rezirkulation von naïven Lymphozyten, um ihre kognitiven Antigene / Autoantigene zu finden, und der Organisation der Affinitätsreifung von B-Zellen gegenüber potenziellen Autoantigenen. Unter Verwendung adoptiver Lymphozytentransferstudien beobachteten wir, dass ATLOs die Lymphozytenrekrutierung in die Arterienwand erheblich verbessern, indem sie sowohl die Einwanderung fördern als auch die gleichzeitige Abschwächung der Auswanderung antigen-induzierter Lymphozyten (27). Nach ihrer Rekrutierung werden T-Zellen aktiviert, beginnen sich zu vermehren und einige der CD4-T-Helferzellen werden in induzierte T-regulatorische Zellen umgewandelt. Diese Daten zeigen, dass das Immunsystem in der Adventitia sehr gut auf die zugrunde liegende entzündliche Gewebereaktion der Arterienwand anspricht. Darüber hinaus scheinen B-Zellen, die Keimzentren in aktivierten B-Zellfollikeln bilden, in Gegenwart von follikulären dendritischen Zellen eine Keimzentrumsreaktion zu durchlaufen, bei der einige in Gedächtnis-B-Zellen umgewandelt werden, während andere die Keimzentren verlassen, um Plasmazellen zu werden (45). Zusammengenommen deuten diese Daten darauf hin, dass ATLOs und nicht sekundäre lymphatische Organe (wie bisher angenommen) die Arteriosklerose-Immunität organisieren.
Die Atlo-Bildung ist stark territorialisiert, was darauf hindeutet, dass Signale von Plaques über Organisator-ähnliche VSMCs des lymphatischen Gewebes an die Adventitia übertragen werden
Ein weiterer Aspekt der Adventitia-Umstrukturierung während der Atherogenese ist, dass die ATLO-Bildung stark territorialisiert ist und weitgehend auf Adventitia-Segmente beschränkt ist, die an atherosklerotische Plaques in der Bauchaorta bei Mäusen angrenzen (16, 45). ATLOs werden nur gelegentlich in der Adventitia der Arteria innominata oder des Aortenbogens gefunden, wo Atherosklerose am ausgeprägtesten ist. Immunzellen in den thorakalen Segmenten der Aorta bestehen im Vergleich zu ATLOs in der Bauchaorta hauptsächlich aus T-Zellaggregaten (16, 41). Der genaue Mechanismus für die Territorialität der ATLOs-Bildung in der Bauchaorta ist noch unbekannt. TLOs scheinen ein Merkmal vieler chronischer unlösbarer entzündlicher Erkrankungen zu sein und sind prominente Kennzeichen von Autoimmunerkrankungen (42). Die Zellularität und Strukturen von TLOs bei Atherosklerose ähneln TLOs bei vielen anderen chronischen Erkrankungen, einschließlich der krebsassoziierten TLO-Bildung (46, 47). Das Gebiet der TLO-Biologie hat sich in den letzten Jahren dramatisch erweitert, was die wichtige Möglichkeit erhöht, dass ein neues therapeutisches Ziel durch das Verständnis der TLO-Funktion bei jeder TLO-assoziierten Krankheit identifiziert werden kann. Die verschiedenen Arten von TLOs zeigen jedoch einige krankheitsspezifische Merkmale, die letztendlich bestimmen können, ob die damit verbundenen Immunantworten schädlich oder schützend sind. Solche krankheitsspezifischen Merkmale entstehen möglicherweise durch einen von mehreren Mechanismen, einschließlich der Organspezifität und der Art der Gewebeschädigung (1, 42). Die Entwicklung lymphoider Organe ist ein komplexer Prozess, der hämatopoetische LTI-Zellen (Lymphoid Tissue Inducer), nicht hämatopoetische LTO-Zellen (Stromal Lymphoid Tissue Organizer) und LTßR-Signalisierung umfasst. Unsere In-vitro-Studien an Maus-Aorta-VSMCs zeigten, dass sie bei entsprechender Stimulation als LTo-ähnliche Zellen dienen können (20), die ursprünglich während der Embryonalentwicklung während der Bildung von sekundärem lymphatischem Gewebe einschließlich Lymphknoten und Milz identifiziert wurden (48, 49) (siehe unten). Es ist wichtig zu beachten, dass ATLOs VSMCs als wichtige Teilnehmer einzubeziehen scheinen, während andere TLOs andere LTo-ähnliche Mesenchymzellen beinhalten (50). Der gemeinsame Nenner aller Formen von TLOs scheint jedoch – im Gegensatz zu sekundären lymphoiden Organen – eine chronisch entzündliche Gewebereaktion zu sein, die das Immunsystem dazu treibt, diese lymphoiden Strukturen in der Nähe oder in einigen Fällen innerhalb des erkrankten Gewebes zu bilden (42, 43).
VSMCs tragen direkt zur Adventitia-Immunität bei Atherosklerose bei
Angesichts der stark territorialisierten Natur von ATLOs neben atherosklerotischen Plaques argumentierten wir, dass VSMCs an der ATLO-Bildung beteiligt sein können und aus dem gleichen Grund eine funktionelle Rolle bei der Atherosklerose spielen können Progression. VSMCs exprimieren das LTßR stark konstitutiv (16), während sein Ligand LTa1ß2 auf verschiedenen Immunzellen exprimiert wird, die als LTi-Zellen bezeichnet werden (51). Es wird angenommen, dass VSMCs durch den LTßR-LT-Signalweg aktiviert werden durch LTi-Zellen, die an der Neogenese des sekundären lymphatischen Gewebes beteiligt sind. Der Ursprung der LTi-Zelle wurde noch nicht eindeutig bestimmt, obwohl aktivierte Makrophagen und andere Immunzellen in der Intima-Plaque Kandidaten für diese Aktivität in der LTO-Neogenese sind. Als Reaktion auf zelluläre und lösliche Mediatoren scheinen VSMCs durch parakrine Sekretion der lymphorganogenen Chemokine, d. H. CXCL13 und CCL21, einen ausgeprägten Phänotyp zu durchlaufen, der in einen LTo-ähnlichen Phänotyp übergeht, wodurch Immunzellen, z. B. Makrophagen / dendritische Zellen, T-Zellen und B-Zellen, in das lokale Adventitia-Milieu angezogen werden, was zur Bildung von ATLO in der Adventitia führt (27, 41, 45) (Tabelle 1). Globaler oder VSMC-spezifischer Mangel an LTßR in gealterten hyperlipidämischen ApoE− / − Mäusen zeigte eine erhöhte atherosklerotische Plaquebildung, was darauf hindeutet, dass der VSMC LTßR die Fähigkeit hat, die Entwicklung von Atherosklerose unter einigen experimentellen Bedingungen abzuschwächen (27). Andere Studien zeigten jedoch, dass junge globale ApoE− / − LTbR- / −Mäuse, die unter einer fettreichen Diät (HFD) gehalten wurden, eine geringere Aortenplaquebelastung aufwiesen als ihre normalen ApoE− / -Gegenstücke, die mit Diät gefüttert wurden (52). Diese offensichtlich widersprüchlichen Daten deuten darauf hin, dass die Rolle von LTßR bei jungen Mäusen und unter Bedingungen einer übermäßigen Hyperlipidämie in den beiden Modellen unterschiedlich sein kann. Alternativ kann die fettreiche Ernährung, die zu dramatischen und möglicherweise berauschenden Plasmalipiden führt, für diese Unterschiede verantwortlich sein. Da wir bei ApoE- / – Mäusen nicht regelmäßig eine fettreiche Diät anwenden, bleiben diese Diskrepanzen ungelöst, obwohl gezeigt wurde, dass das Immunsystem von extremen Plasmalipiden überwältigt werden kann . Diese Daten erfordern weitere Studien, um die molekularen Grundlagen für die scheinbare Dichotomie des LTßR bei der Atherosklerose-Progression bei jungen vs. gealterten Mäusen und / oder frühen vs. fortgeschrittenen Mäusen zu untersuchen Atherosklerose. Darüber hinaus können aus dem Knochenmark stammende Makrophagen als LTßR-unabhängige LTi-Zellen fungieren und die Expression von CCL19, CCL20 und CXCL16 durch VSMCs auslösen (53) (Tabelle 1). Daher können VSMCs an der Bildung von TLOs bei Atherosklerose durch Hochregulierung von lymphorganogenen Chemokinen beteiligt sein, um Immunzellaggregate in der Adventitia zu fördern. Wie oben erwähnt, sind ATLOs häufig bei Menschen mit ischämischer koronarer Herzkrankheit (40) und bei menschlichen atherosklerotischen Aortenaneurysmen (38, 39). Zusammengenommen wirft das Auftreten von ATLOs in experimentellen Mäusen und in der menschlichen Atherosklerose wichtige Fragen hinsichtlich der Natur der Atherosklerose als Autoimmunerkrankung auf: Es ist denkbar, dass während der Atherogenese autoimmune T-Zellen und autoimmune B-Zellen erzeugt werden, die gegen noch zu identifizierende Autoantigene gerichtet sind. Die Isolierung solcher autoimmunen Lymphozyten einschließlich der Sequenzierung ihrer T-Zell-Rezeptoren und / oder B-Zell-Rezeptoren würde es ermöglichen, wichtige Hypothesen bei Atherosklerose zu testen. In der Tat würde die Atherosklerose-Forschung eine große Verschiebung erfahren und das Testen einzelner autoimmuner Lymphozyten-Klone in funktionellen In-vitro- und In-vivo-Systemen würde möglich werden.
Schlussfolgerung
Atherosklerose ist eine entzündliche Erkrankung der Arterien. VSMCs kommunizieren sowohl mit dem ECs als auch mit Immunzellen in den atherosklerotischen Plaques und residenten Zellen in der Adventitia. Diese Fähigkeit ermöglicht es VSMCs, ihre Immunität auf wichtige Weise zu beeinflussen, einschließlich der Bildung von ATLOs. Weitere Arbeiten sind erforderlich, um die Rolle von VSMCs in verschiedenen Stadien der Atherosklerose abzugrenzen, ihre Rolle in jungen vs. alternden Arterien zu bestimmen und ihre dichotomischen Rollen beim Fortschreiten der Krankheit weiter aufzuklären. Ein besseres Verständnis dieser Prozesse kann den Weg für die Entwicklung therapeutischer Strategien für zukünftige Interventionen in klinisch wichtigen Spätstadien der Krankheit ebnen.
Autorenbeiträge
Alle Autoren trugen zur Gestaltung, zum Schreiben und zur Bearbeitung des eingereichten Manuskripts bei und genehmigten es zur Veröffentlichung.
Finanzierung
Interessenkonflikterklärung
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
4. Clarke MC, Figg N, Maguire JJ, Davenport AP, Goddard M, Littlewood TD et al. Apoptose von vaskulären glatten Muskelzellen induziert Merkmale der Plaque-Anfälligkeit bei Atherosklerose. Nat Med. (2006) 12:1075–80. doi: 10.1038/nm1459
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
5. Wamhoff BR. Molekulare Regulation der vaskulären Differenzierung glatter Muskelzellen in Entwicklung und Krankheit. Physiol Rev. (2004) 84:767-801. doi: 10.1152/physrev.00041.2003
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
6. Shankman LS, Gomez D, Cherepanova OA, Lachs M, Alencar GF, Haskins RM, et al. Die KLF4-abhängige phänotypische Modulation glatter Muskelzellen spielt eine Schlüsselrolle bei der Pathogenese atherosklerotischer Plaques. Nat Med. (2015) 21:628–37. doi: 10,1038/nm.3866
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
7. Gomez D, Owens GK. Phänotypische Umschaltung glatter Muskelzellen bei Atherosklerose. Cardiovasc Res. (2012) 95:156-64. doi: 10.1093/cvr/cvs115
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
8. Cherepanova OA, Gomez D, Shankman LS, Swiatlowska P, Williams J, Sarmento VON, et al. Die Aktivierung des Pluripotenzfaktors OCT4 in glatten Muskelzellen ist atheroprotektiv. Nat Med. (2016) 22:657–65. doi: 10,1038/nm.4109
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
10. Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitationen Yla-Herttuala S, Bentzon JF, Daemen M, Falk E, Herrmann J, et al. Stabilisierung von atherosklerotischen Plaques. Positionspapier der Arbeitsgruppe Atherosklerose und Gefäßbiologie der Europäischen Gesellschaft für Kardiologie (ESC). Thromb Hämost. (2011) 106:1–19. doi: 10,1160/TH10-12-0784
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
11. Grootaert MOJ, Moulis M, Roth L, Martinet W, Vindis C, Bennett MR, et al. Vaskulärer glatter Muskelzelltod, Autophagie und Seneszenz bei Atherosklerose. Cardiovasc Res. (2018) 114:622-34. doi: 10.1093/cvr/cvy007
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
14. Akhavanpoor M, Akhavanpoor H, Gleissner CA, Wangler S, Doesch AO, Katus HA, et al. Die beiden Gesichter von Interleukin-17A bei Atherosklerose. Curr Drug Targets. (2017) 18:863–73. doi: 10.2174/1389450117666161229142155
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
15. Jia G, Cheng G, Gangahar DM, Agrawal DK. Insulin-like Growth Factor-1 und TNF-alpha regulieren die Autophagie durch c-jun N-terminale Kinase- und Akt-Signalwege in menschlichen atherosklerotischen glatten Gefäßzellen. In: Immunol Cell Biol. (2006) 84:448–54. doi: 10.1111/j.1440-1711.2006.01454.x
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
16. Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitationen Grabner R, Lotzer K, Radke D, Beer M, et al. Lymphotoxin-Beta-Rezeptor-Signalisierung fördert die tertiäre lymphoide Organogenese in der Aorta adventitia von gealterten ApoE− / − Mäusen. In: J Exp Med. (2009) 206:233–48. doi: 10.1084/jem.20080752
Querverweis Volltext / Google Scholar
17. Damas JK, Smith C, Oie E, Fevang B, Halvorsen B, Waehre T, et al. Verbesserte Expression der homöostatischen Chemokine CCL19 und CCL21 bei klinischer und experimenteller Atherosklerose: mögliche pathogene Rolle bei der Plaque-Destabilisierung. Arterioscler Thromb Vasc Biol. (2007) 27:614–20. doi: 10.1161/01.ATV.0000255581.38523.7c
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doring Y, Noels H, van der Vorst EPC, Neideck C, Egea V, Drechsler M, et al. Vascular CXCR4 limits atherosclerosis by maintaining arterial integrity: evidence from mouse and human studies. Circulation. (2017) 136:388–403. doi: 10.1161/CIRCULATIONAHA.117.027646
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Akhtar S, Gremse F, Kiessling F, Weber C, Schober A. CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells in Apoe-deficient mice. Arterioscler Thromb Vasc Biol. (2013) 33:679–86. doi: 10.1161/ATVBAHA.112.301162
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lotzer K, Dopping S, Connert S, Grabner R, Spanbroek R, Lemser B, et al. Mouse aorta smooth muscle cells differentiate into lymphoid tissue organizer-like cells on combined tumor necrosis factor receptor-1/lymphotoxin beta-receptor NF-kappaB signaling. Arterioscler Thromb Vasc Biol. (2010) 30:395–402. ich: 10.1161/ATVBAHA.109.191395
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
21. Smedbakken LM, Halvorsen B, Daissormont I, Ranheim T, Michelsen AE, Skjelland M, et al. Erhöhte Spiegel des homöostatischen Chemokins CXCL13 bei menschlicher Atherosklerose – mögliche Rolle bei der Plaquestabilisierung. Atherosklerose. (2012) 224:266–73. doi: 10.1016/j.Atherosklerose.2012.06.071
CrossRef Volltext / Google Scholar
22. Es sind keine frei zugänglichen ergänzenden Materialien verfügbar in: Higashi Y, Sukhanov S, Shai SY, Tang R, Snarski P, et al. Insulin-like growth factor-1-Rezeptor-Mangel in Makrophagen beschleunigt Atherosklerose und induziert eine instabile Plaque-Phänotyp in Apolipoprotein E-defizienten Mäusen. Durchblutung. (2016) 133:2263–78. doi: 10.1161/CIRCULATIONAHA.116.021805
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
23. Alexander Herr, Owens GK. Epigenetische Kontrolle der Differenzierung glatter Muskelzellen und phänotypischer Umschaltung bei Gefäßentwicklung und -erkrankung. In: Annu Rev Physiol. (2012) 74:13–40. doi: 10.1146/annurev-physiol-012110-142315
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
24. Er C, Medley SC, Hu T, Hinsdale ME, Lupu F, Virmani R, et al. PDGFRbeta-Signal reguliert lokale Entzündungen und synergisiert mit Hypercholesterinämie, um Atherosklerose zu fördern. Nat Commun. (2015) 6:7770. doi: 10.1038/ncomms8770
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
26. In: Da Ros F, Carnevale R, Cifelli G, Bizzotto D, Casaburo M, Perrotta M, et al. Das Targeting von Interleukin-1beta schützt vor Aortenaneurysmen, die durch gestörte Beta-Signalisierung des transformierenden Wachstumsfaktors induziert werden. Immunität. (2017) 47: 959-73 e9. doi: 10.1016/j.immuni.2017.10.016
CrossRef Volltext / Google Scholar
27. Hu D, Mohanta SK, Yin C, Peng L, Ma Z, Srikakulapu P, et al. Arterie tertiäre lymphatische Organe steuern die Immunität der Aorta und schützen vor Atherosklerose über glatte Gefäßmuskelzellen-Lymphotoxin-Beta-Rezeptoren. Immunität. (2015) 42:1100–15. doi: 10.1016/j.immuni.2015.05.015
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
29. Weitere Informationen finden Sie unter: Paramel Varghese G, Folkersen L, Strawbridge RJ, Halvorsen B, Yndestad A, Ranheim T, et al. NLRP3 Inflammasom Expression und Aktivierung in der menschlichen Atherosklerose. J Am Herz Assoc. (2016) 5:e003031. Geburtsdatum: 10.1161/JAHA.115.003031
CrossRef Volltext / Google Scholar
30. de Jong RJ, Paulin N, Lemnitzer P, Viola JR., Winter C, Ferraro B, et al. Protektive Eignung von Annexin A1 bei arterieller Neointima-Bildung bei Atherosklerose-anfälligen Mäusen – Kurzbericht. Arterioscler Thromb Vasc Biol. (2017) 37:312–5. ich: 10.1161/ATVBAHA.116.308744
CrossRef Volltext / Google Scholar
32. van Gils JM, Derby MC, Fernandes LR, Ramkhelawon B, Ray TD, Rayner KJ, et al. Das neuroimmune Leitwort netrin-1 fördert Atherosklerose, indem es die Auswanderung von Makrophagen aus Plaques hemmt. Nat Immunol. (2012) 13:136–43. doi: 10.1038/ni.2205
Querverweis Volltext / Google Scholar
35. Tchkonia T, Zhu Y, van Deursen J, Campisi J, Kirkland JL. Zelluläre Seneszenz und der seneszente sekretorische Phänotyp: therapeutische Möglichkeiten. In: J Clin Invest. (2013) 123:966–72. doi: 10.1172/JCI64098
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
37. Es sind keine frei zugänglichen ergänzenden Materialien verfügbar in: Majestky MW, Horita H, Ostriker A, Lu S, Regan JN, Bagchi A, et al. Differenzierte glatte Muskelzellen erzeugen eine Subpopulation von residenten vaskulären Vorläuferzellen in der Adventitia reguliert durch Klf4. Circ Res. (2017) 120:296-311. doi: 10.1161/CIRCRESAHA.116.309322
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
40. Akhavanpoor M, Gleissner CA, Akhavanpoor H, Lasitschka F, Dosch AO, Katus HA, et al. Adventitielle tertiäre lymphoide Organklassifikation bei menschlicher Atherosklerose. In: Cardiovasc Pathol. (2018) 32:8–14. doi: 10.1016/j.Karpaten.2017.08.002
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
41. Moos MP, John N, Grabner R, Nossmann S, Gunther B, Vollandt R, et al. Die Lamina adventitia ist der Hauptort der Immunzellakkumulation in Standard-Mäusen mit Apolipoprotein-E-Mangel, die mit Chow gefüttert wurden. Arterioscler Thromb Vasc Biol. (2005) 25:2386–91. doi: 10.1161/01.ATV.0000187470.31662.fe
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
42. Mohanta SK, Yin C, Peng L, Srikakulapu P, Bontha V, Hu D, et al. Die tertiären lymphatischen Organe der Arterien tragen zu angeborenen und adaptiven Immunantworten bei fortgeschrittener Maus-Atherosklerose bei. Circ Res. (2014) 114:1772-87. doi: 10.1161/CIRCRESAHA.114.301137
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
43. Büttner M, Lochner M. Entwicklung und Funktion sekundärer und tertiärer lymphatischer Organe im Dünndarm und Dickdarm. In: Front Immunol. (2016) 7:342. doi: 10.3389/fimmu.2016.00342
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
45. Srikakulapu P, Hu D, Yin C, Mohanta SK, Bontha SV, Peng L, et al. Die tertiären lymphatischen Organe kontrollieren mehrschichtige territorialisierte Atherosklerose-B-Zell-Reaktionen in gealterten ApoE-/- Mäusen. Arterioscler Thromb Vasc Biol. (2016) 36:1174–85. ich: 10.1161/ATVBAHA.115.306983
CrossRef Volltext / Google Scholar
48. van de Pavert SA, Mebius RE. Neue Einblicke in die Entwicklung lymphatischer Gewebe. Nat Rev Immunol. (2010) 10:664–74. doi: 10.1038/nri2832
Querverweis Volltext / Google Scholar
50. Barone F., Gardner DH, Nayar S., Steinthal N., Buckley CD, Luther Sa. Stromafibroblasten in tertiären lymphoiden Strukturen: ein neuartiges Ziel bei chronischen Entzündungen. In: Front Immunol. (2016) 7:477. doi: 10.3389/fimmu.2016.00477
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
51. Scandella E, Bolinger B, Lattmann E, Miller S, Favre S, Littman DR, et al. Wiederherstellung der Integrität lymphoider Organe durch Wechselwirkung lymphoider gewebeinduzierender Zellen mit Stroma der T-Zell-Zone. Nat Immunol. (2008) 9:667–75. doi: 10.1038/ni.1605
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
52. Feldmann K, Gothert JR., Homann S., Klatt C., Dick LS, et al. Deficiency in lymphotoxin beta receptor protects from atherosclerosis in apoE-deficient mice. Circ Res. (2015) 116:e57–68. doi: 10.1161/CIRCRESAHA.116.305723
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Guedj K, Khallou-Laschet J, Clement M, Morvan M, Gaston AT, Fornasa G, et al. M1 macrophages act as LTbetaR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis. Cardiovascular research. (2014) 101:434–43. doi: 10.1093/cvr/cvt263
PubMed Abstract | CrossRef Full Text | Google Scholar