Einführung
Zystische Läsionen im Perikardraum sind eine seltene Einheit und umfassen 7% der mediastinalen Massen und 33% der mediastinalen Zysten . Die gemeldete Inzidenz von Perikardzysten beträgt 1 von 1.00.000 Einwohnern, und die meisten Fälle werden zufällig festgestellt . Sie sind in der Regel in der dritten oder vierten Lebensdekade gefunden und männlich und die Weibchen sind gleichermaßen betroffen . Die meisten Fälle sind angeboren und asymptomatisch, aber lebensbedrohliche Komplikationen können im Verlauf der Krankheit auftreten. Sie sind in der Literatur unter verschiedenen Namen zu finden: le kyste pleuropericardique (Jeaubert de Beaujeu, 1945; Roche, 1954), Pleurazyste, Perikardzyste, Perikardkoelomzyste (Lambert, 1940), Quellwasserzyste (Greenfield, Steinberg und Touroff, 1943), Mesothelzyste (Churchill und Mallory, 1937) und dünnwandige Zyste .
Geschichte
(Tabelle 1) Vorläufige Berichte über Perikardzysten stammen aus der Mitte des 19. Fortschritte in der radiologischen Bildgebung machten die Diagnose vor dem Tod möglich und Le Roux berichtete 1958 in einer Massenröntgenkampagne in Edinburgh über drei Fälle von 300.000 Menschen . Der Fortschritt in der Thoraxchirurgie leitete eine neue Ära in der Behandlung dieser Läsionen ein, und Otto Pickhardt vom Lenox Hill Hospital führte 1931 die erste Resektion der Perikardzyste in New York bei einer 53-jährigen Frau durch. Die erste gemeldete Inzidenz von Perikarddivertikeln wurde 1837 von T. Hart von der Park Street School of Medicine in Dublin vorgestellt . Später wurde festgestellt, dass Perikardzysten und Divertikel verschiedene Stadien einer Läsion mit einer gemeinsamen Embryogenese darstellen. Bis dahin wurden mehrere Fälle von Perikardzysten als Perikarddivertikel gemeldet und umgekehrt. Greenfield et al., prägte den Begriff ‚Quellwasser Zysten‘ wegen ihrer dünnen, transparenten Wand und kristallklaren Flüssigkeitsgehalt. Der chirurgische Ansatz zur Perikardzyste hat seitdem mehrere Modifikationen erfahren, und derzeit wird die videoassistierte thorakoskopische Chirurgie als die vielversprechendste Technik bei der Diagnose und Behandlung von Perikardzysten angesehen .
| Jahr | Veranstaltungen |
|---|---|
| 1837 | Erstbeschreibung eines Perikarddivertikels durch T. Hart von der Park Street School of Medicine in Dublin auf Autopsie . |
| 1903 | Die erste pathoanatomische Autopsie-Fallserie mit 4 Divertikeln und 1 Zyste wurde von Rohn von der Karls-Universität Prag veröffentlicht. Erste Anerkennung der Transformationsbeziehung zwischen Perikarddivertikel und Zyste. |
| 1931 | Beschreibung des radiologischen Aussehens und Differentialdiagnose von Perikardzysten durch Wallace Yater (Georgetown University) . |
| 1931 | Erste chirurgische Entfernung der Perikardzyste durch Otto Pickhardt im Lenox Hill Hospital in New York10 |
| 1937 | Erstes Pneumogramm der Perikardzyste durchgeführt von E. H. Cushing . |
| 1940 | Adrian Lambert schlug zunächst einen ähnlichen embryologischen Ursprung von Perikardzysten und Divertikeln aus getrennten Mesenchymlakunen vor, die sich später zum Perikardcelom vereinigen . |
| 1943 | Erste Resektion eines Perikarddivertikels durch Richard Sweet am Massachusetts General Hospital in Boston . |
| 1943 | Greenfield und Kollegen führten den Begriff ‚Springwater Zyste‘ . |
| 1958 | Le Roux meldete drei Fälle von 300,000 Menschen in einer Massenröntgenkampagne in Edinburgh . |
Tabelle 1: Eine kurze Chronologie der Fortschritte in der Diagnose und Behandlung von Perikardzysten und Divertikeln.
Herkunft
Perikardzysten sind häufig angeborenen Ursprungs, aber auch andere Ursachen wurden in der Literatur beschrieben (Tabelle 2). Sie entstehen normalerweise durch Versagen der Fusion einer der mesenchymalen Lakunen, die den Perikardsack bilden . Adrian Lambert schlug vor, dass sowohl die Zyste als auch das Divertikel aus den getrennten Mesenchymlakunen stammen, die sich später zum Perikardcelom vereinigen . Lillie et al., schlug vor, dass sowohl Perikardzyste als auch Divertikel beide aus der ventralen Aussparung des Perikard-Coeloms stammen. Die Persistenz der Vertiefung bildet das Divertikel, die Verengung des proximalen Teils der persistierenden Vertiefung macht entweder ein Divertikel mit einem schmalen Hals oder eine Zyste in Verbindung mit der Perikardhöhle aus und der vollständige Verschluss der proximalen Vertiefung bildet die Perikardzyste . Die pränatale Diagnose einer Perikardzyste ist mit Ultraschalluntersuchung über die 14. Entzündliche Zysten und Pseudozysten treten aufgrund eines lokalisierten Perikardergusses auf6. Isolierte Hydatidzyste des Perikards ist extrem selten und sie sind in der Regel in Verbindung mit Myokardzyste oder Zyste an anderer Stelle im Körper gefunden .
1.Angeborene
2.Entzündlich: Rheumatische Perikarditis, bakterielle Infektion, Tuberkulose, Echinokokkose
3.Traumatisch
4.Postoperative Herzchirurgie
Tabelle 2: Ätiologie der Perikardzyste6.
Klinisches Erscheinungsbild
Patienten mit Perikardzysten sind in der Regel asymptomatisch (bis zu 60-75%) Fälle ) und die Diagnose ist in der Regel ein zufälliger Befund im Röntgenbild des Brustkorbs. Symptome treten normalerweise auf, wenn die Zyste auf einer nahe gelegenen Struktur komprimiert wird . Häufige Symptome sind chronischer Husten, Brustschmerzen, Atemnot und ein Gefühl von retrosternalem Druck. Abdul-Mannan Masood und Mitarbeiter beschrieben einen Fall von großer Perikardzyste (11 cm x 11 cm), die über Beschwerden der rechten Schulter klagte, die auf die linke Schulter ausstrahlten und im substernalen Bereich zusammen mit Atemnot gipfelten . Wiederkehrende Anfälle von Herzklopfen aufgrund von Herzrhythmusstörungen und häufigen Infektionen der unteren Atemwege wurden ebenfalls in der Literatur beschrieben . Ungewöhnliche Darstellung der Perikardzyste umfasst rezidivierende Synkope , Lungenentzündung , Herzinsuffizienz und plötzlichen Herztod.
Diagnose
Zur Diagnose einer Perikardzyste und zur Unterscheidung von anderen Erkrankungen, die sich als isolierter zystischer Schatten neben dem Herzen im Röntgenbild des Brustkorbs darstellen (Abbildung 1), ist eine weitere Bildgebung erforderlich. Befunde verschiedener Bildgebungsmodalitäten sind in Tabelle 3 dargestellt. Die Computertomographie (CT) (Abbildungen 2A und 2B) gilt als beste Methode für Diagnose und Nachsorge, da sie eine hervorragende Abgrenzung der Perikardanatomie bietet und bei der genauen Lokalisierung und Charakterisierung verschiedener Perikardläsionen, einschließlich Erguss, Perikardverdickung, Perikardmassen und angeborene Anomalien . Ungenauigkeiten treten auf, wenn sich die Zyste an einem ungewöhnlichen Ort befindet oder der Proteingehalt der Zystenflüssigkeit hoch ist . Es kann bösartiges Gewebe nicht mit großer Sicherheit von nicht bösartigen flüssigkeitsgefüllten Zysten unterscheiden . Die Magnetresonanztomographie ist eine weitere nützliche Bildgebungsmodalität, und die Flüssigkeit in der Perikardzyste erzeugt ein hyperintensives Signal auf T2-gewichteten MRT-Bildern und hypointensive Signale auf T1-gewichteten Bildern . Ein erhöhter Proteingehalt kann auch die MRT-Bilder verzerren, da sie die T2-gewichteten MRT-Signale verringern und die T1-gewichteten Signale erhöhen . Infolgedessen kann die Unterscheidung dieser Läsionen von Hämatomen oder Neoplasmen ziemlich schwierig sein. Diffusionsgewichtete MRT kann in einigen Fällen hilfreich sein. Echokardiographie und Ultraschall sind auch nützlich für die Beurteilung des Funktionsstatus des Herzens und Follow-up. Die Echokardiographie wird als primäre Diagnosemodalität wegen des engen Fensters nicht bevorzugt Visualisierung und Zysten an ungewöhnlichen Stellen können bei dieser Technik übersehen werden. Charakteristische Merkmale der Perikardzyste in verschiedenen Bildgebungsmodalitäten sowie deren Vor- und Nachteile sind in Tabelle 3 und die Differentialdiagnose in Tabelle 4 beschrieben .
| CTscan | Charakteristik: Einzelne dünnwandige, scharf definierte, ovale homogene Massen ohne Septation oder feste Komponente. Keine Verbesserung mit intravenösem Kontrast Vorteil: Mangel an Bewegungsartefakt – klares und scharfes Bild Kurze Erfassungszeit Nachteil: Fehlerhafte Meldung bei erhöhtem Proteingehalt der Flüssigkeit. Z.B. Infektion, Blutung Bestrahlung Fehlende funktionelle Beurteilung Jodierter Kontrast Notwendigkeit des Atemstillstands Bemerkungen: Beste Diagnosemodalität |
| Kardiale MRT | Charakteristik: Signal mittlerer bis niedriger Intensität bei T1-gewichteten Sequenzen und hohe Signalintensität bei T2-gewichteten Sequenzen. Keine Verbesserung mit intravenösem Kontrast Vorteil: Ausgezeichnete Weichteilarchitektur Nachteil: Zeitaufwendig Hohe Kosten Veränderte Signalgebung bei hohem Zystenproteingehalt Verkalkung weniger gut sichtbar Nur stabiler Patient Bemerkungen: Beste Diagnosemodalität, wenn CT-Scan nicht schlüssig ist |
| Echokardiographie und Ultraschall | Eigenschaften: Eine homogene echoluzente Masse mit geringer Dämpfung des Ultraschalls durch eine flüssigkeitsgefüllte Struktur niedriger Dichte. Es gibt auch einen echofreien Raum, der seine Trennung von den Herzkammern anzeigt. Vorteil: Sicher Kostengünstig Kann bei instabilen Patienten durchgeführt werden Nachteil: Eingeschränkte Fenster, enges Sichtfeld Technische Schwierigkeiten bei Adipositas, obstruktiver Lungenerkrankung oder unmittelbar nach einer Herz-Thorax-Operation Lokalisierung der Zyste an ungewöhnlicher Stelle schwierig Bedienerabhängig Anmerkungen: Beste Diagnosemodalität für Follow-up und bildgesteuerte perkutane Aspiration |
Tabelle 3: Bildgebungsmodalitäten bei Perikardzysten.
| Läsion | Unterscheidungsmerkmal |
|---|---|
| Bronchialzysten | Mit Bronchialepithel ausgekleidet |
| Lokalisierter Perikarderguss | Flüssigkeit zwischen viszeralem und parietalem Perikard |
| Teratom | Normalerweise assoziiert mit einigen festen Komponenten mit zystischen Komponenten |
| Neuroenterische Zyste | Befindet sich in der rechten hinteren Brust und ist mit Wirbelanomalien assoziiert |
| Lymphangiom | Multilokuläre oder multiple Zysten |
| Angeborene Zysten primitiven Ursprungs (bronchogene Zyste, gastroenterische Zyste und Ösophagusduplikationszyste) | Normalerweise im hinteren Mediastinum lokalisiert und vom jeweiligen Epithel ausgekleidet |
Tabelle 4: Differentialdiagnose eines isolierten zystischen Schattens neben dem Herzen .
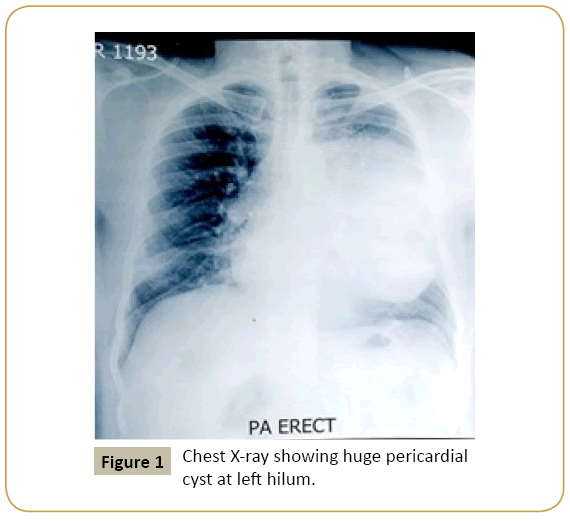
Abbildung 1: Röntgenaufnahme des Brustkorbs mit einer riesigen Perikardzyste am linken Hilum.
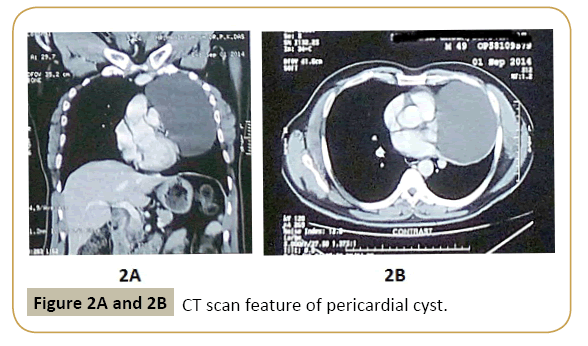
Abbildung 2A und 2B: CT-Scan-Funktion der Perikardzyste.
Komplikation
Perikardzysten sind normalerweise gutartig, aber Komplikationen können schließlich in Form von Kompression, Entzündung, Blutung oder Ruptur auftreten. Symptome treten normalerweise bei Komplikationen auf. Julius Chacha Mwita et al., berichtete über einen Fall einer 22-jährigen Frau mit einer großen (15 cm x 10 cm) Perikardzyste, die sich über den rechten Vorhof und Ventrikel komprimiert, was zu Rechtsherzinsuffizienz führt. Der Patient hatte erhöhten Jugularvenendruck, bilaterales Lochfraßpedalödem, geschwollene oberflächliche Venen in der unteren Extremität, Aszites, Hepatomegalie, linke Varikozele und ein systolisches Auswurfgeräusch Grad 2/6 über dem Präkordium. Die Elektrokardiographie erkannte eine Abweichung der rechten Achse und einen unvollständigen rechten Bündelastblock. In der Echokardiographie wurden die Vena cava inferior und die Lebervenen ohne Atemwegsvariation in der Größe der Vena cava inferior erweitert. Pankaj Kaul und Mitarbeiter beschrieben einen Fall von massiver gutartiger Perikardzyste bei einer 66-jährigen Frau mit Tachykardie, Dyspnoe, geschwollener Halsvene, violetter Verfärbung des Gesichts, Schwellung von Gesicht und Hals und Keuchen über die gesamte rechte Brust. CT-Scan, Herz-MRT und Echokardiographie zeigten eine Kompression der Zyste über dem rechten Hilus, dem rechten Vorhof, dem rechten Ventrikel, der oberen Hohlvene, dem mittleren Lappen und dem vorderen Basalsegment des unteren Lungenlappens. Die chirurgische Entfernung der Zyste wurde durch eine mediane Sternotomie angegangen. Blutungen innerhalb der Perikardzyste können spontan oder durch äußeres Trauma auftreten . Blutungen können zu einer plötzlichen schnellen Ausdehnung der Zyste führen und zu starken Schmerzen, Herztamponade und Herzinsuffizienz führen (Tabelle 5) .
1. Komplikation durch Kompression der umgebenden Struktur *Herzkompression
*Kompression der rechten Herzseite mit Septumabweichung
*Diastolische Dysfunktion
*Obstruktion des rechtsventrikulären Abflusstrakts
* Lungenstenose
• Mitralklappenvorfall
• Herzinsuffizienz
* Kompression der Lunge: Obstruktion des rechten Hauptstammbronchus, Kompression benachbarter Lappen
2. Entzündung: Perikarditis , infizierte Perikardzyste
3. Herztamponade *Intraperikardruptur
*Blutung
•Hydatidzystenruptur
4. Plötzlicher Tod
5. Andere •Vorhofflimmern
*Erosion der Zyste in die obere Hohlvene und die rechte Ventrikelwand
*Rezidivierende Synkope
*Lungenentzündung
Tabelle 5: Komplikation der Perikardzyste .
Management
Das Management von Perikardzysten ähnelt dem der mediastinalen Masse und sollte einem algorithmischen Ansatz folgen (Abbildung 3). Strategien sind konservatives Management mit Follow-up, perkutaner Aspiration und Operation. Daten zur Sicherheit des konservativen Managements fehlen und häufiges Follow-up mit Bildgebung verursacht Angst und zusätzliche finanzielle Belastung für die Patienten. Die Task Force zur Diagnose und Behandlung von Perikarderkrankungen der Europäischen Gesellschaft für Kardiologie empfahl perkutane Aspiration und multiple Sklerose als Erstbehandlung angeborener und entzündlicher Zysten . Videounterstützte Thorakotomie oder chirurgische Resektion werden als Zweitlinienbehandlung empfohlen. Kinoshita et al., berichtete über einen Fall eines 41-jährigen Patienten, der mit multipler Sklerose behandelt wurde, und in 6 Monaten Follow-up wurde kein Rezidiv gefunden. Die Daten zur Sicherheit, Wirksamkeit und langfristigen Nachsorge dieser Technik reichen jedoch nicht aus, um diese Technik als Erstlinienbehandlung für alle Fälle zu unterstützen. Die Autoren empfehlen diesen Patienten einen algorithmischen Ansatz, der auf dem Vorhandensein oder Fehlen von Symptomen, der Größe der Masse, der Kompression über die umgebenden Strukturen und der Besorgnis des Patienten basiert. Eine Operation wird bei symptomatischen Patienten, großen Zysten, radiologischen Merkmalen der Kompression oder drohenden Kompression lebenswichtiger Strukturen, Unsicherheit des malignen Potenzials und Vorbeugung lebensbedrohlicher Notfälle wie Herztamponade, Obstruktion des rechten Hauptstammbronchus und plötzlichem Tod empfohlen. Die videogestützte thorakoskopische Chirurgie ist mit weniger Traumata und einer frühen postoperativen Genesung verbunden. Die Autoren bevorzugen Echokardiographie über CT-Scan für Follow-up für keine ionisierende Strahlung und empfiehlt CT-Scan für Fälle mit Verdacht auf Komplikationen reserviert werden. Bei asymptomatischen Patienten ist möglicherweise keine Behandlung erforderlich . Der Verwaltungsalgorithmus ist in Abbildung 3 dargestellt.
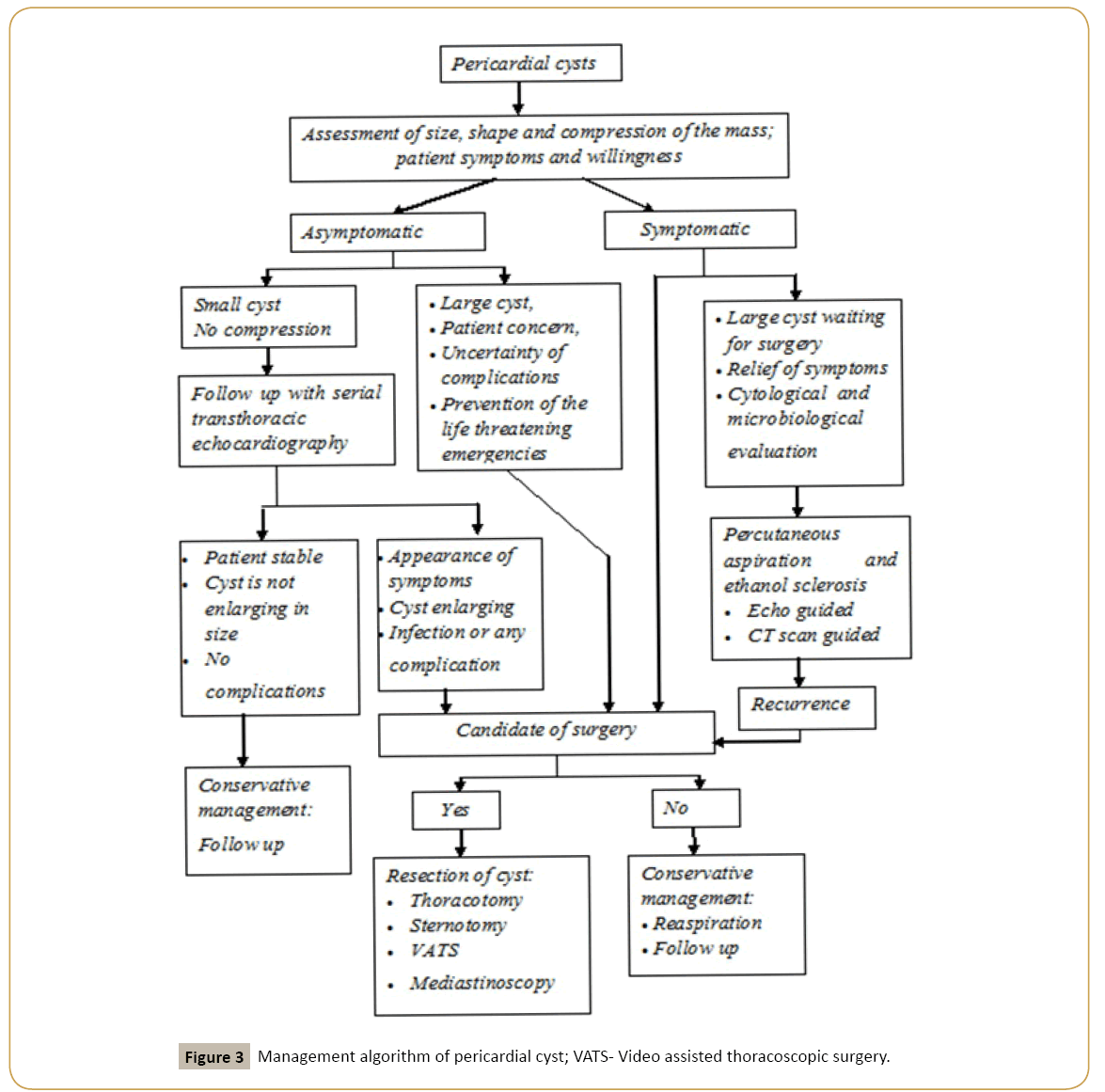
Abbildung 3: Management-Algorithmus der Perikardzyste; VATS- Video assisted thoracoscopic surgery.
Schlussfolgerung
Perikardzyste und Divertikel haben einen ähnlichen Entwicklungsursprung und können bei einem asymptomatischen Patienten als zufälliger Befund im Röntgenbild des Brustkorbs auftreten. Die Autoren empfehlen CT-Scan als diagnostische Modalität der Wahl in allen Fällen und diffusionsgewichtete kardiale MRT für Fälle mit diagnostischer Verwirrung. Die Echokardiographie bietet ein enges Fenster und Läsionen an ungewöhnlichen Stellen können bei dieser Technik übersehen werden. Die Autoren empfehlen Echokardiographie für Follow-up und bildgesteuerte Aspiration aus der Zyste. Das Managementprotokoll ähnelt dem der mediastinalen Masse. Große Zysten sollten abgesaugt werden, um das Volumen und damit die Kompressionswirkung zu reduzieren, und dann chirurgisch reseziert werden. Für das Management sollte ein algorithmischer Ansatz verfolgt werden, der von Größe, Form und Kompressibilität der Masse, Patientensymptomen, chirurgischer Fitness und Patientenpräferenz abhängt.
- Cohen AJ, Thompson L, Edwards FH, Bellamy RF (1991) Primäre Zysten und Tumoren des Mediastinums. Ann ThoracSurg 51: 378-384.
- Davis RD, Oldham HN, Sabiston DC (1987) Primäre Zysten und Neoplasmen des Mediastinums: jüngste Veränderungen in der klinischen Präsentation, Methoden der Diagnose, Management und Ergebnisse. Ann ThoracSurg 44: 229-237.
- Unverferth DV, Wooley CF (1979) Die Differentialdiagnose von parakardialen Läsionen: Perikardzysten. Cathetcardiovasc Diagn 5: 31-40.
- Patel J, Park C, Michaels J, Rosen S, Kort S (2004) Perikardzyste: Fallberichte und eine Literaturübersicht. Echokardiographie 21: 269-272.
- Elamin WF, Hannan K (2008) Perikardzyste: eine ungewöhnliche Ursache für Lungenentzündung. Fälle J 1: 26.
- Maisch B, Seferović PM, Ristić AD, Erbel R, RienmÃller R, et al. (2004) Leitlinien zur Diagnose und Behandlung von Perikarderkrankungen executive summary; Die Task Force zur Diagnose und Behandlung von Perikarderkrankungen der Europäischen Gesellschaft für Kardiologie. Eurasien J 25: 587-610.
- DE ROOVER P, MAISIN J, LACQUET A (1963) Kongenitalpleuroperikardzysten. Thorax 18: 146-150.
- Schweigert M, Dubecz A, Beron M, Ofner D, Stein HJ (2012) Die Geschichte der Quellwasserzysten: ein historischer Überblick über die Chirurgie bei angeborenen Perikarddivertikeln und Zysten. Tex Herz Inst J 39: 330-334.
- LE ROUX BT (1959) Perikardkoelomische Zysten. Thorax 14: 27-35.
- Pickhardt OC (1933) Pleurodiaphragmatische Zyste. In: Transaktionen der New York Surgical Society-Ein Treffen am 1. April 1933. Ann Surg 99: 814-816.
- Hart T (1837) Ein Bericht über Hernie Perikardii. Dublin J Med Sci 11: 365-367.
- Greenfield L, Steinberg L, Touroff AS (1943) Quellwasserzyste des Mediastinums. J Thorakalchirurgie 12: 495-502.
- Rohn A (1903) Ueberdivertikel- und cystenbildung am Perikard . Prag Med Wochschr 28: 461-464.
- Yater WM (1931) Zyste der pericardium.Am Herz J 6: 710-712.
- Cushing EH (1937) Divertikel des Perikards. Arch Intern Med 59: 56-64.
- Lambert AV (1940) Ätiologie dünnwandiger Thoraxzysten. J Thorakalchirurgie 10: 1-7.
- MAZER ML (1946) Wahres Perikarddivertikel; Bericht über einen Fall mit sicherer operativer Entfernung. Bin J Röntgenol Radium Ther 55: 27-29.
- LILLIE WI, McDonald JR, CLAGETT OT (1950) Perikardzysten und Perikarddivertikel; ein Konzept der Ätiologie und des Fallberichts. J Thorakalchirurgie 20: 494-504.
- Lewis KM, Sherer DM, Gonçalves LF, Fromberg RA, Eglinton GS (1996) Pränatale sonographische Diagnose einer Perikardzyste im mittleren Trimester. PrenatDiagn 16: 549-553.
- Bernasconi A, Yoo SJ, Golding F, Langer JC, Jaeggi ET (2007) Ätiologie und Ergebnis von pränatal nachgewiesenen parakardialen zystischen Läsionen: eine Fallserie und Überprüfung der Literatur. Ultraschall ObstetGynecol 29: 388-394.
- Dasbaksi K, Haldar S, Mukherjee K, Mukherjee P (2015) Eine seltene Kombination von Leber- und Perikardhydatidzysten und Literaturübersicht. Int J Surg Fall Rep 10: 52-55.
- Kosecik M, Karaoglanoglu M, Yamak B (2006) Perikardhydatidzyste mit Herztamponade. Can 22: 145-147.
- Borges AC, Gellert K, Dietel M, Baumann G, Witt C (1997) Akute rechtsseitige Herzinsuffizienz aufgrund einer Blutung in eine Perikardzyste. Ann ThoracSurg 63: 845-847.
- Sokouti M, Halimi M, Golzari SE (2012) Perikardzyste als chronischer Husten: ein seltener Fallbericht. Tanaffos 11: 60-62.
- Mejía Lozano P, Pérez Ortiz E, PuchaesManchón C (2010) Herztamponade aufgrund einer Pleuroperikardzyste mit invasivem Lungenkrebs. Arch Bronconeumol 46: 658-659.
- Satur CM, Hsin MK, Dussek JE (1996) Riesenperikardzysten. Ann ThoracSurg 61: 208-210.
- Masood AM, Ali OM, Sequeira R (2013) Ein Versteck im Futter: schmerzhafte Perikardzyste. BMJ Fall Rep 2013.
- Ilhan E., Altin F., Ugur O., Özkara S., Kayacioglu I., et al. (2012) Eine ungewöhnliche Darstellung der Perikardzyste: rezidivierende Synkope bei einem jungen Patienten. Cardiol J 19: 188-191.
- Forouzandeh F, Krim SR, Bhatt R, Abboud LN, Ramchandani M, et al. (2012) Die Entstehung der Pneumonie. Tex Herz Inst J 39: 296-297.
- Lau CL, Davis RD (2004) Kapitel 56: Das Mediastinum, in Sabistons Lehrbuch der Chirurgie, (17thedn.) Philadelphia, Elsevier 1738-1739 und 1758.
- Wang ZJ, Reddy GP, Gotway MB, Yeh BM, Hetts SW, et al. (2003) CT- und MR-Bildgebung von Herzbeutelerkrankungen. Röntgenaufnahmen 23 Spec No: S167-180.
- Raja A, Walker JR, Sud M, Du J, Zeglinski M, et al. (2011) Diagnose von Perikardzysten mittels diffusionsgewichteter Magnetresonanztomographie: Eine Fallserie. J Med Fall Rep 5: 479.
- Jeung MEINE, Gasser B, Gangi A, Bogorin A, Charneau D, et al. (2002) Bildgebung von zystischen Massen des Mediastinums. Röntgenbilder 22 Spez.-Nr.: S79-93.
- Peebles CR, Shambrook JS, Harden SP (2011) Perikardkrankheit – Anatomie und Funktion. Br J Radiol 84 Spez.-Nr. 3: S324-337.
- Verhaert D, Gabriel RS, Johnston D, Lytle BW, Desai MY, et al. (2010) Die Rolle der multimodalen Bildgebung bei der Behandlung von Perikarderkrankungen. CircCardiovasc Bildgebung 3: 333-343.
- Rohn A (1903) Ueberdivertikel- und cystenbildung am Perikard. Prag Med Wochschr 28: 461-464.
- de Bustamante TD, Azpeitia J, Miralles M, Jiménez M, Santos-Briz A, et al. (2000) Pränatale sonographische Detektion von Perikardteratomen. J Clin, 28: 194-198.
- Mwita JC, Chipeta P, Mutagaywa R, Rugwizangoga B, Ussiri E (2012) Perikardzyste mit rechtsventrikulärer Kompression. Pan Afr Mit J 12: 60.
- Kaul P, Javangula K, Farook SA (2008) Massive benigne Perikardzyste mit gleichzeitigen Syndromen der oberen Hohlvene und des Mittellappens. J Kardiothorakchirurgie 3: 32.
- Marigliano A, Cirio EM, Versace R (2010) Perikardzyste mit intrazystischer Blutung. Ein Fallbericht und Überprüfung der Literatur. G ItalCardiol (Rom) 11: 493-497.
- Temizkan V, Onan B, Inan K, Ucak A, Yilmaz AT (2010) Blutung in eine Perikardzyste und damit verbundene rechtsventrikuläre Kompression nach stumpfem Brusttrauma. Ann ThoracSurg 89: 1292-1295.
- Najib MQ, Chaliki HP, Raizada A, Ganji JL, Panse PM, et al. (2011) Symptomatische Perikardzyste: eine Fallserie. Eur J Echokardiographie 12: E43.
- Martins IM, Fernandes JM, Gelape CL, Braulio R, Silva Vde C, et al. (2011) Eine große Perikardzyste mit Kompression der rechten Herzkammern. Rev. Cir Cardiovasc 26: 504-507.
- Lesniak-Sobelga AM, Olszowska M, Tracz W (2008) Riesige Perikardzyste, die den rechten Ventrikel komprimiert. Ann ThoracSurg 85: 1811.
- McMillan A, Souza CA, Veinot JP, Turek M, Hendry P, et al. (2009) Eine große Perikardzyste, die durch eine Perikarditis bei einem jungen Mann mit einer mediastinalen Masse kompliziert wird. Ann ThoracSurg 88: e11-13.
- Hoque M, Siripurapu S (2005) Methicillin-resistente Staphylococcus aureus-infizierte Perikardzyste. Mayo ClinProc 80: 1116.
- El Hammoumi MM, Sinaa M, El Oueriachi F, Arsalane EIN, Kabiri EH (2014) . Rev Mal Respir 31: 442-446.
- Shiraishi I, Yamagishi M, Kawakita A, Yamamoto Y, Hamaoka K (2000) Akute Herztamponade durch massive Blutung aus Perikardzyste. Auflage 101: E196-197.
- Kumar Paswan A, Prakash S, Dubey RK (2013) Herztamponade durch hydatide Perikardzyste: ein seltener Fallbericht. Anesth Schmerz Med 4: e9137.
- Fredman CS, Parsons SR, Aquino TI, Hamilton WP (1994) Plötzlicher Tod nach einem Stresstest bei einem Patienten mit einer großen Perikardzyste. Am Herzen J 127: 946-950.
- Generali T, Garatti A, Gagliardotto P, Frigiola A (2011) Rechte mesotheliale Perikardzyste zur Bestimmung hartnäckiger atrialer Arrhythmien. InteractCardiovascThoracSurg 12: 837-839.
- Kar SK, Ganguly T, Dasgupta CS, Goswami A (2014) Kardiovaskuläre und Atemwegsüberlegungen in der mediastinalen Masse während der Thoraxchirurgie. J ClinExpCardiolog 5: 354.
- Kinoshita Y, Shimada T, Murakami Y, Sano K, Tanabe K, et al. (1996) Multiple Sklerose kann eine sichere und nützliche Behandlung für Perikardzysten sein. ClinCardiol 19: 833-835.