Epoxid-Ringöffnungsreaktionen – SN1 vs. SN2, Regioselektivität und Stereoselektivität
Die nichtenzymatischen Ringöffnungsreaktionen von Epoxiden bieten einen schönen Überblick über viele der Konzepte, die wir bereits in diesem Kapitel gesehen haben. Ringöffnungsreaktionen können entweder durch SN2- oder SN1-Mechanismen ablaufen, abhängig von der Art des Epoxids und den Reaktionsbedingungen. Wenn das Epoxid asymmetrisch ist, variiert die Struktur des Produkts je nachdem, welcher Mechanismus dominiert. Wenn ein asymmetrisches Epoxid in basischem Methanol einer Solvolyse unterzogen wird, Die Ringöffnung erfolgt durch einen SN2-Mechanismus, und der weniger substituierte Kohlenstoff ist der Ort des nukleophilen Angriffs, was zu dem führt, was wir als Produkt B bezeichnen werden:

Umgekehrt, wenn Solvolyse in saurem Methanol auftritt, tritt die Reaktion durch einen Mechanismus mit erheblichem SN1-Charakter auf, und der substituiertere Kohlenstoff ist der Angriffsort. Infolgedessen überwiegt das Produkt A.

Dies sind beides gute Beispiele für regioselektive Reaktionen. In einer regioselektiven Reaktion sind zwei (oder mehr) verschiedene Konstitutionsisomere als Produkte möglich, aber eines wird bevorzugt (oder manchmal ausschließlich) gebildet.
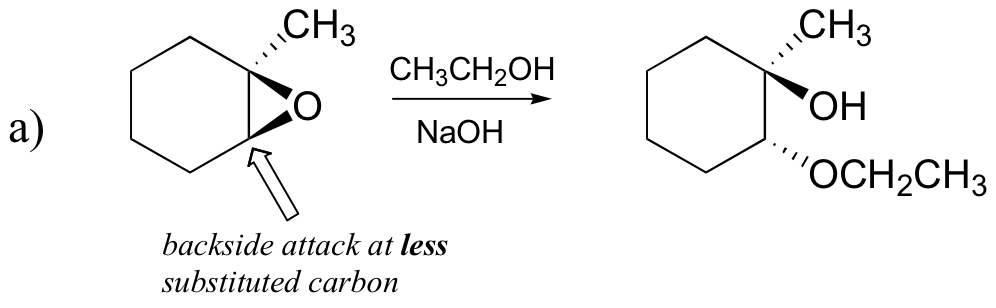
Lassen Sie uns zuerst den grundlegenden SN2-Fall untersuchen. Die Abgangsgruppe ist ein Alkoholatanion, da keine Säure zur Verfügung steht, um den Sauerstoff vor der Ringöffnung zu protonieren. Ein Alkoholat ist eine schlechte Abgangsgruppe, und daher ist es unwahrscheinlich, dass sich der Ring ohne einen ‚Stoß‘ vom Nukleophil öffnet.

Das Nukleophil selbst ist potent: ein deprotoniertes, negativ geladenes Methoxidion. Wenn eine nukleophile Substitutionsreaktion eine schlechte Abgangsgruppe und ein starkes Nukleophil beinhaltet, Es ist sehr wahrscheinlich, dass es durch einen SN2-Mechanismus abläuft.
Was ist mit dem Elektrophilen? Es gibt zwei elektrophile Kohlenstoffe im Epoxid, aber das beste Ziel für das Nukleophil in einer SN2-Reaktion ist der Kohlenstoff, der am wenigsten gehindert wird. Dies erklärt das beobachtete regiochemische Ergebnis. Wie bei anderen SN2-Reaktionen findet der nukleophile Angriff von der Rückseite statt, was zu einer Inversion am elektrophilen Kohlenstoff führt.
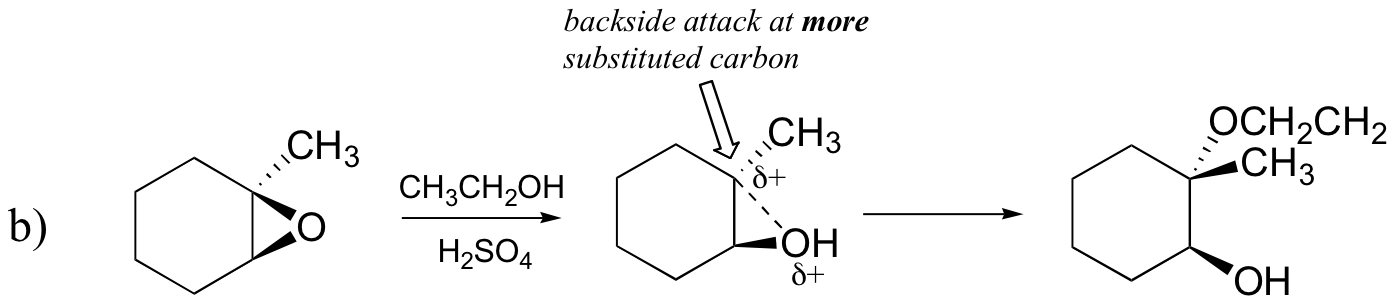
Wahrscheinlich ist der beste Weg, die säurekatalysierte Epoxid-Ringöffnungsreaktion darzustellen, ein Hybrid oder eine Kreuzung zwischen einem SN2- und SN1-Mechanismus. Zuerst wird der Sauerstoff protoniert, wodurch eine gute Abgangsgruppe entsteht (Schritt 1 unten) . Dann beginnt die Kohlenstoff-Sauerstoff-Bindung zu brechen (Schritt 2) und positive Ladung beginnt sich auf dem mehr substituierten Kohlenstoff aufzubauen (erinnern Sie sich an die Diskussion aus Abschnitt 8.4B über Carbokationsstabilität).

Anders als bei einer SN1-Reaktion greift das Nukleophil den elektrophilen Kohlenstoff an (Schritt 3), bevor sich ein vollständiges Carbokationszwischenprodukt bilden kann.

Der Angriff erfolgt bevorzugt von der Rückseite (wie bei einer SN2-Reaktion), da die Kohlenstoff-Sauerstoff-Bindung noch zu einem gewissen Grad vorhanden ist und die Sauerstoffblöcke von der Vorderseite angreifen. Beachten Sie jedoch, wie sich das regiochemische Ergebnis von der basisch katalysierten Reaktion unterscheidet: im säurekatalysierten Prozess greift das Nukleophil den stärker substituierten Kohlenstoff an, da dieser Kohlenstoff einen höheren Grad an positiver Ladung aufweist.
Aufgabe 8.17:
Vorhersage der Hauptprodukte der Ringöffnungsreaktion, die auftritt, wenn das unten gezeigte Epoxid behandelt wird mit:
a) Ethanol und einer kleinen Menge Natriumhydroxid
b) Ethanol und einer kleinen Menge Schwefelsäure

Hinweis: Achten Sie darauf, sowohl Regiochemie als auch Stereochemie zu berücksichtigen!
Khan Academy Videos

Ringöffnung unter sauren Bedingungen: