Inferior Petrosal Sinus Sampling (IPSS) ist ein invasives Verfahren, bei dem adrenocorticotrope Hormonspiegel (ACTH) aus den Venen entnommen werden, die die Hypophyse entwässern; Diese Spiegel werden dann mit den ACTH-Spiegeln im peripheren Blut verglichen, um festzustellen, ob ein Hypophysentumor (im Gegensatz zu einer ektopischen ACTH-Quelle) für das ACTH-abhängige Cushing-Syndrom verantwortlich ist. IPSS kann auch verwendet werden, um festzustellen, auf welcher Seite der Hypophyse sich der Tumor befindet.
Die Cushing-Krankheit resultiert aus einer übermäßigen Cortisolproduktion aufgrund erhöhter ACTH-Spiegel, die von einem Hypophysentumor produziert werden. Im Gegensatz dazu umfasst das Cushing-Syndrom alle Zustände des Hyperkortisolismus, die entweder auf ACTH-abhängige Ursachen (z. B. Cushing-Krankheit oder ektopische ACTH-Sekretion durch einen nichtpituitären Tumor) oder auf ACTH-unabhängige Ursachen (z. B. übermäßige autonome Sekretion von Cortisol aus einem hyperfunktionellen Nebennierenrindentumor) zurückzuführen sind.
Andere und seltenere Zustände, die zum Cushing-Syndrom führen können, umfassen ektopische Corticotropin-Releasing-Hormon (CRH) -Sekretion, primäre bilaterale pigmentierte noduläre Nebennierenhyperplasie, makronodulare Nebennierenhyperplasie, ektopische Wirkungen von magenhemmenden Peptiden und andere Syndrome wie das McCune-Albright-Syndrom und das Carney-Syndrom. Pseudo-Cushing-Zustände mit ähnlichen klinischen Darstellungen können bei Depressionen und Alkoholabhängigkeit gefunden werden. Cushingoid-Merkmale können auch bei Fettleibigkeit gefunden werden.
Die Unterscheidung der ACTH-abhängigen von der ACTH-unabhängigen Cushing-Krankheit ist oft einfach, aber es kann schwierig sein, die Cushing-Krankheit von einem Hyperkortisolismus zu unterscheiden, der durch eine ektopische ACTH-Sekretion (dh aus einer nichtpituitären Quelle) verursacht wird zyklische und intermittierende Sekretion durch ACTH-sekretierende Tumoren und die unterschiedlichen Empfindlichkeiten und Spezifitäten der verschiedenen biochemischen Tests. (2002) ist der Wert der Querschnittsbildgebung beim ACTH-abhängigen Cushing-Syndrom auch eingeschränkt, da in bis zu 10% der bei gesunden jungen Menschen durchgeführten MRT-Untersuchungen kleine nicht funktionierende Hypophyseninzidentome vorhanden sind.
Die schlechte Empfindlichkeit der Bildgebung für Mikroadenome der Hypophyse ist ein weiteres Problem. ACTH-sekretierende Hypophysenadenome sind bei Standard-1,5-T- oder 3-T-MRT sowie bei dynamischer Kontrastbildgebung schwer zu identifizieren. In der Mehrzahl der Fälle ist die routinemäßige kontrastverstärkte T1-gewichtete MRT in dünnen Schichten in der Lage, anatomische Details bereitzustellen und das IPS-Drainagemuster zu identifizieren. In einigen Fällen, wenn das Drainagemuster nicht identifiziert werden kann, hilft selbst die räumliche Auflösung nicht, die komplexe Anatomie darzustellen. In einer solchen Situation hilft IPSS allein, die Cushing-Krankheit aufgrund ektopischer ACTH-sekretierender Tumoren vom Cushing-Syndrom zu unterscheiden, und ist daher immer noch der Goldstandard für die Diagnose von ACTH-sekretierenden Hypophysenadenomen. Es ist bekannt, dass IPSS die Cushing-Krankheit genau diagnostizieren kann, und es ist auch bekannt, dass die MRT eine größere Genauigkeit bei der Lokalisierung der Stelle des Adenoms bietet. Kakade et al. haben vorgeschlagen, dass im Falle von zweideutigen MRT Hypophyse Befunde, vorherige IPSS kann unnötige transsphenoidale Chirurgie vermeiden. Eine Studie berichtet, dass die 7T-MRT dazu beitragen kann, die standardmäßige 1.5T- und 3T-MRT-negative Cushing-Krankheit zu erkennen und IPSS in Zukunft vorzubeugen.
Geschichte der Petrosal Sinus Sampling
IPSS wurde 1977 von Corrigan et al. eingeführt, die über die Verwendung von einseitiger selektiver Katheterisierung und venöser Probenahme zur Lokalisierung der ACTH-Sekretion bei einem Patienten mit einem verwirrenden klinischen und Laborbild berichteten, das entweder mit einer ektopischen ACTH-Sekretion oder einem hypophysenabhängigen Cushing-Syndrom kompatibel ist. Später wurde festgestellt, dass die ACTH-Spiegel in der Hypophysenvenendrainage asymmetrisch sein können, entweder aufgrund der Lage des corticotropen Adenoms oder asymmetrischer Variationen in der venösen Anatomie.
Die Hypophysenvenendrainage ist normalerweise ipsilateral, so dass die Venendrainage auf der kontralateralen Seite relativ zum Adenom häufig keine hohe ACTH-Konzentration aufweist. (1984) schlugen eine gleichzeitige Probenahme aus beiden unteren Nasennebenhöhlen (IPSs) vor, um falsch negative Ergebnisse bei Vorliegen eines Hypophysen-Corticotropen Adenoms zu vermeiden. Dieses Verfahren wurde als bilaterale inferiore Petrosalsinusprobenahme (BIPSS) bezeichnet.
Viele corticotrope Adenome sind anfällig für eine Stimulation durch exogen verabreichtes CRH, wie es erstmals 1991 von Oldfield et al. beschrieben wurde, um die Empfindlichkeit von BIPSS zu erhöhen. In den verschiedenen berichteten Studien wurden zwei verschiedene Formen von CRH verwendet: Schaf-CRH (oCRH) und Human-CRH (hCRH). Nieman et al (1989) haben berichtet, dass die peripheren ACTH- und Cortisol-Reaktionen auf oCRH signifikant höher waren als bei humanem CRH.
Zukunft und Kontroversen
Einige Zentren haben eine verbesserte Genauigkeit und intrasellare Lokalisation mit bilateraler Sinus cavernosus-Probenahme berichtet, aber es besteht ein erhöhtes Risiko für Hirnnervenlähmung, so dass diese Technik noch nicht an Popularität gewonnen hat.
Internal jugular venous Sampling (IJVS) wurde auch als technisch einfachere Alternative zu BIPSS versucht. Radvany et al. vergleich von IJVS mit IPSS bei 30 aufeinanderfolgenden Patienten mit MRT-negativem ACTH-abhängigem Cushing-Syndrom. Ihre Ergebnisse zeigen, dass IJVS bei der Diagnose der Hypophyse als Quelle für übermäßiges ACTH nicht so hilfreich ist wie IPSS. Obwohl IJVS eine ähnliche Spezifität wie BIPSS aufweist, weist es laut Ilias et al. eine geringere Sensitivität auf (83% gegenüber 94%).
Unter Verwendung von Proben aus IPSS haben Oklu et al. 3 kleine potenzielle Biomarker der Cushing-Krankheit identifiziert (Pyridoxat, Desoxycholsäure und Trimethyladipat). Diese können die Tumorbiologie aufklären und in Zukunft mögliche diagnostische molekulare Bildgebungssonden und therapeutische Ziele bei Patienten mit rezidivierenden Erkrankungen nach der Operation vorschlagen.
Relevante Anatomie
Eine detaillierte Beschreibung der relevanten Anatomie wurde von Miller und Doppman (1991) bereitgestellt (siehe Bild unten).
 Anatomie der Nasennebenhöhle Inferior
Anatomie der Nasennebenhöhle Inferior Bei den meisten Menschen verengt sich die IPS zu einer einzigen Vene und entleert sich in die ipsilaterale Vena jugularis interna (IJV). Bei etwa 25% der Personen bildet die IPS-Drainage einen Plexus von Kanälen, die sich in das IJV entleeren. Bei 0,6% -7% der Personen besteht keine Verbindung zwischen dem IJV und dem IPS, was eine Standardprobenahme unmöglich macht.
Bei ungefähr 60% der Personen ist die Hypophysenvenendrainage symmetrisch, wobei der größte Teil des venösen Abflusses von jeder Seite der Hypophyse in das ipsilaterale IPS abfließt. Infolgedessen kann BIPSS bei den meisten Menschen ein wirksames Instrument sein, um corticotrope Adenome zu lateralisieren und falsch negative Ergebnisse zu vermeiden.
Doppman et al (1999) führten die 0.8% Prävalenz von falsch-negativen Ergebnissen zu einem hypoplastischen oder anomalen IPS. Shiu et al (1968) beschrieben zunächst ein Klassifikationssystem für die anatomischen IPS-Varianten. Bonelli et al (2000) haben eine Modifikation des Klassifikationssystems von Shiu et al wie folgt beschrieben:
-
Typ I (siehe Bild unten): Eine IPS-Anastomose mit dem IJV; Die vordere Kondylenvene fehlt oder verbindet sich mit der IPS an einem definierten Ursprung; das kurze Segment der Vene vom Punkt dieser Anastomose bis zum IJV wird als inferior condylar confluence bezeichnet
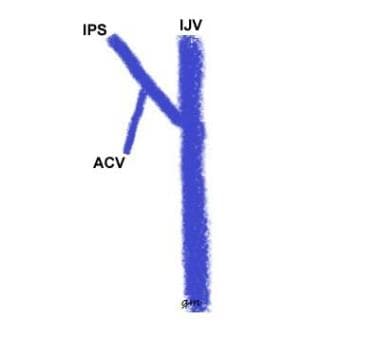 IPS variant type 1
IPS variant type 1 -
Typ II (siehe Bild unten): Ein gemeinsamer Ursprung des IPS und der vorderen Kondylenvene mit dem IJV
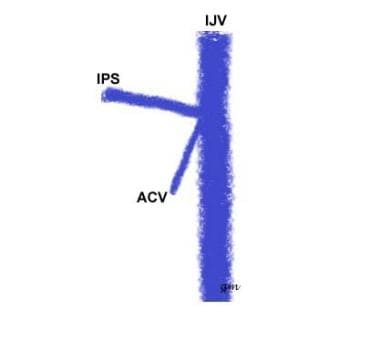 IPS-Variante Typ 2
IPS-Variante Typ 2 -
Typ III (siehe Bild unten): Ein IPS bestehend aus mehreren kleinen Kanälen, die mit dem IJV kommunizieren
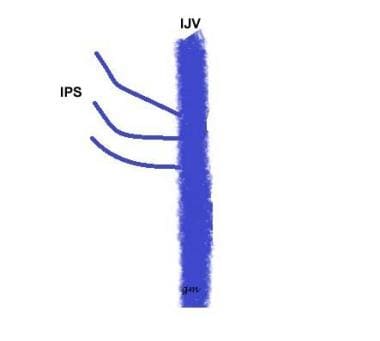 IPS variant type 3
IPS variant type 3 -
Typ IV (siehe Bild unten): Ein IPS, das mit der vorderen Kondylenvene kommuniziert und nicht mit dem IJV
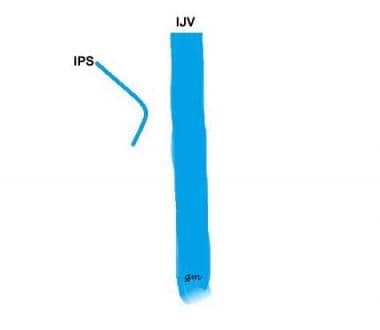 IPS-Variante Typ 4
IPS-Variante Typ 4
 IPS variant type 1
IPS variant type 1  IPS-Variante Typ 2
IPS-Variante Typ 2  IPS variant type 3
IPS variant type 3  IPS-Variante Typ 4
IPS-Variante Typ 4