26. Oktober 2020, von NCI-Mitarbeitern
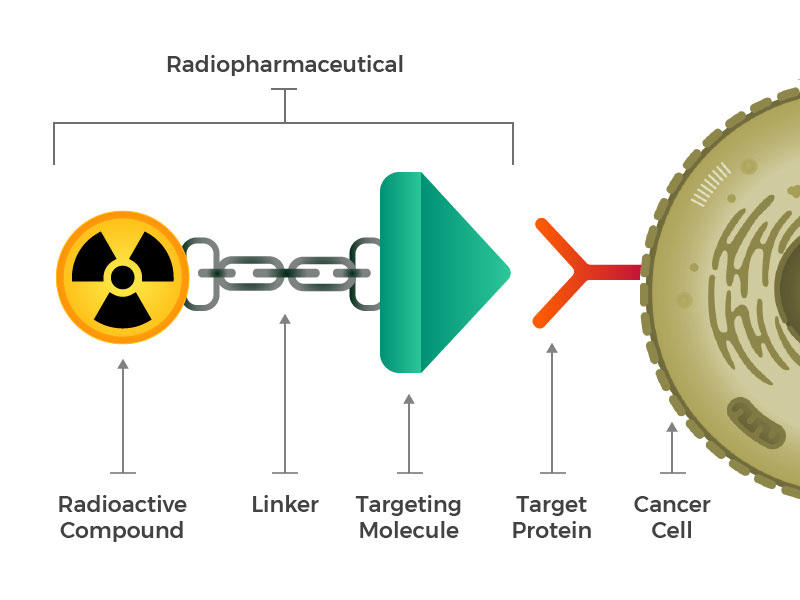
Radiopharmazeutika bestehen aus einem radioaktiven Molekül, einem Zielmolekül und einem Linker, der die beiden verbindet.
Die letzten zwei Jahrzehnte haben die Art und Weise, wie viele Krebsarten behandelt werden, grundlegend verändert. Gezielte Therapien schalten bestimmte Proteine in Krebszellen aus, die ihnen helfen, zu wachsen, sich zu teilen und sich auszubreiten. Immuntherapien stimulieren oder unterdrücken das körpereigene Immunsystem, um Krebs zu bekämpfen. Aber lange verwendete Behandlungen – Chirurgie, Chemotherapie und Strahlentherapie — bleiben das Rückgrat der Behandlung für die meisten Krebsarten.
Die Strahlentherapie wurde erstmals vor mehr als 100 Jahren zur Behandlung von Krebs eingesetzt. Etwa die Hälfte aller Krebspatienten erhält es noch irgendwann während ihrer Behandlung. Und bis vor kurzem wurden die meisten Strahlentherapien wie vor 100 Jahren durchgeführt, indem Strahlungsstrahlen von außerhalb des Körpers abgegeben wurden, um Tumore im Körper abzutöten.
Obwohl wirksam, kann externe Strahlung auch Kollateralschäden verursachen. Selbst mit modernen Strahlentherapiegeräten „muss man normales Gewebe haben, um zu einem Tumor zu gelangen“, sagte Charles Kunos, M.D., Ph.D., vom Cancer Therapy Evaluation Program (CTEP) des NCI. Die daraus resultierenden Nebenwirkungen der Strahlentherapie hängen von der behandelten Körperregion ab, können jedoch Geschmacksverlust, Hautveränderungen, Haarausfall, Durchfall und sexuelle Probleme umfassen.
Jetzt entwickeln Forscher eine neue Klasse von Medikamenten namens Radiopharmazeutika, die eine Strahlentherapie direkt und spezifisch an Krebszellen abgeben. In den letzten Jahren gab es eine Explosion von Forschung und klinischen Studien, in denen neue Radiopharmaka getestet wurden.
Diese Studien haben gezeigt, dass die gezielte Strahlentherapie auf zellulärer Ebene das Risiko von kurz- und langfristigen Nebenwirkungen der Behandlung verringern und gleichzeitig ermöglichen kann, dass selbst winzige Ablagerungen von Krebszellen im ganzen Körper abgetötet werden.
„Ich denke, sie werden die Radioonkologie in den nächsten 10 bis 15 Jahren verändern“, sagte Dr. Kunos.
Aufbauend auf einer natürlichen Affinität
Strahlung direkt an Zellen zu liefern, ist selbst kein neuer Ansatz. Eine solche Therapie, radioaktives Jod genannt, wird seit den 1940er Jahren zur Behandlung einiger Arten von Schilddrüsenkrebs eingesetzt. Eine radioaktive Version des Elements kann im Labor hergestellt werden. Wenn es eingenommen wird (als Pille oder Flüssigkeit), sammelt es sich in Krebszellen an und tötet sie ab, die nach einer Schilddrüsenoperation übrig geblieben sind.
Eine ähnliche natürliche Affinität wurde später ausgenutzt, um Medikamente zur Behandlung von Krebs zu entwickeln, der sich auf die Knochen ausgebreitet hat, wie Radium-223-Dichlorid (Xofigo), das 2013 zur Behandlung von metastasiertem Prostatakrebs zugelassen wurde. Wenn Krebszellen im Knochen wachsen, führen sie dazu, dass das Knochengewebe, in das sie eindringen, zusammenbricht. Der Körper versucht dann, diesen Schaden zu reparieren, indem er diesen Knochen ersetzt — ein Prozess, der als Knochenumsatz bezeichnet wird.
Das radioaktive Element Radium „sieht aus wie ein Kalziummolekül, so dass es in Bereiche des Körpers eingebaut wird, in denen der Knochenumsatz am höchsten ist“, wie Bereiche, in denen Krebs wächst, erklärte Dr. Kunos. Das Radium ist dann in der Lage, Krebszellen in der Nähe abzutöten.
Diese radioaktiven Verbindungen wandern alle ohne Hilfe zu Krebszellen. Die Forscher fragten sich, ob es möglich wäre, neue radioaktive Moleküle zu entwickeln, die spezifisch auf andere Krebsarten abzielen.
Sie stellten sich technische Radiopharmaka vor, die aus drei Hauptbausteinen bestehen: einem radioaktiven Molekül, einem Targeting-Molekül (das Krebszellen erkennt und spezifisch daran bindet) und einem Linker, der die beiden verbindet. Solche Verbindungen könnten injiziert, infundiert, inhaliert oder eingenommen werden und dann in den Blutkreislauf gelangen.
Die Idee, ein gegen Krebs gerichtetes Molekül mit einem Molekül zu verknüpfen, das Krebszellen abtötet, ist ebenfalls nicht neu. Zum Beispiel wurden mehrere Medikamente, sogenannte Antikörper–Wirkstoff-Konjugate, bei denen ein Antikörper, der an bestimmte Krebszellen bindet, mit einem toxischen Medikament verbunden ist, zur Behandlung von Krebs zugelassen.
Aber die Bemühungen, solche Medikamente zu entwickeln, haben nur begrenzten Erfolg gehabt, erklärte Dr. Kunos, weil es nicht ausreicht, dass Toxine in die Nähe einer Krebszelle gebracht werden. Die Toxine müssen nach innen genommen werden und bleiben lange genug in den Zellen, um Schäden zu verursachen. Viele Krebszellen haben oder entwickeln Mechanismen, um Giftstoffe einfach wieder herauszupumpen, bevor dies passieren kann.
Radiopharmazeutika wirken auch dann am besten, wenn die Medikamente in die Zellen gelangen können. Aber das ist nicht notwendig, damit sie effektiv sind. Sobald ein Radiopharmazeutikum an einer Krebszelle haftet, wird die radioaktive Verbindung auf natürliche Weise abgebaut. Dieser Zerfall setzt Energie frei, die die DNA benachbarter Zellen schädigt. Und wenn die DNA einer Zelle irreparabel beschädigt wird, stirbt diese Zelle. Krebszellen reagieren besonders empfindlich auf strahleninduzierte DNA-Schäden.
Abhängig von der Art der verwendeten radioaktiven Verbindung kann die resultierende Energie die an das Radiopharmazeutikum gebundene Zelle sowie etwa 10 bis 30 Zellen, die diese Zelle umgeben, durchdringen. Dies erhöht die Anzahl der Krebszellen, die mit einem einzigen radiopharmazeutischen Molekül abgetötet werden können.
Mitte der 2010er Jahre hatte die Food and Drug Administration (FDA) zwei Radiopharmaka zugelassen, die auf bestimmte B-Zellen abzielen, um einige Menschen mit Non-Hodgkin-Lymphom, einer Art Blutkrebs, zu behandeln. Aber diese Medikamente wurden nie weit verbreitet. Nur wenige Ärzte, die Patienten mit Lymphomen behandeln, wurden geschult, um diese Arten von radioaktiven Verbindungen zu verabreichen. Und die Radiopharmazeutika standen im Wettbewerb mit neueren, nicht radioaktiven Medikamenten.
Der Game-Changer für das Feld kam im Jahr 2018, sagte Jacek Capala, Ph.D., von NCIS Strahlenforschungsprogramm, als die FDA Lutetium Lu 177-dotatate (Lutathera) für die Behandlung bestimmter krebsartiger neuroendokriner Tumoren (NETs), die den Verdauungstrakt betreffen, genehmigte.
„Dies zeigte, dass solide Tumoren auch auf diese Weise gezielt werden können“, sagte er mit einem Radiopharmazeutikum, das von Grund auf neu gebaut wurde. In diesem Fall sind die Ziele bestimmte Hormonrezeptoren, die in Hülle und Fülle auf der Oberfläche von Nervenzellen vorkommen.
Lutetium Lu 177-dotatate verlangsamte das Nettowachstum besser als jedes zuvor getestete Medikament, erklärte Dr. Aman Chauhan von der University of Kentucky, der mehrere neue klinische Studien mit dem Medikament leitet. „Das war ein großer Schritt nach vorne für unser Feld“, sagte er.
Anpassung von Medikamenten aus bildgebenden Verbindungen
Forscher entwickeln und testen jetzt Radiopharmaka für eine Reihe von Krebsarten wie Melanom, Lungenkrebs, Darmkrebs und Leukämie, sagte Dr. Capala. Jeder Tumor, der ein zielbares Molekül auf der Oberfläche seiner Zellen und eine gute Blutversorgung hat — ausreichend, um Medikamente zu liefern — könnte möglicherweise mit Radiopharmaka behandelt werden, fügte Dr. Chauhan hinzu.
Viele dieser neueren Medikamente sind überarbeitete Versionen bestehender Verbindungen, die für die nukleare Bildgebung verwendet werden. Nukleare Bildgebungstests wie die Positronen-Emissions-Tomographie (PET) verwenden manchmal schwach radioaktive Verbindungen, die mit Molekülen verknüpft sind, die an bestimmte Ziele auf der Oberfläche von Krebszellen binden. Spezialisierte Kameras können dann sogar winzige Ablagerungen von Krebszellen aufdecken und so die Ausbreitung von Krebs im Körper messen.
Forscher haben nun diese Targeting—Moleküle wiederverwendet, um stattdessen stärkere radioaktive Verbindungen oder Isotope zu tragen – solche, die Krebszellen töten könnten, anstatt sie einfach zu visualisieren.
Prostatakrebs war ein frühes Testfeld für diese Umnutzung. Ein Protein namens PSMA kommt in großen Mengen — und fast ausschließlich — auf Prostatazellen vor. Durch die Fusion eines Moleküls, das an PSMA bindet, mit einer radioaktiven Verbindung, die in der PET-Bildgebung verwendet wird, konnten Wissenschaftler winzige Ablagerungen von Prostatakrebs sichtbar machen, die zu klein sind, um mit herkömmlicher Bildgebung nachgewiesen zu werden.
Mehrere radiopharmazeutische Behandlungen, die auf PSMA abzielen, werden derzeit in klinischen Studien getestet.
Die meisten Prostatakrebsarten sind sehr strahlenempfindlich, und externe Strahlung wird häufig zur Behandlung der Krankheit eingesetzt, erklärte Frank Lin, MD, vom NCI Center for Cancer Research, der eine klinische Studie mit einem PSMA-Targeting-Radiopharmazeutikum am NIH Clinical Center leitet.
Die meisten Männer, die als Erstbehandlung bestrahlt werden, erleben kein Wiederauftreten ihres Krebses. Aber wenn sie es tun, breitet es sich manchmal im ganzen Körper aus, mit vielen kleinen Ablagerungen von Krebszellen in vielen Organen, erklärte er.
„Wenn sich der Tumor so ausgebreitet hat, können Sie keine externe Strahlung mehr durchführen, da externe Strahlung nur auf einen kleinen Teil Ihres Körpers gleichzeitig fokussiert und behandelt werden kann“, sagte Dr. Lin.
Ein Radiopharmazeutikum, das auf PSMA abzielt, ist in diesen Fällen eine bessere Möglichkeit, Strahlung abzugeben, da es direkt in den Blutkreislauf infundiert werden kann und weit verbreitet zirkuliert und an Prostatakrebszellen bindet, die sich im ganzen Körper ausgebreitet haben, erklärte er.
Und ein großer Vorteil von Bildgebungs- und Behandlungsmolekülen, die dasselbe Ziel verwenden, besteht darin, dass die Bildgebung den Ärzten eine Vorschau darauf geben kann, ob die Behandlung wahrscheinlich funktioniert, fügte Dr. Lin hinzu.
Zum Beispiel müssen Männer in der Studie von Dr. Lin vor der Behandlung einen PET-Scan mit der bildgebenden Version der Verbindung durchführen lassen. Wenn die bildgebende Verbindung den Weg zu den Krebszellen findet und auf dem PET-Scan nachgewiesen wird, können die Forscher davon ausgehen, dass die entsprechende radiopharmazeutische Behandlung ihr Ziel erreicht.
„Diese komplementäre Entwicklung der Diagnostik Hand in Hand mit medikamentösen Therapien macht dieses Feld so viel spannender“, sagte Dr. Chauhan. „Auf diese Weise können wir wissen, dass wir die Therapie direkt an die Tumorzellen liefern.“
Umstellung auf Kombinationstherapien
Während Radiopharmazeutika in frühen Studien vielversprechend waren, ist es auch unwahrscheinlich, dass sie, wie es bei anderen Arten von Krebsmedikamenten der Fall ist, einen Tumor selbst auslöschen.
Zum Beispiel verdoppelte Lutetium Lu 177-dotatate die Anzahl der Menschen, deren neuroendokrine Tumoren nach der Behandlung schrumpften, mehr als, aber diese Zahl war immer noch bescheiden: etwa 17%, gegenüber 7% ohne das Medikament, erklärte Dr. Chauhan.
„Es gibt noch erheblichen Raum für Verbesserungen“, sagte er.
Die Verwendung von Radiopharmaka in Kombination mit anderen Therapien kann eine Möglichkeit sein, diese Verbesserung voranzutreiben. Einige Forscher testen jetzt Radiopharmaka in Kombination mit Strahlensensibilisatoren — Medikamente, die Krebszellen noch anfälliger für Strahlung machen. Zum Beispiel leitet Dr. Chauhan eine klinische Studie mit Lutetium-177-Dotatat in Kombination mit einem Strahlensensibilisator namens Triapin, der Zellen daran hindert, die Verbindungen zu produzieren, die für die DNA-Reparatur nach strahleninduzierten Schäden benötigt werden.
In einer anderen Studie testet Dr. Lin Lutetium Lu 177-dotatat mit einer Art Medikament namens PARP-Inhibitor. Diese Medikamente, die bereits zur Behandlung einiger Arten von Brust-, Eierstock- und anderen Krebsarten zugelassen sind, blockieren den Prozess der DNA-Reparatur selbst. „Die Strahlung würde also die DNA schädigen, und der PARP-Inhibitor würde verhindern, dass die Tumorzellen ihre DNA nach der Bestrahlung heilen“, erklärte er.
Andere Forscher kombinieren Radiopharmaka mit Immuntherapien, um die Wirksamkeit dieser Medikamente zu steigern. „Jüngste Studien haben gezeigt, dass Radiopharmaka Tumore besser auf eine Immuntherapie ansprechen lassen können“, sagte Dr. Capala.
Viele Tumore seien „kalte“ Tumore, erklärte er, da Immunzellen sie nicht erkennen oder in der Mikroumgebung um Tumore herum nicht richtig funktionieren, erklärte er.
Aber wenn Strahlung Krebszellen tötet, können Proteine und DNA aus diesen Zellen in den Blutkreislauf gelangen, damit Immunzellen sie sehen können, was es den Immunzellen ermöglichen kann, andere Krebszellen im ganzen Körper zu erkennen und abzutöten. Die Strahlentherapie kann auch die Tumormikroumgebung für Immunzellen gastfreundlicher machen, fügte Dr. Capala hinzu.
Zusammen können diese Effekte einen kalten Tumor in einen „heißen“ Tumor verwandeln: einen Tumor, der eine Fülle von Immunzellen aufweist und auf Immuntherapeutika ansprechen kann. Einige Studien haben versucht, externe Strahlung zu verwenden, um diese Art von Reaktion zu erzeugen.
„Aber es gibt Daten, die darauf hindeuten, dass das besser funktioniert, wenn jeder Tumor, jede Metastase Strahlung ausgesetzt ist. Die radiopharmazeutische Therapie hat dort also den Vorteil, dass sie, sobald sie im Körper ist, alle Metastasen erreicht „, erklärte Dr. Capala.
Es kann sogar sinnvoll sein, Radiopharmaka mit externer Strahlung zu kombinieren, solange eine sorgfältige Behandlungsplanung eine sichere Gesamtstrahlendosis gewährleisten kann, fügte Dr. Capala hinzu. „Externe Strahlentherapie ist sehr gut im Targeting von großen Tumoren, und dann könnte man es mit radiopharmazeutischen Therapie kombinieren, um Metastasen zu zielen“, sagte er.
Herausforderungen und Vorsichtsmaßnahmen
Der Bereich der Radiopharmazeutika steckt noch in den Kinderschuhen. Eine Herausforderung, die der Ansatz überwinden muss, bevor er breiter eingesetzt werden kann, ist der Mangel an Ärzten, die für die Verabreichung solcher Medikamente geschult sind.
„Die Zahl der Nuklearmediziner in den USA ist gering“, sagte Dr. Lin, der sowohl in Nuklearmedizin als auch in medizinischer Onkologie ausgebildet ist. „Und ich denke, wir trainieren nur vielleicht 70 oder 80 neue Leute pro Jahr.“
Bisher hat dieser Arbeitskräftemangel Radiopharmazeutika davon abgehalten, ihr wahres Potenzial als personalisierte Behandlung auszuschöpfen, erklärte Dr. Capala. Dieses Potenzial spiegelt die Tatsache wider, dass Ärzte im Gegensatz zu anderen Arten von Krebsmedikamenten mithilfe der Bildgebung fast in Echtzeit genau messen können, wie viel von einem Radiopharmazeutikum einen Tumor erreicht hat, und die Dosis entsprechend anpassen können.
Diese Art der Behandlungsplanung erfordert jedoch multidisziplinäres Fachwissen, das nicht allgemein verfügbar ist und dazu geführt hat, dass Menschen Radiopharmaka eher als „radioaktive Chemotherapie“ mit einer einheitlichen Dosis verwenden, fügte er hinzu. „Dies bedeutet, dass viele Patienten nicht optimal behandelt werden“, sagte Dr. Capala.
Langfristige Sicherheitsstudien sind ebenfalls erforderlich, fügte Dr. Chauhan hinzu. Bei Menschen, die mit einer externen Strahlentherapie behandelt werden, können Monate oder Jahre nach der Behandlung einige Nebenwirkungen auftreten, die als Spätfolgen bezeichnet werden — wie die Entwicklung von Zweitkrebs. Obwohl die bisherige Forschung keine hohe Rate an Spätfolgen einer radiopharmazeutischen Behandlung gezeigt hat, „sind dies sehr neue Wirkstoffe, und wir müssen weiterhin vorsichtig sein und sie überwachen“, sagte er.
Da diese Medikamente relativ neu sind, „kratzen wir nur an der Oberfläche der Medikamentenentwicklung für Radiopharmaka“, sagte Dr. Chauhan.
Um die Studien mit vielversprechenden neuen Radiopharmaka weiter voranzutreiben, startete NCI 2019 die Radiopharmazeutische Entwicklungsinitiative (FEI), um vielversprechende neue Medikamente schneller in die klinische Erprobung zu bringen.
Eine Sache, die NCI mit der FEI erreichen will, ist, mehr Studien mit Kombinationen von Medikamenten zu vermitteln, die von verschiedenen Pharmaunternehmen hergestellt werden, die sonst vielleicht nicht zusammenarbeiten, erklärte Dr. Kunos, der die Initiative leitet. Bedenken hinsichtlich des geistigen Eigentums und mangelndes Vertrauen können solche Projekte stoppen, bevor sie beginnen, erklärte Dr. Kunos.
„Diese Art von Zusammenarbeit würde nicht unbedingt stattfinden, wenn NCI nicht der ehrliche Makler in der Mitte wäre“, sagte er. Derzeit testen nur etwa 2% der von NCI unterstützten Frühphasenstudien Radiopharmaka, aber mit der FEI könnte dies in den kommenden Jahren exponentiell zunehmen, fügte er hinzu.
„Wir werden Maschinen oder andere Techniken, die wir in der Strahlentherapie verwenden, nicht eliminieren“, sagte Dr. Kunos. „Aber mit ihrer gezielten Natur denken wir, dass Radiopharmazeutika die Art und Weise, wie wir Strahlung nutzen, verändern werden.“