Abbildung 4: Struktur des Auges.Dieses Bild stammt von Chirstie (ref. 4) und ist nach der angegebenen Quelle urheberrechtlich geschützt (d.h. es handelt sich nicht um ein eigenes Werk des Autors).
Dastruktur des Auges: Der Bereich im Auge (siehe Abbildung 4), der Licht und Farbe erkennt, wird als Netzhaut bezeichnet. Die zwei vorhandenen Zelltypen, Stäbchen und Zapfen, verarbeiten Informationen, die durch die Linse kommen, und senden sie über den Sehnerv zum Gehirn. Stäbchenzellen (von denen es etwa 100 Millionen gibt) erkennen den Grad der Helligkeit, die in das Auge eintritt, und ihre Empfindlichkeit hängt von der Menge des vorhandenen Rhodopsins ab, das selbst in den Zellen erzeugt wird. Rhodopsin wird jedoch durch Bleichen bei Lichteinwirkung zerstört, und daher arbeiten Stäbchenzellen nur bei schwachem Licht, da bei hoher Beleuchtung der reduzierte Gehalt dieses lichtempfindlichen Pigments zu einer sehr geringen Empfindlichkeit führt. Zapfenzellen (von denen es etwa 3 Millionen gibt) sind ebenfalls lichtempfindlich, behalten ihre Funktion jedoch bis zu einer hohen Ausleuchtung durch Verwendung des Pigments Iodopsin bei.Die Erkennung der Farbe ist eine Funktion der drei Arten von Zapfenzellen, die in der Netzhaut vorhanden sind: Zwischen ihnen decken sie das sichtbare Spektrum ab. Dies liegt daran, dass jeder Typ für einen anderen Wellenlängenbereich empfindlich ist, wobei das Maximum Rot (lang), Grün (mittel) oder Blau (kurz) entspricht.
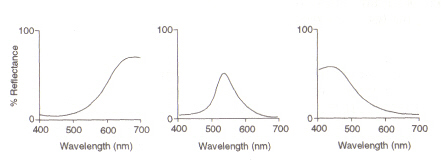
Abbildung 5: Maximalwerte von (von links) roten, grünen und blauen Kegelzellen. Dieses Bild stammt von Chirstie (ref. 4) und ist nach der angegebenen Quelle urheberrechtlich beschränkt (d.h. es handelt sich nicht um eigene Werke der Autoren).
Der Mechanismus von Rhodopsin innerhalb der Stäbchenzellen: Das Protein Rhodopsin enthält den protonierten Retinal-Schiff-Basenkomplex, der natürlich in der Intermembrantasche liegt, die von den sieben Transmembran-a-Helikalrezeptoren gebildet wird. Es gibt viele flache Scheiben von Rhodopsin innerhalb des äußeren Segments der Arod-Zelle, die bei Lichtdetektion eine photoisomere Veränderung von Rhodopsin (11-cis) zu all-trans-Retinal erfahren. Nach der Photoisomerisierungskaskade, die über 5 kurzlebige Zwischenprodukte erfolgt (Flussdiagramm 1), diffundiert transretinal weg und wird vor dem Wiedereintritt in den Zyklus wieder in 11-Cisretinal umgewandelt. Dieser Prozess erfolgt durch Reduktion zu alpha-Trans-Retinol, gefolgt von Oxidation/Isomerisierung im Dunkeln. PhotoexcitedRhodopsin (4. der 5 Vermittler) löst einen enzymatischen Kaskaden processresulting in der Hydrolyse von GMP aus. Dies wiederum schließt kationenspezifische Kanäle innerhalb der Stäbchenzellmembran, die natürlicherweise für den Zustrom von Na + im Dunkeln offen sind, und aufgrund des Effekts der Hyperpolarisation sendet die innere Synapse ein Nervensignal an andere Neuronen in der Netzhaut. Schließlich hilft das lichtinduzierte Absenken des Kalziumspiegels, angeregte Neuronen in einen passiven, „dunklen“ Zustand zu versetzen, und der Zyklus beginnt bei Erkennung von Licht erneut. Thephotoreceptors von Kegelzellen sind auch sieben a-helicalreceptors mit 11-cis-retinal als ihr Chromophor. Der Nachweisbereich variiert von grün nach rot, da die drei unpolaren hydroxylhaltigen Reste nearetinal nacheinander durch polare ersetzt werden.

Links – Abbildung 6: Position der 11-cis-Netzhaut innerhalb von Rhodopsin. Dieses Bild stammt von Stryer (ref. 6) und ist entsprechend der angegebenen Quelle urheberrechtlich eingeschränkt (d.h. es handelt sich nicht um eigene Werke der Autoren).
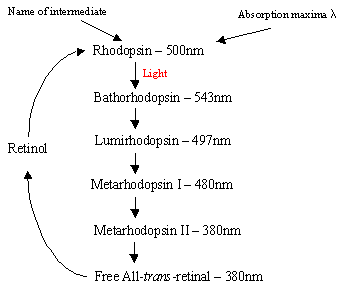
Rechts – Flussdiagramm1: Die 5 Zwischenprodukte des Rhodopsinzyklus.
Woher kommt Rhodopsin?
Menschen können kein Hodopsin herstellen, stattdessen verwenden sie eine externe Quelle, B-Carotin, das in Lebensmitteln vorkommt, um es zu synthetisieren:
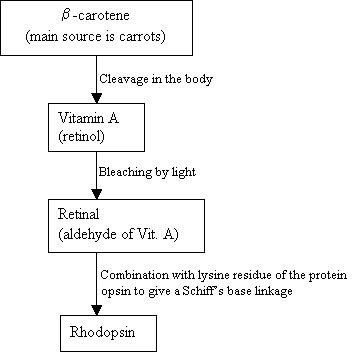 |
Flussdiagramm 2: Die Synthese von Rhodopsin Neues Bild =Abbildung 7: Die Strukturen von B-Carotin (oben), VitaminA (Mitte) und 11-cis Retinal (unten). |
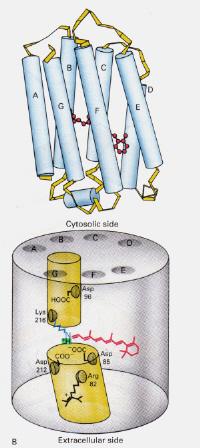
Wie unterscheidet sich der Mechanismus vonbacteriorhodopsin in Halobakterien von dem von Rhodopsin in den Zellen des menschlichen Auges?: Dieses Mal blockiert der protonierte Retinal-Schiff-Basiskomplex auf natürliche Weise einen Kanal durch die Membran, der sonst durch zwei benachbarte Kammern gebildet wird. Der protonierte trans-Komplex spendet ein Proton an Asp-85, das dann den Austritt desselben Protons auf die extrazelluläre Seite ermöglicht. Die Photoisomerisierung zur 13-cis-Struktur ermöglicht es der Schiff-Base, ein Proton aus dem Asp-96-Rest auf der cytosolischen Seite aufzunehmen. Nach der Umorientierung der cis-Form zur trans setzt sich der Zyklus der Isomerisierung und Protonenpumpung fort.