Calmodulin
Dies ist eine Video-Einführung in das Calcium-Signalprotein Calmodulin aus der Sicht eines anorganischen Chemikers!
Calmodulin oder CaM ist ein Polypeptid, das in allen eukaryotischen Zellen allgegenwärtig ist. Dieses Protein ist als Calmodulin bekannt, da es ein kalziummoduliertes Protein ist, das eine wichtige Rolle bei der Kalziumsignaltransduktion spielt. Calciumsignaltransduktion ist der Prozess, durch den die Wechselwirkungen zwischen Calciumionen und zahlreichen Proteinen die Kommunikation zwischen Zellen vermitteln. die Funktion von Calmodulin ist daher in allen eukaryotischen Zellen notwendig, und einige der Aufgaben, die es zu erfüllen hilft, sind Nervensignale, Skelettmuskelbewegungen und Gedächtnis. Durch die Erfassung von Calciumionen in der Umgebung aktiviert Calmodulin und wirkt anschließend als Zwischenprodukt, initiiert die Bindung wichtiger Proteine wie Kinasen und unterstützt unsere Zellen bei der grundlegenden und komplexen Funktion („Calmodulin“).
Das folgende Video zeigt die strukturelle Veränderung, die innerhalb von CaM während der Calciumbindung auftritt (PDB-Codes 3CLN und 1CFD).
Das Protein selbst ist 148 Aminosäuren lang mit zwei globulären Regionen, die jeweils 2 EF-Hand-Motive enthalten, die charakteristische Stellen von Calcium-vermittelten Polypeptiden sind. Bei Aktivierung beherbergt Calmodulin 4 Ca2 + -Ionen, die die Form des Proteins drastisch verändern. Wenn Calmodulin an die Calciumionen bindet, öffnet sich das Protein von seiner Apo-Form zu seiner Halo-Form und legt eine Alpha-Helix frei, die als Linker oder zentrale Tether-Region bekannt ist. Geprägt für seine Flexibilität ist die zentrale Tether-Region der Ort des Proteins, an dem Partnerproteine binden und zu der Kaskade beitragen, die die sekundäre Quelle von Kalzium ist. Aufgrund seiner Struktur und seines Funktionsbedarfs an Calciumionen muss Calmodulin in der Lage sein, Calciumionen im Zytoplasma auszuwählen, und die Wechselwirkungen zwischen dem Ion und den Liganden in den EFD-Domänen unterstützen diese Idee der Selektivität (Bertini et. Al., 635-638).
Dieses Bild zeigt, wie ein EF-Hand-Motiv einer Hand ähnelt. Das Farbbanddiagramm links zeigt eines der vier charakteristischen Helix-Turn-Helix-Handmotive von calmodulin. (HVE-Code 3CLN)
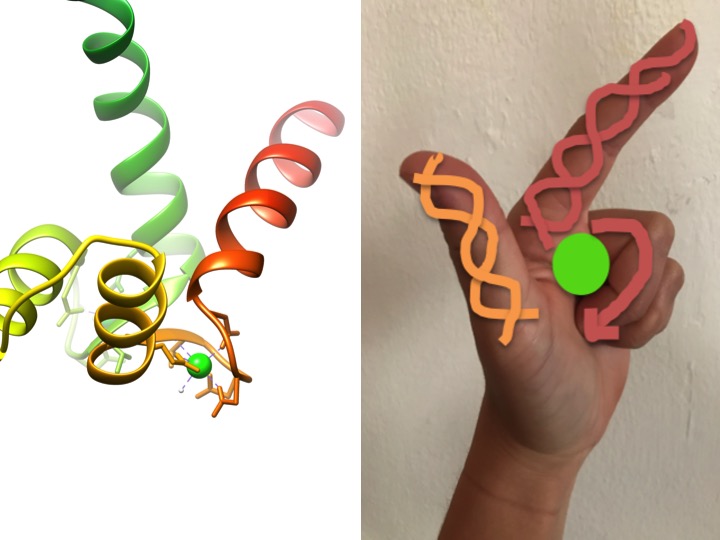
EF-Handmotive sind hochkonservierte Strukturregionen von Proteinen, die an der Bindung von Kalzium beteiligt sind. Diese Bereiche werden als „Hand“ -Motive bezeichnet, da sie einer Hand ähneln, die in Form eines L ausgeführt ist, wobei sich das Metallion in der Mitte der Faust befindet, die Alpha-Helices durch den nach oben gerichteten Zeigefinger und den nach innen gerichteten Daumen angezeigt werden und die gekräuselten Finger den Dreh- oder Schleifenbereich darstellen. Dies wird in der obigen Abbildung gezeigt. In einem charakteristischen rechten Motiv binden Aminosäuren einschließlich Glutamate, Asparagine, Asparaginsäuren und Glutaminsäuren an Ca sowie Wasser (Bertini et. Al. 639). Die typische EF-Hand-Domänenbindungssequenz ist in der folgenden Abbildung dargestellt.
Dieser Cartoon veranschaulicht die koordinierten Aminosäuren in einer typischen EFD-Domäne (Die genaue Aminosäurezusammensetzung variiert!). Die gestrichelte Linie stellt die Koordination von Ca zum Sauerstoff eines Rückgratcarbonyls dar, während durchgezogene Linien die Koordination zu Seitenketten oder Wasser anzeigen.
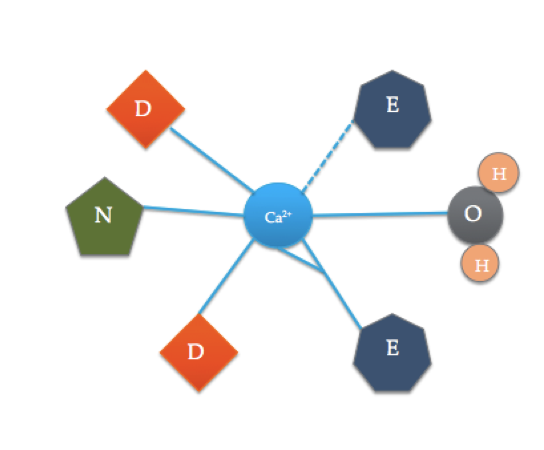
Die Calmodulin-Bindungsstelle unterscheidet sich etwas von der oben gezeigten typischen EF-Handdomäne. Die 6 Liganden von Calmodulin umfassen die Seitenketten von drei Asparaginsäuren (D), 1 Glutaminsäure (E), die zwei koordinierte kovalente Bindungen mit dem Ion bildet, 1 Wassermolekül aus der Lösung und 1 Carbonylmolekül aus dem Rückgrat. Die Bindungsstelle von Calmodulin besteht aus einem Ca2 + -Ion, das von 6 Liganden umgeben ist, während es 7 Bindungen bildet.
Man kann feststellen, dass das EF-Motiv innerhalb von Calmodulin viele der gleichen Liganden enthält, nur an verschiedenen Stellen. Diese Konformation kann eine Vorstellung davon vermitteln, warum Calmodulin für Calcium selektiv ist und wie nur die Anwesenheit eines Calciumions die Bindungsstelle befriedigen kann, die die Aktivierung des Proteins bewirkt. Dies hängt mit der Thermodynamik von Calmodulin in der Zelle zusammen und wie es auf die Anwesenheit von Calciumionen reagiert.
Um die Thermodynamik zu verstehen, die die Aktivierung von Calmodulin koppelt, muss man zuerst die Konzentration von Ionen wie Calcium und Magnesium in einer eukaryotischen Zelle, einschließlich der eines Menschen, verstehen. Die Konzentration dieser Ionen muss genau reguliert werden. Innerhalb der Zelle geht die Calciumsignalisierung mit einem vorübergehenden Anstieg der Calciumionenkonzentration einher, der von Proteinen wie Calmodulin (Bertini et. Al., 636). Dieser Kalziumanstieg könnte auf intrazelluläre G-Proteine zurückzuführen sein, die das raue und glatte Retikulum dazu veranlassen, Kalzium freizusetzen, oder die Kalziumionen könnten aus dem extrazellulären Raum eingebracht werden. Im Falle von Calmodulin reagiert es normalerweise darauf, dass Kalzium von außen in die Zelle gebracht wird, was bei Prozessen wie Nervensignalen auftritt (Bertini et. Al. 637). Bevor die Calciumkonzentration kurzzeitig erhöht wird, liegt die Konzentration innerhalb der Zelle üblicherweise zwischen 10-100 nm, während während des kurzen Ioneneinstroms die Konzentration auf 1.000-100.000 nm ansteigt. Die Konzentrationsänderung bewirkt, dass das Calmodulin die Calciumionen erfasst, bindet und eine weitere Signaltransduktion initiiert (Bertini et. Al., 635).
Wie bindet Calmodulin dann endgültig Calciumionen und nicht beispielsweise Magnesiumionen? Mg2 + -Ionen sind Calciumionen tatsächlich ziemlich ähnlich: sie würden eher elektrostatische als kovalente Wechselwirkungen eingehen und gelten als harte Atome. Der Grund, warum Calmodulin Calciumionen anstelle von Magnesiumionen zu bevorzugen scheint, hängt mit den Bindungskonstanten jedes Ions zusammen. Calmodulin kann existieren, während es an andere Ionen wie Magnesium gebunden ist, aber wenn es eine höhere Konzentration an Kalzium gibt, konkurrieren die Calciumionen sofort mit den Magnesiumionen, um Calciumbindungsstellen zu besetzen. Dies liegt daran, dass die Bindungskonstante von CaM und Ca2+ (Ka) größer ist als die von CaM und Mg2 +, wie in Abbildung 7 gezeigt. Dies deutet darauf hin, dass Calmodulin bei Bindung an Calciumionen mehr Produkte produzieren würde. Man muss all diese Ideen berücksichtigen, wenn man bedenkt, dass dieser Prozess unzählige Male pro Sekunde abläuft und der Umsatz dieses Proteins sich ändert, um auf die ständig modulierte Calciumkonzentration der Zelle zu reagieren.
Warum ist die Calmodulinbindung mit Calciumionen günstiger als mit anderen Metallen? Dies könnte an der Größe der Ionen in Bezug auf die durch die Liganden induzierte sterische Behinderung liegen. Die Bindungsstelle ist durch 6 Liganden gekennzeichnet, die 7 koordinierte Bindungen bilden. Da Calciumionen größer als Magnesiumionen sind, wie in Abbildung 8 gezeigt, ist es möglich, dass Calcium bevorzugt wird, da es den Abstand der Liganden voneinander vergrößert und somit die sterischen Wechselwirkungen zwischen den Liganden verringert. Die Struktur des Proteins selbst könnte auch einen Grund für die Selektivität von Calciumionen darstellen. Insgesamt ist bekannt, dass Calmodulin aufgrund der Thermodynamik, die auf der Variation der zellulären Konzentration von Calciumionen basiert, die Zunahme von Ionen spürt, sie bindet und dabei hilft, seine Funktion auszuführen.
Nocken + Ca2+ <–> Ca2+Nocken (KCaM-Ca)
Nocken + Mg2+ <–> Mg2+Nocken (KCaM-Mg)
Mg2+-Nocken + Ca2+ <–> Ca2+Nocken + Mg2+
weil KCaM-Ca > KCaM-Mg
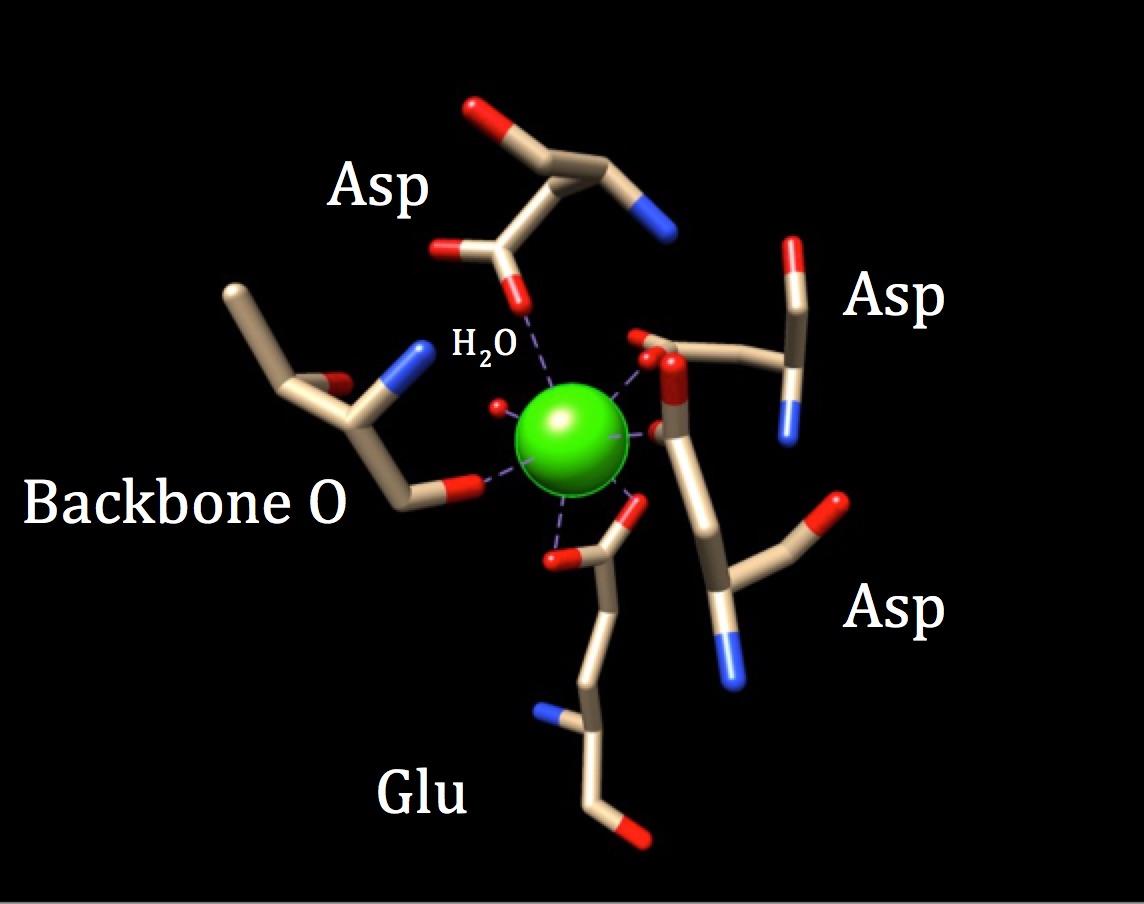
In einer weiteren Diskussion der Chemie der Bindungsstelle von Calmodulin sollte die Koordinationsgeometrie untersucht werden. Da das Calciumion mit sieben Donoratomen interagiert, wird das System als Heptadentatsystem bezeichnet. Da Calmodulin von sechs Liganden umgeben ist, würde man von einer oktaedrischen Koordinationsgeometrie ausgehen. Da jedoch einer der Liganden zweizähnig mit dem Ion interagiert – was bedeutet, dass er zwei koordinierte kovalente Bindungen aufweist, die von verschiedenen Atomen in einer Aminosäure stammen —, nimmt der Koordinationskomplex eine verzerrte oktaedrische Form an. Die spezifische Koordination ist in der folgenden Abbildung dargestellt.
Die Koordinationsgeometrie der Kalziumbindungsstelle von Calmodulin. Das zentrale Calciummetallion ist von drei Asparaginen (Asp), einem Rückgratsauerstoff, einer Gluatminsäure (Glu) und einem Wassermolekül umgeben. (HVE-Code 3CLN)
Wir können uns auch auf die Theorie des Chelateffekts beziehen, um die Fähigkeit von Calmodulin, mit hoher Affinität an Metallionen zu binden, besser zu verstehen. Ein Chelator ist ein Atom, das mit mehr als einem Donoratom binden kann. Die Polydentatbindung hängt mit dem Chelateffekt zusammen, der besagt, dass, wenn ein Ligand mit vielen Donorgruppen (Poly) bindet, die koordinierten kovalenten Bindungen viel stärker oder fester gehalten werden. Diese Theorie wird durch die Thermodynamik gestützt, insbesondere dass die Polydentatbindung die Entropie eines Systems erhöht und es positiver (mehr Störung) macht, was thermodynamisch günstig ist. Die Anwendung dieser Theorie auf Calmodulin hilft, nicht nur die Bedeutung der Polydendatbindung innerhalb der Stellen selbst zu erklären, sondern auch die Notwendigkeit, dass das Protein 4 verschiedene Calciumionen bindet, um seine Funktion zu aktivieren. Indem im Wesentlichen die Bindung von vier Ca2 + -Ionen innerhalb der Stellen erforderlich ist, fördert das System eine Erhöhung der Entropie, indem mehr Substrate / Reaktanten eingeführt werden, um eine größere Anzahl von Produkten zu bilden. Dies geschieht aufgrund der höheren Anzahl von Bindungen innerhalb der Ligandenwechselwirkungen jeder Bindungsstelle. Alles in allem wird die Bindung des Calciumions an den Stellen des Polypeptids durch die Chelateffekttheorie unterstützt und beleuchtet die Effizienz von Calmodulin bei der Bindung von Calcium.
EF-Handmotive haben eine bestimmte Struktur, die auf der Tatsache beruht, dass Kalzium das zentrale Metall ist. Dies gilt auch für die Calmodulin-Bindungsstellen. Das Ca2 + -Ion bindet mit ähnlichen Atomen in den Strukturen bestimmter Aminosäuren, basierend auf einer Theorie, die als Hart / Weich-Säure-Base-Theorie bezeichnet wird. Diese Theorie trennt Metalle und Liganden in zwei Kategorien, basierend auf der Polarisierbarkeit und ihrem Verhältnis von Ladung zu Radius. Harte Säuren und Basen sind kleinere Ionen, die ein größeres Verhältnis von Ladung zu Größe haben, und dies führt dazu, dass sie auf elektrostatische Weise interagieren (was Anziehungen zwischen + und – Ladungen bedeutet), während weiche Säuren und Basen größer sind und daher ein kleineres Verhältnis von Ladung zu Größe aufweisen, was dazu führt, dass sie Bindungen mit kovalentem Charakter eingehen. Der Ausdruck „Gleiches bindet mit gleichem“ bezieht sich auf die Tatsache, dass harte Säuren und Basen dazu neigen, mit anderen harten Atomen zu interagieren, und dasselbe gilt für weiche Säuren und Basen. Ca2 + wird als harte Säure charakterisiert, da es, obwohl es einen großen Radius hat, meist elektrostatisch mit Liganden interagiert. Wenn man sich die Calciumbindungsstelle von Calmodulin ansieht, kann man sehen, dass das Calciumion an Sauerstoffatome der 3 Asparaginsäuren, Glutaminsäure, Wasser und Rückgratcarbonyl bindet. Diese Bindung steht im Einklang mit „like bindet mit like“, da Wasser und die Aminosäurenliganden Glutaminsäure und Asparaginsäure durch Sauerstoffspender binden, die als harte Basen charakterisiert sind. Abbildung 10 zeigt die Bindungsstellen von Calmodulin und gleichzeitig die negativen Seitenketten der Aminosäuren, die mit den blau markierten Calciumionen interagieren würden.
In Bezug auf die Donoratome der gebundenen Liganden und ihre Fähigkeit, Elektronenpaare an den Koordinationskomplex zu spenden, erklärt die spektrochemische Reihe, wie die Atome mit dem Zentralmetall interagieren. Im Falle der Calcium-Bindungsstelle werden die Sauerstoffstoffe, die mit dem Ca2 + -Ion interagieren, alle als σ-Donatoren und π-Donatoren angesehen, da die Donor-Sauerstoffstoffe 2 oder mehr Elektronenpaare besitzen. Die Kategorien der spektrochemischen Seires, die Elektronenverfügbarkeit und Spende angeben, haben Auswirkungen auf die Spinbezeichnung (niedrig oder hoch), die angibt, wie d-Elektronen ihre Orbitale ausfüllen, und die Delta (Δ) -Größe zwischen den d-Orbitalen des Metalls. Dies macht die d-Orbitale in den meisten Gesprächen über das Protein im Wesentlichen vernachlässigbar. Eine Ausnahme betrifft die Berücksichtigung der Labilität des Calciumions im System.
Der Mangel an Elektronen in den d-Orbitalen von Ca führt zu einer Null-Liganden-Feldstabilisierungsenergie und erklärt die hohe Labilität des Calciumions. Labilität bezieht sich auf die Geschwindigkeit, mit der Liganden in Koordinationskomplexen ersetzt werden können, und beschreibt daher die Kinetik eines Systems. Atome sind labil, wenn sie Liganden schnell austauschen. Aufgrund seiner relevanten Funktion in allen eukaryotischen Zellen wird erwartet, dass Calmodulin Calciumionen millionenfach pro Sekunde bindet und freisetzt, um Nachrichten von umgebenden Zellen durch die Übertragung von Calciumionen zu senden und zu empfangen. Wenn es um die Fähigkeit von Calmodulin geht, Ca2 + schnell zu binden und freizusetzen, ist es wichtig, die Belegung von Elektronenorbitalen der Valenz d zu berücksichtigen. Wie bereits erwähnt, besitzt Calcium leere Valenz-d-Orbitale. Diese unbesetzten Orbitale können eine Erklärung für die Labilität eines Ca2 + -Ions liefern. Da alle d-Orbitale des Calciumions leer sind, besitzt es eine Ligandenfeldstabilisierungsenergie (LFSE) von 0. Dies deutet darauf hin, dass das Calcium bei der Betrachtung von LFSE instabil ist, da stabile Moleküle normalerweise einen negativen Wert für LFSE haben. Instabilität führt in diesem Fall zu einer Bereitschaft, schnell zu reagieren und Komplexe ein- und auszuschalten, was die Behauptung stützt, dass Ca2 + -Ionen schnelle Reaktionen fördern und als labil charakterisiert werden können. Obwohl dies der Diskussion über den Chelateffekt nicht eingängig zu sein scheint, Es versteht sich, dass sich diese beiden Theorien nicht widersprechen. Die Stabilität der fest gehaltenen Koordinationsbindungen, die durch den Chelateffekt vorgeschlagen wird, ermutigt das Calmodulin, lange genug stabil zu bleiben, um Ergänzungsproteine zu binden. Sobald dies abgeschlossen ist und sich die Calciumkonzentration wieder normalisiert, ist es effizient, die Stelle der Calciumionen zu entfernen.
Calmodulin spielt aufgrund seiner Struktur und der Zusammensetzung seiner lebenswichtigen Bindungsstelle einen integralen Bestandteil unzähliger Prozesse, die von eukaryotischen Zellen ausgeführt werden. Durch die Aufnahme und Bindung von Calciumionen bei der Signaltransduktion wirkt Calmodulin als zentraler Bestandteil der Grund- und Hochfunktion in Organismen wie dem Menschen. Durch die Anwendung der bioanorganischen Theorie und das Verständnis der fein überwachten Umgebung einer eukaryotischen Zelle kann man die Fähigkeit von Calmodulin, Calciumionen auszuwählen und die weitere Funktion mit mehr als 100 Partnerproteinen zu fördern, richtig verstehen.