Vitamin E-Behandlung für Patienten mit nichtalkoholischer Steatohepatitis
Jhonathan Ferney Vélez M. (1), Gustavo Amador Crespo H. (1), Juan Carlos Restrepo G. MD. Esp, MSc, PhD. (2)
(1) Medizinstudent an der Medizinischen Fakultät der Universidad de Antioquia in Medellín, Kolumbien.
(2) Außerordentlicher Professor in der Abteilung für Innere Medizin und der Gastrohepatologie-Gruppe an der Universidad de Antioquia und Hepatologe am Krankenhaus Pablo Tobón Uribe in Medellín, Kolumbien. [email protected]
Empfangen: 12-02-14 Akzeptiert: 05-11-14
Zusammenfassung
Die nichtalkoholische Steatohepatitis (NASH) ist histologisch durch das Aufblähen von Hepatozyten, lobuläre Entzündung und Steatose gekennzeichnet. Bei Verdacht auf diese Diagnose ist es wichtig, andere Ursachen für Leberschäden auszuschließen, insbesondere übermäßigen Alkoholkonsum. Dennoch ist eine Biopsie bis heute die einzige verfügbare Methode, um die Diagnose zu bestätigen. Vitamin E sollte als Erstlinientherapie zur Behandlung dieser Krankheit angesehen werden, da mehrere klinische Studien gezeigt haben, dass eine Dosis von 800 UI / Tag die Histologie von nicht-diabetischen Erwachsenen, die an NASH leiden, verbessert, selbst wenn es keinen signifikanten Einfluss auf die Fibrose gibt. Diese Ergebnisse wurden durch Biopsien bestätigt. Trotz der nachgewiesenen Vorteile der Verwendung dieses Arzneimittels ist es wichtig zu wissen, dass seine Verwendung Änderungen in Ernährung und Bewegung nicht ersetzen kann, sondern als Ergänzung zu diesen Maßnahmen angesehen werden sollte.
Schlüsselwörter
Nichtalkoholische Steatohepatitis, Vitamin E, oxidativer Stress.
EINLEITUNG
NASH ist histologisch durch das Aufblähen von Hepatozyten, lobuläre Entzündung und Steatose gekennzeichnet (1, 2). Derzeit kann NASH nur durch eine Leberbiopsie diagnostiziert werden, die der diagnostische Goldstandard ist. Es liefert auch Informationen über das Vorhandensein und den Grad der Entzündung, Nekrose und Fibrose, die alle wichtig sind, um die Prognose des Patienten zu bestimmen (2-5). Die Unterschiede zwischen NASH und alkoholischer Steatohepatitis sind mikroskopisch gering, was eine histologische Unterscheidung erschwert. Aus diesem Grund ist es wichtig, vom Patienten Informationen über seine Trinkgewohnheiten zu erhalten (4).
NASH ist Teil einer viel breiteren Einheit namens NAFLD (nonalcoholic Fatty Liver Disease), die die frühen Stadien der Lebersteatose umfasst: Steatose ohne Entzündung und Steatose mit leichter Entzündung. Letztendlich entwickelt sich NAFLD zum charakteristischen Entzündungszustand von NASH, der zu Fibrose und schließlich Zirrhose führt (1, 2, 5). Es ist noch nicht ganz klar, dass Individuen von einer einfachen Steatose zum Entzündungszustand übergehen. Wechselwirkungen zwischen genetischer Anfälligkeit, Stoffwechselstörungen und oxidativem Stress sind die wichtigsten Faktoren (6, 7).
NAFLD ist die weltweit häufigste Lebererkrankung (2, 4, 6). Die Prävalenz von NAFLD wird auf 20% bis 30% geschätzt, und die Prävalenz von NASH wird in der Allgemeinbevölkerung der westlichen Welt auf 2% bis 3% geschätzt (8).
Aufgrund seiner antioxidativen Eigenschaften wurde Vitamin E in den aktuellen amerikanischen Richtlinien zur Behandlung von NASH empfohlen. „Vitamin E (α -Tocopherol), das in einer täglichen Dosis von 800 IE / Tag verabreicht wird, verbessert die Leberhistologie bei nicht-diabetischen Erwachsenen mit biopsiebewiesenem NASH “ Dies vermeidet nicht die Bedeutung von Interventionen in den Lebensstil und die Ernährung des Patienten als Teil grundlegende Behandlung für Patienten mit NASH (9, 10). In diesem Artikel überprüfen wir die Pathophysiologie von NASH mit Schwerpunkt auf der Rolle von Vitamin E bei der Behandlung von Patienten mit dieser Krankheit.
PATHOPHYSIOLOGIE
Während die Pathogenese von NASH noch nicht vollständig geklärt ist, ist die bisher am besten akzeptierte Hypothese zur Erklärung der Ereignisse, die zur Steatose und anschließend zur Steatohepatitis führten, die „Two-Hit“ -Theorie. Der erste Treffer beim Ausbruch dieser Krankheit ist die Fettüberladung (11, 12). Eine sitzende Lebensweise, genetische Faktoren und eine erhöhte Kalorienzufuhr machen den Menschen anfälliger für die Entwicklung von Insulinresistenz und Hyperinsulinämie, was zu einer Erhöhung der Leberlipidsynthese und Freisetzung von freien Fettsäuren aus dem Fettgewebe führt. Wenn die Leber in diesem Zustand gehalten wird, wird sie unfähig, alle Fettsäuren zu metabolisieren, die sie produziert und die aus dem Kreislauf entfernt werden. Dieser Zustand führt schließlich zum zweiten Treffer, der Lebersteatose und oxidativer Stress ist (4, 5, 13).
Oxidativer Stress ist ein Ungleichgewicht, das Prooxidantien gegenüber Antioxidantien begünstigt (3). Während der Lebersteatose treten Hepatozyten in einen hypermetabolischen Zustand ein, der zu einer erhöhten Produktion von freien Radikalen in Zellorganellen führt (13). Zunehmende Mengen an reaktiven Sauerstoffspezies (ROS) in Hepatozyten führen zu einer Lipidperoxidation, einer Reaktion, die eine kontinuierliche Zufuhr zusätzlicher freier Radikale mit potenziell verheerenden Auswirkungen ermöglicht (14, 15).
Ein Antioxidans ist Vitamin E (Tocopherol), das mit Lipidperoxiden reagiert, um sie gegenüber Fettsäuren zu reduzieren. Sie bilden das relativ stabile Radikal Tocopheroxyl, das lange genug persistiert, um über eine Reaktion mit Vitamin C auf der Zelloberfläche wieder in Tocopherol überzugehen (12). Aufgrund dieser Eigenschaft wurde Vitamin E zur Behandlung von Patienten mit NASH in Betracht gezogen (13, 16).
MANIFESTATIONEN UND DIAGNOSE
NAFLD ist ein häufiges Syndrom, das von einfacher Steatose bis zu Steatohepatitis (NASH) mit anschließender Fibrose und Zirrhose reicht (5). Obwohl die meisten Patienten bei der Diagnose asymptomatisch sind, können einige Patienten, insbesondere Kinder, über Müdigkeit und Unwohlsein klagen. Beschwerden im rechten oberen Quadranten des Abdomens, Verdacht auf erhöhte Aminotransferasen und ein Bauchultraschall mit einer hellen Lebererkrankung sind Anzeichen dieser Krankheit. Adipositas, Diabetes und Dyslipidämie sollten auch bei der Beurteilung von Erkrankungen berücksichtigt werden, die mit NAFLD und NASH in Verbindung gebracht werden können (5, 17).
Während der diagnostischen Beurteilung sollten andere häufige Ursachen von Lebererkrankungen ausgeschlossen werden, aber letztendlich ist eine Leberbiopsie die einzige verfügbare Methode, um die Diagnose zu bestätigen. Es ist auch wichtig für die Definition der Prognose des Patienten (Tabelle 1) (3, 4). Trotz ihres großen klinischen Wertes ist eine Biopsie teuer und führt zu einem leichten Anstieg der Morbidität und in seltenen Fällen zur Mortalität. Dieses Instrument sollte nur bei Patienten in Betracht gezogen werden, bei denen der Verdacht auf eine nichtalkoholische Lebersteatose besteht, bei denen ein hohes Risiko für Steatohepatitis und fortgeschrittene Fibrose (Adipositas, Typ-II-Diabetes mellitus, Dyslipidämie und metabolisches Syndrom) besteht) und in Fällen unsicherer Diagnose (3, 9).

ROLLE VON VITAMIN E BEI DER BEHANDLUNG VON NICHTALKOHOLISCHER STEATOHEPATITIS
Derzeit gibt es keine wirksame Behandlung für NASH. In Anbetracht der wichtigen Rolle von Vitamin E als antioxidativer Faktor wurden jedoch mehrere klinische Studien durchgeführt, um seinen Nutzen für die klinische und histopathologische Entwicklung dieser Krankheit nachzuweisen (Tabelle 2).
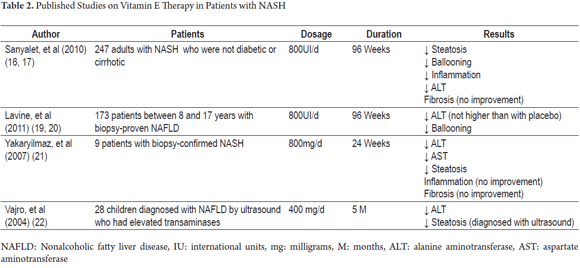
Dazu gehört die PIVENS-Studie (Pioglitazon versus Vitamin E versus Placebo zur Behandlung von nichtdiabetischen Patienten mit nichtalkoholischer Steatohepatitis). Dies war eine multizentrische, doppelblinde, placebokontrollierte Studie, in der die histologische Verbesserung bei 247 nicht-diabetischen und nicht-zirrhotischen Patienten mit NASH untersucht wurde. Die Patienten erhielten nach dem Zufallsprinzip eine tägliche Dosis Pioglitazon (80 Patienten), Vitamin E (84 Patienten) oder ein Placebo (83 Patienten) für sechsundneunzig Wochen (18). Die täglichen Dosierungen betrugen 30 mg für Pioglitazon und 800 IE für Vitamin E. Diese Studie ergab, dass sich 43% der Patienten, die Vitamin E erhielten (P = 0,001), gegenüber 34% der Patienten, die Pioglitazon erhielten (P = 0,04) und 19% der Patienten, die Placebos erhielten. Der Unterschied in den Verbesserungsraten zwischen Pioglitazon und Placebos war statistisch nicht signifikant, während der Unterschied zwischen den Verbesserungsraten von Vitamin E und Placebos war. Beide Medikamente waren jedoch mit einer Verbesserung der Aminotransferase-Spiegel, einer Verringerung der Steatose und einer lobulären Entzündung verbunden, führten jedoch nicht zu einer Verbesserung der Fibrose. Die gleiche Studie zeigte, dass nach der Behandlung mit Vitamin E suspendiert wurde Aminotransferase-Spiegel erhöht, was darauf hinweist, dass eine unbestimmte Verabreichung der Behandlung erforderlich sein kann. Darüber hinaus wurden keine signifikanten Unterschiede zwischen den Nebenwirkungen von Vitamin E und den Nebenwirkungen von Placebos gefunden (19).
Eine Neubewertung der PIVENS-Studie durch Hoofnagle et al. konzentrierte sich auf die Reaktion der Serum-ALT bei Patienten, die Vitamin E oder Placebos erhielten, und auf die Assoziation dieser Reaktion mit den anfänglichen klinischen, histologischen Veränderungen und Wechselwirkungen mit Veränderungen des Körpergewichts. Sie fanden heraus, dass Veränderungen der ALT bei denen, die Vitamin E erhielten, häufiger auftraten (48%) als bei denen, die Placebos erhielten (16%; p < 0,001). In der Gruppe, die Vitamin E erhielt, waren die ALT-Reaktionen mit einer verminderten Aktivität der nichtalkoholischen Fettlebererkrankung (NAFLD) verbunden, aber es gab keine Verbesserung der Fibrose nach dem Ende der Behandlung nach 96 Wochen. Die ALT-Spiegel stiegen in der Vitamin-E-Gruppe nach Beendigung der Verabreichung an, stiegen jedoch in der Placebogruppe nach Beendigung der Verabreichung nicht an. Beide Behandlungsgruppen hatten in Woche 120 fast identische ALT-Spiegel. Diese Ergebnisse ähneln denen, die in der vollständigen Kohorte der Hauptpublikation der PIVENS-Studie gezeigt wurden. Darüber hinaus zeigten die Ergebnisse, dass Gewichtsverlust (2 kg oder mehr) auch mit einer ALT-Reaktion verbunden ist, mit verbesserter NAFLD (< 0,001) und verbesserter Fibrose (p < 0,02), aber Vitamin E hatte größere Auswirkungen auf NAFLD unabhängig von Veränderungen des Körpergewichts. Schließlich ist anzumerken, dass die Auswirkungen von Vitamin E und Gewichtsverlust auf die ALT-Reaktion und Histologie unabhängig sind, was bedeutet, dass auch Patienten, die abnehmen, von einer Therapie mit Vitamin E profitieren würden (20).
Die Studie TONIC (Treatment of nonalcoholic fatty liver disease in children) war eine weitere multizentrische, doppelblinde, placebokontrollierte Studie. Es umfasste 173 Patienten im Alter zwischen acht und siebzehn Jahren. Die Patienten erhielten nach dem Zufallsprinzip 96 Wochen lang Vitamin E (58 Patienten), Metformin (57 Patienten) oder Placebos (58 Patienten). Die Dosierung betrug 400 IE zweimal täglich für Vitamin E und 500 mg zweimal täglich für Metformin (21). Keiner der Wirkstoffe war Placebos überlegen, um entweder eine nachhaltige Reduktion der ALT-Ausgangswerte um mindestens 50% oder anhaltende ALT-Spiegel von 40 U / l oder weniger zu erreichen. Die Messungen wurden alle 12 Wochen von Woche 48 bis Woche 96 durchgeführt. Diese Studie ergab auch, dass die Auflösung von NASH in der Gruppe der mit Vitamin E behandelten Patienten signifikant höher war als in der Placebogruppe. Dieses Ergebnis wurde auf die signifikante Abnahme der hepatozellulären Ballonbildung zurückgeführt, die bei mit Vitamin E behandelten Patienten festgestellt wurde. Dies ähnelt den Ergebnissen von PIVENS, obwohl in der TONIC-Studie aufgrund der histopathologischen Unterschiede zwischen NALFD bei pädiatrischen Patienten und Erwachsenen kein vermindertes hepatozelluläres Ballooning als primäres Ergebnis untersucht wurde. Die TONIC-Studie ergab keine Verbesserung der Fibrose (22).
Vor diesen beiden großen Studien gab es andere kleinere Studien, die Ergebnisse mit großen Unterschieden in den primären Ergebnissen hatten ausgewertet. Zusätzlich zu viel kleineren Populationen hatten diese Studien weniger Überwachungszeit, und einige von ihnen wurden nicht mit Placebogruppen kontrolliert.
Eine Studie von Yakaryilmaz et al. aus dem Jahr 2007. untersuchte die Wirkung von Vitamin E auf neun Patienten, deren NASH-Diagnosen durch Biopsie verifiziert worden waren. Die Studie untersuchte die Wirkung von Vitamin E auf den Peroxisom-Proliferator-aktivierten Rezeptor Gamma (PPARG) und auf die Insulinresistenz. Die Patienten erhielten 24 Wochen lang täglich 800 mg Vitamin E. Vor Beginn der Behandlung wurden die Lebern der Patienten biochemisch und histologisch untersucht. Diese Bewertungen wurden nach Beendigung der Behandlung wiederholt. Am Ende der 24 Wochen wurden statistisch signifikante Abnahmen von AST, ALT und Steatose gefunden, aber keine histologischen Veränderungen im Ausmaß der Entzündung und Fibrose. Bei dieser Dosierung von Vitamin E traten bei keinem Patienten Nebenwirkungen auf (23).
Vajro, et al. (2004) führten eine Studie an einer Gruppe von 28 Kindern mit Adipositas-bedingter Leberfunktionsstörung durch. Die Patienten wurden in zwei Gruppen eingeteilt. Das Durchschnittsalter der ersten Gruppe betrug 9,88 (+/- 3,97) Jahre und der zweiten Gruppe 10,7 (+/- 3,45) Jahre. Die Patienten wurden untersucht, um festzustellen, ob eine Vitamin-E-Behandlung positive Auswirkungen auf den Gewichtsverlust, die Transaminasespiegel und die durch Ultraschall gemessene Steatose hatte. Die in diese Studie eingeschlossenen Kinder hatten alle eine chronische Hypertransaminasämie (AST- oder ALT-Spiegel, die länger als 6 Monate 1, 5-mal über dem Normalwert lagen) und Anzeichen einer Steatose im Ultraschall. Die Studie hatte ein Single-Blind-Design, in dem die Patienten in eine von zwei Gruppen randomisiert wurden: Gruppe 1 (Placebo plus Diät) und Gruppe 2 (Vitamin E + Diät). Später wurde jede Gruppe in Abhängigkeit von der Einhaltung der Behandlung durch den Patienten unterteilt. Gruppe 1 wurde in Untergruppe 1A für diejenigen, die die Diät einhielten, und Untergruppe 1B für diejenigen, die die Diät nicht eingehalten hatten, unterteilt. Gruppe 2 wurde in Untergruppe 2A für diejenigen unterteilt, die die Vitamin-E-Therapie eingehalten hatten, und Untergruppe 2B für diejenigen, die die Vitamin-E-Therapie nicht eingehalten hatten. Untergruppe 2A wurde weiter unterteilt in Untergruppe 2A1 für diejenigen, die die Diät nicht einhielten, und Untergruppe 2A2 für diejenigen, die die Diät einhielten. Die Studie ergab, dass die 400 mg / Tag-Dosis von Vitamin E zu einer signifikanten Abnahme der ALT-Werte bei Patienten in der Subgruppe 2A führte, die sich unabhängig von Gewichtsveränderungen einer Normalisierung näherten. Auf der anderen Seite erreichten diejenigen Patienten, die hohe Serumspiegel von Vitamin E erreichten und auch Gewicht verloren, eine Normalisierung und Remission der Steatose. Darüber hinaus ergab ein Vergleich zwischen der Untergruppe 1A, die nur die Diät einhielt, und der Untergruppe 2A1, die nur die Vitamin-E-Therapie einhielt, dass beide Patientengruppen nach zweimonatiger Überwachung einen verringerten ALT-Spiegel aufwiesen, dass jedoch in der Untergruppe 1A (nur Diät einhielt) eine stärkere Abnahme auftrat als in der Untergruppe 2A1 (nur Vitamin E einhielt) nach fünfmonatiger Überwachung. Alle Anzeichen einer Steatose verschwanden aus Ultraschallbildern in der Gruppe der Untergruppe 2A2, die während der Behandlung mit 400 mg Vitamin E abgenommen hatte. Diese Ergebnisse unterstreichen die Bedeutung der Förderung einer gesunden Ernährung als eine der wichtigsten Behandlungsinterventionen für Patienten mit NASH, aber wir müssen auch beachten, dass viele Patienten Ernährungsregime nicht einhalten, was zum Scheitern der Intervention führt. Dies unterstreicht die Bedeutung der Verwendung von Antioxidantien wie Vitamin E als gute alternative Therapie für diese Patienten (24).
Eine Pilotstudie von Kugelmas, et al. (2003) untersuchten die Auswirkungen von Schritt 1 der American Heart Association-Diät in Kombination mit erhöhtem Aerobic-Training mit und ohne tägliche Verabreichung von Vitamin E auf die Profile von Zytokinen (TNF alpha, IL-8, IL – 6) und Leberenzymspiegel bei 16 Patienten zwischen 18 und 65 Jahren mit Biopsie nachgewiesenem NASH. Dies war eine Einzelblindstudie, in der die Patienten randomisiert 800 IE Vitamin E täglich erhielten. Patienten, die kein Vitamin E erhielten, erhielten Placebos. Der Test wurde über einen Zeitraum von 12 Wochen durchgeführt. Die Zytokinwerte nahmen mit Gewichtsverlust mit oder ohne Verabreichung von Vitamin E während der Studie nicht signifikant ab. Die Änderungen des Lebensstils waren mit Verbesserungen der Leberenzyme und des Plasmacholesterins bei Patienten mit NASH verbunden, während die in dieser Studie verwendete Dosierung von Vitamin E keinen zusätzlichen Nutzen zeigte. Dieses Ergebnis kann auf eine kleine Stichprobengröße, die kurze Nachbeobachtungszeit oder die Dosierung des verwendeten Vitamin E zurückzuführen sein (25, 26).
Eine im November 2013 veröffentlichte Übersicht über die derzeit verfügbaren Optionen zur Behandlung von Patienten mit NASH erkannte die aktuelle Empfehlung für die Verwendung von Vitamin E als Erstlinientherapie bei Patienten mit NASH an, die durch Biopsie bestätigt wurden und nicht zirrhotisch sind und keinen Diabetes haben, hob jedoch auch hervor, dass diese Therapie nur bei weniger als der Hälfte der Patienten einen signifikanten Nutzen gezeigt hat. Aus diesem Grund kam die Überprüfung zu dem Schluss, dass zukünftige Behandlungsstrategien auf pathogenen Krankheitswegen basieren sollten, wenn jemals eine wirksame Behandlung für Patienten mit NASH entwickelt werden soll (27).
Ji H-F et al. durchführung einer Metaanalyse zur Bewertung der Wirkung von Vitamin E auf die Verringerung der Aminotransferasen bei Patienten mit NAFLD, NASH und chronischer Hepatitis C (KHK). Die vier Studien, die sie untersuchten, umfassten Patienten mit NASH, die Vitamin-E-Präparate erhielten. Die Studien umfassten die Studien TONIC und PIVENS. Sie fanden heraus, dass Vitamin E die AST- und ALT-Spiegel bei diesen Patienten optimieren konnte. Es sei jedoch darauf hingewiesen, dass diese Metaanalyse durch die Unfähigkeit, die Auswirkungen von Interventionen mit Änderungen des Lebensstils, Bewegung und der Verwendung anderer Antioxidantien auszuschließen, und die Unfähigkeit, die Auswirkungen anderer Risikofaktoren für chronische Lebererkrankungen wie Alkohol- und Drogenkonsum auszuschließen, eingeschränkt wurde. Hinzu kommt, dass die Heterogenität der Studien berücksichtigt werden muss, da sie die Gesamtanalyse einschränkt und eine geringere Spezifität für Aminotransferase-Spiegel aufweist als Biopsien, die zum Zeitpunkt der Diagnose und Beurteilung von Lebererkrankungen entnommen wurden (28).
Obwohl wir unter den großen Studien zur Beurteilung der Wirkung der Verwendung von Vitamin E bei Patienten mit NASH keine statistisch signifikanten Unterschiede zur kurzfristigen Verwendung von Placebos und anderen therapeutischen Optionen festgestellt haben, besteht Besorgnis über mögliche Nebenwirkungen einer längeren Verwendung von Vitamin E.
Eine systematische Überprüfung von neun randomisierten, neuen randomisierten, placebokontrollierten Studien, um die Auswirkungen von Vitamin E über einen Zeitraum von mindestens einem Jahr auf die Gesamtinzidenz von zerebrovaskulären Unfällen sowie Subtypen von zerebrovaskulären Unfällen zu bewerten. Es wurde ein erhöhtes Risiko für einen hämorrhagischen Schlaganfall festgestellt (RR = 1, 22, 95% -KI: 1, 0 bis 1, 48, p = 0, 045). Aufgrund der Ergebnisse ihrer Überprüfung empfehlen die Forscher, die wahllose Verwendung von Vitamin E aufgrund der schwerwiegenden Folgen hämorrhagischer Schlaganfälle bei Morbidität und Mortalität zu vermeiden (29).
In einer randomisierten, placebokontrollierten Studie mit 35.533 Patienten, die mindestens sieben Jahre lang beobachtet wurden, wurden die Risiken von Vitamin E im Zusammenhang mit Prostatakrebs untersucht. Es verglich eine Placebogruppe mit einer Gruppe, die Vitamin E in einer täglichen Dosis von 400 IE erhielt. Es gab einen signifikanten Anstieg des Risikos für Prostatakrebs bei denjenigen, die Vitamin E einnahmen (HR 1,17; 99% CI, 1,004-1,360; p = 0,008). Der absolute Anstieg des Risikos betrug 1,6 pro 1000 Personenjahre (30).
Eine weitere Meta-Analyse untersuchte die Dosis-Wirkungs-Beziehung zwischen Vitamin-E-Supplementierung und Gesamtmortalität bei Erwachsenen. Es zeigte sich, dass Patienten, die hohe Dosen von Vitamin E (größer oder gleich 400 IE / Tag) erhielten, eine erhöhte Mortalität aus allen Ursachen aufwiesen. Diese Metaanalyse beschränkte ihre Suche auf randomisierte kontrollierte Studien, deren Patientenproben aus Erwachsenen bestanden, die eine Behandlung mit Vitamin E allein oder in Kombination mit anderen Vitaminen oder Mineralstoffen erhielten und schwangere Frauen ausschlossen und die mindestens 1 Jahr lang behandelt und überwacht wurden. Die Ergebnisse dieser Metaanalyse sollten mit Vorsicht betrachtet werden, da einige der Studien kleine Stichprobengrößen aufweisen und bei Patienten mit mehreren chronischen Erkrankungen durchgeführt wurden. Dies schränkt die Fähigkeit der Studie ein, die Ergebnisse auf die gesunde erwachsene Bevölkerung zu verallgemeinern (31).
SCHLUSSFOLGERUNG
Obwohl es derzeit keine wirksame medikamentöse Therapie für Patienten mit NASH gibt, deuten die in der PIVENS-Studie gezeigten Beweise darauf hin, dass die richtige Verabreichung von Vitamin E die Leberhistologie bei erwachsenen nicht zirrhotischen Patienten mit NASH verbessert, die keinen Diabetes haben. Dennoch sind weitere Studien erforderlich, bevor diese Empfehlung auf Diabetiker oder Patienten mit Zirrhose mit NASH ausgedehnt werden kann. Studien, die an pädiatrischen Patienten mit NASH durchgeführt wurden, haben keine ausreichenden Beweise gefunden, um die Verwendung von Vitamin E zu unterstützen. Gewichtsverlust durch eine kalorienarme Diät in Kombination mit erhöhter körperlicher Aktivität sollte für alle Patienten empfohlen werden. In Bezug auf Nebenwirkungen haben wir keine statistisch signifikanten Unterschiede bei der kurzfristigen Anwendung von Vitamin E mit Placebos und anderen Behandlungsmöglichkeiten festgestellt. Dennoch wird die wahllose Verwendung von Vitamin E für längere Zeit nicht empfohlen, da es Hinweise auf ein erhöhtes Risiko für Prostatakrebs, hämorrhagischen Schlaganfall und Tod aus allen Ursachen gibt.
1. Abbas AK, Fausto N. Hígado, vesícula biliar y vías biliares. De: Robbins SL, Mitchell RN, Kumar V, Abbas AK, Fausto N. Patología funcional y estructural. 8. Aufl. Barcelona: Elsevier; 2012. s. 645-687.
2. Brunt E, Neuschwander-Tetri B, Burt AD. Fettlebererkrankung: alkoholisch und alkoholfrei. De: Burt AD, Ferrell, L Portmann BC. MacSween Pathologie der Leber. 6. Auflage. GROßBRITANNIEN: Elservier; 2012. s. 293-359.
3. Corrado RL, Torres DM, Harrison SA. Überprüfung der Behandlungsmöglichkeiten für nichtalkoholische Fettlebererkrankungen. Med Clin N Am 2014; 98: 55-72.
4. Koek GH, Liedorp PR, Bast A. Die Rolle von oxidativem Stress bei nichtalkoholischer Steatohepatitis. Clinica Chimica Acta 2011; 412: 1297-1305.
5. Cortez-Pinto H, Ermelinda Camilo M. Nichtalkoholische Fettlebererkrankung / nichtalkoholische Steatohepatitis (NAFLD / NASH): Diagnose und klinischer Verlauf. Best Practice & Forschung Klinische Gastroenterologie 2004; 18(6): 1089-104.
6. Mishra A, Younossi ZM. Epidemiologie und Naturgeschichte der nichtalkoholischen Fettlebererkrankung. Zeitschrift für klinische und experimentelle Hepatologie 2012; 2 (2): 135-44.
7. Rolo AP, Teodoro JS, Palmeira CM. Rolle von oxidativem Stress in der Pathogenese der nichtalkoholischen Steatohepatitis. Kostenlos Radic Biol Med 2012; 52(1): 59-69.
8. Machado MV, Cortez-Pinto H. Nicht-invasive Diagnose von nicht-alkoholischen Fettlebererkrankungen. Eine kritische Würdigung. Zeitschrift für Hepatologie 2013; 58 (5): 1007-19.
9. In: Chalasani N, et al. Die Diagnose und Behandlung von nichtalkoholischen Fettlebererkrankungen: Praxisleitlinie der American Association for the Study of Liver Diseases, des American College of Gastroenterology und der American Gastroenterological Association. Hepatologie 2012; 55.
10. Mazzella N, Ricciardi LR, Mazzotti A, Marchesini G. Die Rolle von Medikamenten für die Behandlung von Patienten mit NAFLD. Clin Leber Dis 2014; 18: 73-89.
11. Chunga MEINE, Yeunga SF, Parka HJ, Volekb JS, Brunoa RS. Eine Nahrungsergänzung mit α- und γ-Tocopherol dämpft Lipopolysaccharid-induzierten oxidativen Stress und entzündungsbedingte Reaktionen in einem adipösen Mausmodell der nichtalkoholischen Steatohepatitis. Zeitschrift für Ernährungsbiochemie 2010; 21: 1200-1206.
12. Tag CP, James von. Steatohepatitis: Eine Geschichte von zwei ‚Hits‘? Gastroenterologie 1998; 114: 842-4.
13. Harper HA, Murray RK, Rodwell VW, Bender DA. Bioquímica ilustrada, 28 Aufl. México: McGraw-Hill Interamericana; 2010. s. 484-485.
14. Neuschwander-Tetri BA. Hepatische Lipotoxizität und Pathogenese der nichtalkoholischen Steatohepatitis: die zentrale Rolle von Nichttriglyceridfettsäuremetaboliten. Hepatologie 2010; 52(2): 774-88.
15. Le T, Loomba R. Management von nicht-alkoholischen Fettlebererkrankungen und Steatohepatitis. Zeitschrift für klinische und experimentelle Hepatologie 2012; 2: 156-173.
16. De Jonge C, Moonen E, van Berkel J, Luijk J, Bouvy ND, Buurman AW, Rensen SS, Greve JW. Nichtalkoholische Steatohepatitis: Eine nicht-invasive Diagnose durch Analyse des ausgeatmeten Atems. Zeitschrift für Hepatologie 2013; 58: 543-548.
17. Palmentieri B, de Sio I, La Mura V, et al. Die Rolle des hellen Leberechomusters bei der Ultraschall-B-Mod-Untersuchung bei der Diagnose von Lebersteatose. Dig Leber Dis 2006; 38: 485-9.
18. In: Sanyal AJ, et al. Pioglitazon versus Vitamin E versus Placebo zur Behandlung von nicht-diabetischen Patienten mit nicht-alkoholischer Steatohepatitis: PIVENS-Studiendesign. Contemp Clin Studien 2009; 30(1): 88-96.
19. Kowdley KV, McCullough A, Diehl AM, Bass NM, et al. Pioglitazon, Vitamin E oder Placebo bei nichtalkoholischer Steatohepatitis. N Engl J Med 2010; 362(18): 1675-85.
20. Hoofnagle JH, Van Natta ML, Kleiner DE, Clark JM, Kowdley KV, Loomba R, et al. Vitamin E und Veränderungen der Serum-Alanin-Aminotransferase-Spiegel bei Patienten mit nichtalkoholischer Steatohepatitis. Aliment Pharmacol Ther 2013; 38(2):134-43.
21. Molleston JP, Scheimann AO, Murray KF, Abrams SH, et al. Behandlung der nichtalkoholischen Fettlebererkrankung bei Kindern: KLINISCHES Studiendesign. Contemp Clin Studien 2010; 31(1): 62-70.
22. Van Natta ML, et al. Wirkung von Vitamin E oder Metformin zur Behandlung von nichtalkoholischen Fettlebererkrankungen bei Kindern und Jugendlichen: Die Tonic randomisierte kontrollierte Studie. JAMA 2011; 305(16): 1659-68.
23. Yakaryilmaz F, Guliter S, Savas B, Erdem O, Ersoy R, Erden E, et al. Auswirkungen der Vitamin-E-Behandlung auf die Peroxisom-Proliferator-aktivierte Rezeptor-Alpha-Expression und Insulinresistenz bei Patienten mit nichtalkoholischer Steatohepatitis: Ergebnisse einer Pilotstudie. Intern Med J 2007; 37(4): 229-35.
24. Vajro P, Mandato C, Franzese A, Ciccimarra E, Lucariello S, Savoia M, et al. Vitamin E-Behandlung bei pädiatrischer Adipositas-bedingter Lebererkrankung: eine randomisierte Studie. J Pediatr Gastroenterol Nutr 2004; 38(1): 48-55
25. Papastergiou V, et al. Neun Scoring-Modelle für die Kurzzeitmortalität bei alkoholischer Hepatitis: Kreuzvalidierung in einer Biopsie-nachgewiesenen Kohorte. Aliment Pharmacol Ther 2014; 39: 721-732.
26. Kugelmas M, Hill DB, Vivian B, Marsano L, McClain CJ. Zytokine und NASH: Eine Pilotstudie zu den Auswirkungen von Lebensstiländerungen und Vitamin E. Hepatologie 2003; 38 (2): 413-9.
27. Younossi ZM, Reyes MJ, Mishra MA, Mehta R, Henry L.. Systematische Überprüfung mit Metaanalyse: Nichtalkoholische Steatohepatitis – ein Fall für eine personalisierte Behandlung basierend auf pathogenen Zielen. Aliment Pharmacol Ther2014; 39: 3-14.
28. Ji HF, et al. Wirkung der Vitamin-E-Supplementierung auf die Aminotransferase-Spiegel bei Patienten mit NAFLD, NASH und CHC: Ergebnisse einer Metaanalyse. Ernährung 2014; 1-6.
29. Markus S, Robert JG, Pamela MR, Christophe T, Tobias K. Auswirkungen von Vitamin E auf Schlaganfall-Subtypen: Metaanalyse randomisierter kontrollierter Studien. BMJ 2010; 341.
30. Klein EA, Thompson IM, Tangen CM, et al. Vitamin E und das Risiko von Prostatakrebs: Die Selen und Vitamin E Cancer prevention Trial (select). JAMA 2011; 306(14): 1549-56.
31. Miller ER, 3rd, Pastor-Barriuso R, Dalal D, Riemersma RA, Appel LJ, Guallar E.. Metaanalyse: Eine hochdosierte Vitamin-E-Supplementierung kann die Gesamtmortalität erhöhen. Ann Intern Med 2005; 142(1): 37-46.