Electrolitos iónicos
El agua y otras moléculas polares son atraídas por los iones, como se muestra en la Figura \(\pageIndex{2}\). La atracción electrostática entre un ion y una molécula con un dipolo se denomina atracción ion-dipolo. Estas atracciones juegan un papel importante en la disolución de compuestos iónicos en el agua.
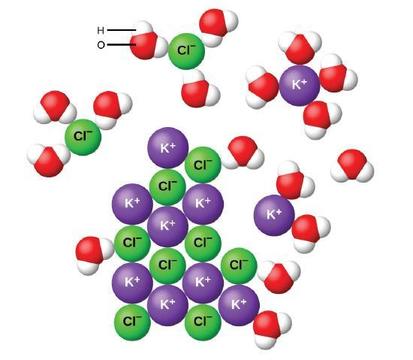
Cuando los compuestos iónicos se disuelven en agua, los iones en el sólido se separan y dispersan uniformemente en toda la solución porque las moléculas de agua rodean y solvatan los iones, reduciendo las fuertes fuerzas electrostáticas entre ellos. Este proceso representa un cambio físico conocido como disociación. En la mayoría de las condiciones, los compuestos iónicos se disocian casi por completo cuando se disuelven, por lo que se clasifican como electrolitos fuertes.
Consideremos lo que sucede a nivel microscópico cuando agregamos KCl sólido al agua. Las fuerzas iónico-dipolares atraen el extremo positivo (hidrógeno) de las moléculas de agua polares a los iones de cloruro negativos en la superficie del sólido, y atraen los extremos negativos (oxígeno) a los iones de potasio positivos. Las moléculas de agua penetran entre los iones K+ y Cl individuales y los rodean, reduciendo las fuertes fuerzas interiónicas que unen a los iones y dejándolos pasar a la solución como iones solvatados, como se muestra en la figura. La reducción de la atracción electrostática permite el movimiento independiente de cada ion hidratado en una solución diluida, lo que resulta en un aumento del desorden del sistema a medida que los iones cambian de sus posiciones fijas y ordenadas en el cristal a estados móviles y mucho más desordenados en solución. Este trastorno aumentado es responsable de la disolución de muchos compuestos iónicos, incluido el KCl, que se disuelven con la absorción de calor.
En otros casos, las atracciones electrostáticas entre los iones en un cristal son tan grandes, o las fuerzas de atracción iónico-dipolo entre los iones y las moléculas de agua son tan débiles, que el aumento del desorden no puede compensar la energía requerida para separar los iones, y el cristal es insoluble. Tal es el caso de compuestos como el carbonato de calcio (piedra caliza), el fosfato de calcio (el componente inorgánico del hueso) y el óxido de hierro (óxido).