Las reacciones en solución que no están catalizadas son lentas, ya que el desarrollo y la separación de la carga se producen en el estado de transición. Cuando se forman o rompen enlaces, a menudo se forman intermedios cargados que son más altos en energía que los reactivos. Dado que el intermedio es más alto en energía que los reactivos, el estado de transición sería aún más alto en energía, y por lo tanto se asemejaría más al intermedio cargado. Cualquier cosa que pueda estabilizar las cargas en el intermedio y, por lo tanto, las cargas en desarrollo en los estados de transición, reducirá la energía del estado de transición y catalizará la reacción. En esta sección investigaremos el mecanismo subyacente a la catálisis por moléculas pequeñas de reacciones químicas. Presumiblemente, el catalizador macromolecular biológico (como las enzimas proteicas) utilizará mecanismos similares en sus efectos catalíticos (que se discutirán en la siguiente sección).
Los catalizadores, incluidas las enzimas, pueden emplear al menos 5 formas diferentes de estabilizar los estados de transición.
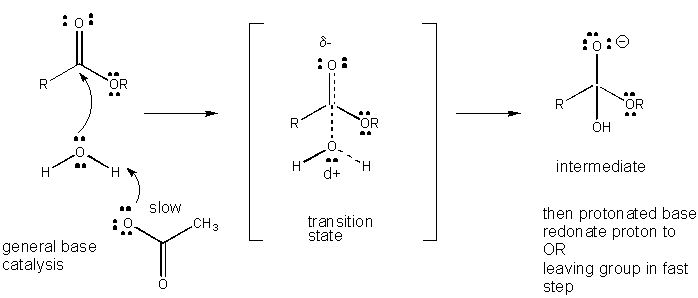
El desarrollo de carga en el TS puede reducirse mediante la donación de un protón de ácidos generales (como el ácido acético o un anillo indol protonado) a un átomo como un carbonilo O que desarrolla una carga negativa parcial en el TS cuando está unido por un nucleófilo. La donación de protones disminuye el desarrollo negativo en el ST. Alternativamente, un nucleófilo como el agua que desarrolla una carga positiva parcial en el TS a medida que comienza a formar un enlace a un C electrofílico en un carbonilo puede estabilizarse por la presencia de una base general (como el acetato o el anillo indol desprotonado). La abstracción de protones disminuye la carga positiva en desarrollo
Figura: DESARROLLO DE CARGA EN EL ESTADO DE TRANSICIÓN PARA HIDRÓLISIS DE ÉSTERES
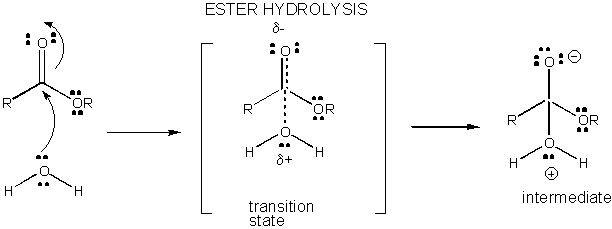
Figura: MECANISMO DE CATÁLISIS ÁCIDA GENERAL
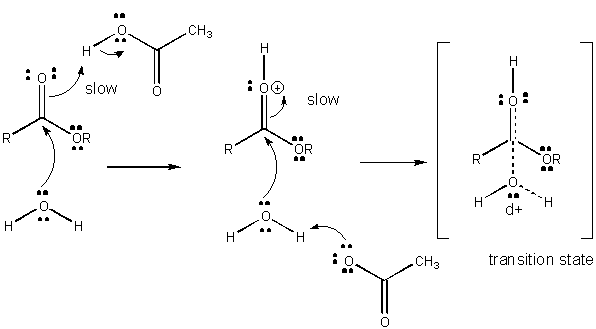
Figura: MECANISMO DE CATÁLISIS DE BASE GENERAL
Colaboradores y atribuciones
- Prof. Henry Jakubowski (College of St. Benedict / St. John’s University)