Dimethyl Sulfoxide Oxidations
Dimethyl sulfoxide-based oxidation of primary alcohols to aldehydes or secondary alcohols to ketones is a mild method that does not depend upon heavy metal oxidants. Here is a brief, chronological history of the procedure.
Index:
-
Swern Oxidation (trifluoroacetic anhydride)
-
Swern Oxidation (oxalyl chloride)
Kornblum Oxidation: (1959) Un tosilato primario se calienta a 150o para causar el desplazamiento de SN2 por el oxígeno del sulfóxido de dimetilo (DMSO) en presencia de NaHCO3. El mecanismo aceptado en ese momento era una eliminación de E2, como se muestra. El sulfuro de dimetilo (DMS) es el producto de reducción de la reacción. Este trabajo formó el tosilato a partir del yoduro de alquilo con tosilato de plata. Presumiblemente, el tosilato se puede preparar a partir del alcohol, que es una ruta más directa. La desventaja del procedimiento es la temperatura elevada, aunque el tiempo de contacto es de solo unos minutos. El problema esencial es encontrar un método para generar la sal de sulfonato.

Modificación de Barton: (1964) Barton y sus compañeros de trabajo fueron capaces de generar sales de sulfenato mediante el tratamiento de cloroformatos alquilos con DMSO con pérdida de CO2. La adición de trietilamina genera el producto de oxidación. Este procedimiento mejoró las duras condiciones del procedimiento de Kornblum. Además, el cloroformato está fácilmente disponible mediante el tratamiento del alcohol que se oxida con el exceso de fosgeno.

Oxidación de Moffatt-Pfitzner: (1963) Esta variante de oxidación a base de sulfóxido de dimetilo fue desarrollada en Syntex. El activador se prepara mediante protonación de diciclohexil carbodiimida (1, DCC), que es atacada por el sulfóxido de dimetilo. El intermedio 2 se protona de nuevo para facilitar la adición del oxígeno alcohólico al átomo de azufre. Se forma diciclohexil urea 4 estable junto con sal de sulfenato 3. Esta especie sufre colapso al compuesto carbonilo bajo la influencia del anión dihidrogenofosfato. Aunque el ácido fosfórico es un catalizador ácido eficaz para esta reacción, el ácido sulfúrico, el cloruro de hidrógeno y el ácido trifluoroacético no lo son. Sin embargo, el trifluoroacetato de piridinio es un catalizador eficaz. Es fundamental que la base conjugada del ácido sea lo suficientemente básica para efectuar el último paso de la reacción.

Mecanismo de Torrsell: (1966) El químico sueco Torrsell demostró que el mecanismo de estas oxidaciones basadas en DMSO no procede a través de una eliminación intermolecular de β. La eliminación es un proceso intramolecular. La sal de sulfenato 5 se preparó mediante el procedimiento de Moffatt-Pfitzner (véase más arriba). Si se aplicara el mecanismo de Kornblum, el sulfuro de dimetilo obtenido estaría desprovisto de deuterio (Experimento 1). Sin embargo, se obtuvo sulfuro de dimetilo-d1 (7). Este resultado es consistente con una base que desprotona el grupo metilo unido al ilid 6 formador de azufre. El ilid se descompone por desprotonación intramolecular para producir los productos observados.Experimento
1:

Para corroborar este mecanismo, el deuterio se incorporó al DMSO como DMSO-d6. En consecuencia, la reacción produjo sulfuro de dimetilo-d5 (12) y aldehído 11 no diluido (Experimento 2).Experimento
2:

Oxidación de Parikh-Doering: (1967) Esta oxidación utiliza el complejo de trióxido de azufre de piridina (13) como activador del sulfóxido de dimetilo. El sulfato es el grupo saliente en el desplazamiento por el alcohol (primario o secundario) en intermedio 14. El sulfenato 15 se descompone por el mecanismo intramolecular (vide supra) para producir un aldehído o cetona.

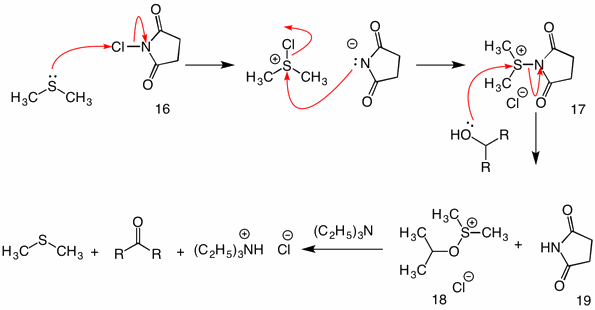
Corey-Kim Oxidación: (1972) En este procedimiento, el sulfuro de dimetilo se activa (oxida) con N-clorosuccinimida (16) para proporcionar el reactivo 17. En la reacción de esta especie con un alcohol, el grupo succinimidilo funciona como un grupo saliente. El sulfenato intermedio habitual 18 colapsa por el mecanismo intramolecular al agregar trietilamina.
Oxidación de Swern: (1976) Esta oxidación temprana de Swern emplea anhídrido trifluoroacético (20) a-50oC para activar el sulfóxido de dimetilo. La adición del alcohol al intermedio 21 produce el sulfenato deseado 22. La cetona o aldehído se produce de la manera habitual con trietilamina.

Oxidación de Swern: (1978) Este procedimiento de Swern posterior es un método conveniente para la producción de reactivo 24 sin usar sulfuro de dimetilo y cloro. El sulfóxido de dimetilo, que está al mismo nivel de oxidación que la sal 24, reacciona con el cloruro de oxalilo (23) para liberar monóxido de carbono, dióxido de carbono y reactivo 24. La adición del alcohol primario o secundario seguida de la desprotonación de sulfenato 25 con trietilamina conduce al aldehído o cetona deseados, respectivamente.
