La hipersensibilidad dentinaria es una de las quejas más comunes de los pacientes que se escuchan en la práctica dental.1 Afecta hasta al 57% de los pacientes, parece alcanzar su pico entre los 20 y los 40 años de edad.2 La prevalencia de hipersensibilidad es ligeramente superior en las mujeres,3 con caninos y premolares de ambos arcos más comúnmente involucrados.4 El dolor es a menudo crónico y marcado por episodios agudos.5
Según Holland et al6, la hipersensibilidad dentinaria se define como un » dolor corto y agudo que surge de la dentina expuesta en respuesta a estímulos, que generalmente son térmicos, evaporativos, táctiles y osmóticos o químicos que generalmente no se pueden atribuir a ninguna otra forma, defecto dental o patología.»Por lo general, el dolor es localizado y de corta duración. Esto difiere del dolor pulpar, que es prolongado, sordo, doloroso, mal localizado y dura más que el estímulo aplicado.
La angustia causada por la hipersensibilidad puede variar de leve a grave. Los pacientes que experimentan hipersensibilidad severa pueden encontrar difícil comer y beber, especialmente cuando consumen sustancias frías o calientes. El dolor experimentado por los individuos con sensibilidad es altamente subjetivo, sin embargo, y la intensidad es de naturaleza episódica. Desafortunadamente, los pacientes rara vez son capaces de aislar el diente relevante.7 Con el fin de aislar las causas de la sensibilidad, los médicos generalmente se basan en exponer el diente sospechoso a una explosión de aire o líquido caliente o frío para provocar una respuesta. El uso de un dique de goma para aislar el diente puede ser útil en este proceso.
TEORÍA HIDRODINÁMICA
La teoría hidrodinámica es la causa más comúnmente acordada de hipersensibilidad dentinaria. Kramer8 y Brännström9 confirmaron y ampliaron esta teoría que establece una relación entre la presión aplicada, los blastos de aire y los estímulos químicos a los cambios de líquido dentinario que ocurren en respuesta a estos estímulos.7 En la investigación original, Brännström molió a través del esmalte hasta la dentina medrocoronal de premolares en niños cuyos dientes iban a ser extraídos para uso ortodóntico. Los túbulos de dentina transversales de los niños se expusieron a la saliva durante una semana, lo que resultó en un aumento de la sensibilidad. Inicialmente, una capa de frotis cubría estos dientes, pero, al final de la semana, había desaparecido, haciendo que la dentina fuera cada vez más hiperconductiva.9 La permeabilidad de la dentina varía y puede disminuir rápidamente.10
La evidencia que respalda la teoría hidrodinámica se basa en estudios in vivo en seres humanos y animales. La distribución de los nervios en los túbulos dentinarios varía, con alrededor del 40% sobre los cuernos pulpar y un porcentaje menor ubicado en la dentina cervical. Parece que los túbulos dentinarios abiertos son necesarios para que la dentina expuesta se vuelva sensible (Figura 1, página 18); de hecho, la sensibilidad de un paciente aumentará en proporción al número de túbulos grandes abiertos presentes. Los túbulos abiertos demuestran una alta conductancia hidráulica; por el contrario, el flujo de fluido disminuye si los túbulos están bloqueados. Esto proporciona un medio para varias opciones de tratamiento. Magloire et al11 afirman que los estímulos externos resultan en el movimiento del líquido dentinario, y que los odontoblastos y/o la reacción del complejo nervioso pueden ser un sistema mecanosensorial distintivo, proporcionando un nuevo papel para los odontoblastos como células sensores. La transferencia de información entre odontoblastos y axones puede ser el resultado de mediadores en el espacio entre odontoblastos y axones, como lo demuestran los receptores de transducción nocioceptiva y las fibras aferentes del trigémino, y la expresión de efectores reputados por odontoblastos (Figura 2).11
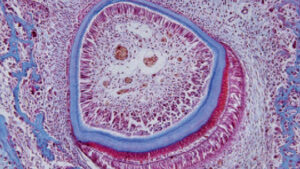
que depositan la dentina (fina capa azul), que constituye la mayor parte del diente. El esmalte (capa azul más gruesa) está formado por ameloblastos, una capa de células alargadas alrededor de la parte exterior del esmalte.
POSIBLES CAUSAS
La enfermedad periodontal, la recesión gingival, los dientes agrietados, la erosión, la abrasión, la abfracción y la fractura dental pueden causar hipersensibilidad. Todas estas condiciones dan lugar a la exposición de la dentina, lo que crea un entorno en el que los estímulos causan el movimiento del líquido tubular dentinario que activa las fibras nerviosas, causando dolor. La dentina expuesta puede ser el resultado de la extracción del cemento cervical durante el raspado y el alisado radicular, el acabado y pulido de restauraciones o el cepillado extremo de dientes, especialmente después de la ingestión de alimentos o bebidas ácidos. La regurgitación por parte de pacientes con bulimia produce exposición al ácido, y el cepillado posterior puede conducir a la pérdida de la estructura dental.1 El dolor puede ser localizado o de naturaleza general, y puede afectar una variedad de superficies dentales, ya sea juntas o individualmente.12
Como se ha señalado, los pacientes con enfermedad periodontal están sujetos a hipersensibilidad dentinaria.13 Estudios muestran que la incidencia de hipersensibilidad aumenta una semana después de la cirugía periodontal y se resuelve en ocho semanas.14,15 Pacientes más jóvenes muestran más sensibilidad en comparación con los adultos mayores, en los que la sensibilidad tarda más en resolverse. El raspado y el alisado radicular también pueden causar sensibilidad durante varios días después del tratamiento.
La recesión gingival resulta en la exposición de las superficies radiculares y la posible sensibilidad. El hueso bucal proporciona la mayor parte del suministro de sangre para la encía bucal, y cualquier pérdida de hueso bucal resultará en una disminución de la encía.14 El hueso delgado o fenestrado, la anatomía del diente, la posición del diente o el movimiento ortodóntico pueden provocar una recesión. El cepillado de dientes excesivo con dentífrico también puede causar recesión.15 Los signos y síntomas de los dientes agrietados pueden variar dependiendo de la gravedad. Los pacientes generalmente experimentarán dolor agudo con la masticación, pero, al eliminar el estímulo, el dolor disminuye. Si el dolor se extiende a la pulpa o al ligamento periodontal, persistirá.16
La erosión se define como una pérdida de esmalte a través de la disolución química por ácidos que no son de origen bacteriano. Hay tres tipos de erosión: extrínseca (por ejemplo, dieta, estilo de vida o entorno), intrínseca (por ejemplo, ácido gástrico) e idiopática.17 El ácido unificado se difunde en las áreas interprismáticas del esmalte y disuelve el mineral en el área subsuperficial.18 En la etapa inicial, la superficie del diente está opaca debido a la desmineralización, pero el diente no es hipersensible porque la dentina con túbulos abiertos no está expuesta. El compuesto se puede utilizar para sellar el esmalte para restaurar el contorno normal y evitar la exposición a la dentina.19 Restaurar el diente mejorará la higiene bucal y reducirá la posible afectación pulpar, la abrasión del cepillo de dientes/ dentífrico y la erosión ácida.20
La abrasión es la pérdida de la estructura del diente por fuerzas mecánicas de un elemento extraño, y puede causar sensibilidad.21 El desgaste es el contacto diente a diente, que resulta de la función oclusal o la parafunción, como el bruxismo, y puede causar pérdida de la estructura del diente en las superficies oclusales y los bordes incisales.22
El papel de la abfracción en la etiología de la hipersensibilidad dentinaria es controvertido. La abfracción puede ocurrir cuando una carga de dientes no axial cíclica desproporcionada conduce a la flexión de la cúspide y a la concentración de tensiones en la región cervical susceptible de los dientes. Estas lesiones cervicales, causadas por tensiones oclusales, conducen al debilitamiento de la estructura del diente cervical y pueden causar que el esmalte, el cemento o la dentina se desprendan del aspecto cervical.23 Lee y Eakle24 describieron por primera vez lesiones que pueden resultar de esfuerzos de tracción. Establecieron que una lesión por abfracción a menudo se localiza en o cerca del fulcro en el área con la mayor concentración de tensión de tracción; por lo general, tiene forma de cuña y muestra un tamaño proporcional al grado y la incidencia de la fuerza de tracción aplicada.
Otros, sin embargo, sostienen que hay evidencia limitada que respalda la abfracción como causa primaria de lo que ahora se conoce como lesiones cervicales no múltiples. Los procesos no múltiples que resultan en la pérdida de tejido duro en el área cervical parecen ser multifactoriales y pueden incluir abrasión, desafíos ácidos y posiblemente abfracción.23 Si bien las pruebas disponibles sugieren que estas lesiones pueden desarrollarse a partir de fuerzas, incluidas las fuerzas oclusales, que actúan solas o en combinación,se justifican 23 estudios adicionales para determinar el papel exacto de la abfracción en lesiones no múltiples y cualquier sensibilidad relacionada.
Además de estas fuentes, el blanqueamiento dental a menudo causa hipersensibilidad dentinaria. El uso de peróxido de hidrógeno o peróxido de carbamida puede infiltrarse a través del esmalte y la dentina hasta la pulpa. La glutatión peroxidasa y la catalasa en la pulpa no tienen tiempo suficiente para inactivar el peróxido de hidrógeno, lo que puede causar sensibilidad. También debe tenerse en cuenta que todos los geles blanqueadores son hipertónicos y extraen agua osmóticamente de la pulpa a través de la dentina y el esmalte hasta el agente blanqueador. Esto puede estimular potencialmente los nervios intradentales.25
OPCIONES DE TRATAMIENTO
Los médicos pueden recomendar una variedad de tratamientos para uso en el hogar o en la oficina (consulte la Tabla 1 para ver un diagrama de flujo de opciones de tratamiento).26 El mecanismo de acción suele ser la desensibilización de los nervios, la precipitación de proteínas, el taponamiento de los túbulos dentinarios, el sellado de la dentina o la ablación de la dentina con un láser. Las terapias más utilizadas incluyen agentes antiinflamatorios, precipitantes de proteínas, agentes ocluyentes de túbulos y selladores de túbulos. El enfoque más conservador debe implementarse inicialmente, con tratamientos más agresivos sugeridos si no se logra el alivio.27
CUADRO 1. Estrategias para el Tratamiento de la Hipersensibilidad Dentinal26 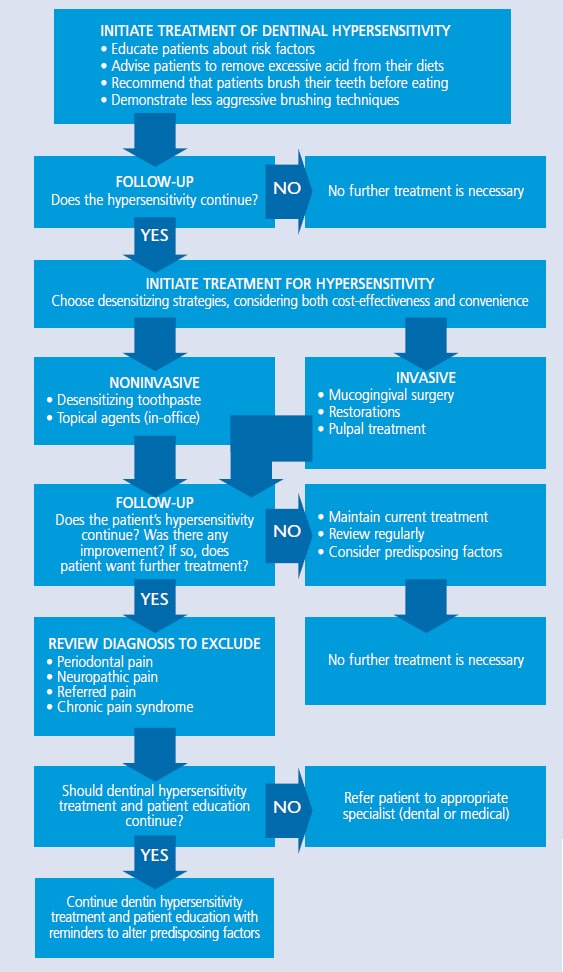 Como primera línea de defensa contra la sensibilidad, los médicos pueden recomendar un dentífrico con sales de potasio (por ejemplo, nitrato de potasio, cloruro de potasio o citrato de potasio), sales de estroncio (por ejemplo, cloruro de estroncio o acetato de estroncio) o fluoruro. Los iones de potasio se difunden a lo largo de los túbulos dentinarios, lo que bloquea la acción nerviosa y atenúa el dolor asociado con la hipersensibilidad. Los dentífricos de sal de potasio son efectivos, pero pueden requerir dos semanas de uso constante para que los pacientes sientan los efectos.28 En comparación, el método de acción que se encuentra en los dentífricos de sal de estroncio o en el fluoruro es la oclusión de túbulos. El flúor en varias formas es una estrategia eficaz para aliviar la sensibilidad en el hogar. El fluoruro de sodio, el fluoruro de estaño y el monofluorofosfato de sodio bloquean los túbulos dentinarios, reduciendo la sensibilidad. Los dentífricos de fluoruro recetados y la aplicación de bandejas también pueden ser útiles.29 Las tecnologías de fosfato cálcico son otra opción para tratar la hipersensibilidad. El fosfato de calcio amorfo hace que los iones de calcio y fosfato estén disponibles en la saliva para acelerar la remineralización, y puede ayudar a minimizar la sensibilidad inducida por el blanqueamiento. Está disponible en gel y productos blanqueadores.29 Además, los productos que contienen fosfato de calcio amorfo fosfopéptido de caseína (CPP-ACP) se pueden utilizar para ocluir parcialmente los túbulos dentinarios. Aunque el pretratamiento con un agente desensibilizante a veces interfiere con la unión restaurativa, un estudio de Borges et al30 encontró que la pasta con CPP-ACP no afectó negativamente la resistencia de la unión y, en algunos casos, la mejoró. El fosfosilicato de calcio y sodio también puede ayudar en la infiltración y remineralización de los túbulos. La sílice en el material funciona como una posición de nucleación para la precipitación de calcio y fosfato.31 El fosfato tricálcico (TCP) es la adición más reciente a la familia de tecnologías de fosfato de calcio. Proporcionando una liberación lenta de calcio a la superficie del diente, el TCP está diseñado para aumentar los efectos remineralizantes del fluoruro, que también pueden disminuir la sensibilidad. Está disponible en un dentífrico con receta y barniz de flúor.32
Como primera línea de defensa contra la sensibilidad, los médicos pueden recomendar un dentífrico con sales de potasio (por ejemplo, nitrato de potasio, cloruro de potasio o citrato de potasio), sales de estroncio (por ejemplo, cloruro de estroncio o acetato de estroncio) o fluoruro. Los iones de potasio se difunden a lo largo de los túbulos dentinarios, lo que bloquea la acción nerviosa y atenúa el dolor asociado con la hipersensibilidad. Los dentífricos de sal de potasio son efectivos, pero pueden requerir dos semanas de uso constante para que los pacientes sientan los efectos.28 En comparación, el método de acción que se encuentra en los dentífricos de sal de estroncio o en el fluoruro es la oclusión de túbulos. El flúor en varias formas es una estrategia eficaz para aliviar la sensibilidad en el hogar. El fluoruro de sodio, el fluoruro de estaño y el monofluorofosfato de sodio bloquean los túbulos dentinarios, reduciendo la sensibilidad. Los dentífricos de fluoruro recetados y la aplicación de bandejas también pueden ser útiles.29 Las tecnologías de fosfato cálcico son otra opción para tratar la hipersensibilidad. El fosfato de calcio amorfo hace que los iones de calcio y fosfato estén disponibles en la saliva para acelerar la remineralización, y puede ayudar a minimizar la sensibilidad inducida por el blanqueamiento. Está disponible en gel y productos blanqueadores.29 Además, los productos que contienen fosfato de calcio amorfo fosfopéptido de caseína (CPP-ACP) se pueden utilizar para ocluir parcialmente los túbulos dentinarios. Aunque el pretratamiento con un agente desensibilizante a veces interfiere con la unión restaurativa, un estudio de Borges et al30 encontró que la pasta con CPP-ACP no afectó negativamente la resistencia de la unión y, en algunos casos, la mejoró. El fosfosilicato de calcio y sodio también puede ayudar en la infiltración y remineralización de los túbulos. La sílice en el material funciona como una posición de nucleación para la precipitación de calcio y fosfato.31 El fosfato tricálcico (TCP) es la adición más reciente a la familia de tecnologías de fosfato de calcio. Proporcionando una liberación lenta de calcio a la superficie del diente, el TCP está diseñado para aumentar los efectos remineralizantes del fluoruro, que también pueden disminuir la sensibilidad. Está disponible en un dentífrico con receta y barniz de flúor.32
APLICACIÓN EN EL CONSULTORIO
Las terapias simples en el consultorio pueden ser útiles para abordar la sensibilidad. Los médicos pueden aplicar una pasta de profilaxis desensibilizante formulada con 8% de arginina y carbonato de calcio para ocluir los túbulos con tapones de arginina, calcio, fosfato y carbonato. Se ha demostrado que soporta la presión pulpar normal y los desafíos ácidos, minimizando con éxito el flujo de fluido del túbulo dentinario y, por lo tanto, la sensibilidad,33 sin dañar la fuerza de unión.El barniz de fluoruro 34
permite la liberación lenta y continua de fluoruro. Los barnices proporcionan un vehículo natural a base de resina para el flúor. El fluoruro de calcio se deposita en la superficie del diente, lo que resulta en la formación de fluorapatita. La adición de oxalato de potasio provoca la formación de oxalato de calcio resistente a los ácidos después de la reacción con el calcio de la dentina.El barniz de contacto extendido 35 es un barniz de fluoruro fotocurado que se puede utilizar para disminuir la hipersensibilidad dentinaria. Consiste en un ionómero de vidrio modificado con resina que incorpora glicerofosfato con liberación de fluoruro. También fomenta la formación de etiquetas de resina, lo que permite la oclusión instantánea y a largo plazo de los túbulos. Otro producto de barniz combina un 5% de glutaraldehído y un 35% de hidroxietilmetacrilato. Actúa como fijador biológico y crea una coagulación de proteínas plasmáticas en los túbulos, bloqueando las aberturas. Capaz de reducir la sensibilidad durante al menos tres meses,,sup>36 puede infiltrar dentina húmeda y grabada al ácido. Estos barnices son compatibles con adhesivos, cementos y materiales restauradores y de acumulación de núcleos.37
El barniz de clorhexidina forma una barrera mecánica después del secado, que reduce la sensibilidad, al tiempo que proporciona una acción antiplaca y antibacteriana.38
También se ha demostrado que los oxalatos disminuyen la permeabilidad dentinal y bloquean los túbulos.39 El oxalato reacciona con los iones de calcio en la dentina para formar cristales de oxalato de calcio en los túbulos y en la superficie. Sin embargo, el efecto se reduce con el tiempo, ya que los cristales se eliminan mediante el cepillado y los ácidos dietéticos. El grabado mejora la infiltración de cristales de oxalato de calcio en los túbulos.39
Los médicos también pueden usar un desensibilizador curado por luz que reduce la sensibilidad a través de la reacción del monómero con calcio en el diente y la formación de etiquetas de resina, lo que resulta en la oclusión de los túbulos. Una luz de curado polimeriza posteriormente la capa de resina. Se puede utilizar para el sellado inmediato de la dentina de los dientes preparados.
OPCIONES DE TRATAMIENTO INVASIVO
Cuando las terapias menos invasivas no son eficaces, el tratamiento de unión, injerto y láser puede proporcionar alivio de la hipersensibilidad dentinaria. Los agentes de unión se pueden utilizar para desensibilizar y unir simultáneamente.40 Dependiendo del producto utilizado, una desventaja potencial de este enfoque es la necesidad de ácido fosfórico antes de colocar el agente de unión, lo que puede requerir el uso de anestesia.
Una alternativa es utilizar un adhesivo de autograbado. Otro agente de unión disponible bloquea los túbulos dentinales y contiene triclosán para minimizar la formación de placa.41 Un modo alternativo de desensibilización es cubrir las superficies de las raíces expuestas con injertos. Sin embargo, esto debe considerarse antes de las técnicas de unión, ya que las restauraciones unidas podrían impedir un injerto exitoso.42 El uso de Nd:Los láseres YAG proporcionan absorción de energía térmica en la dentina, lo que puede provocar oclusión o estrechamiento de los túbulos dentinarios.39,43
RESUMEN
La hipersensibilidad dentinaria es causada por la dentina expuesta en la que los estímulos desencadenan el movimiento del líquido del túbulo dentinario que activa las fibras nerviosas para causar dolor. La relación entre la precipitación superficial e intratubular y la moderación de la sensibilidad no es sencilla. No es la cantidad de precipitado, sino, más bien, la calidad, la densidad, la porosidad, la profundidad de penetración y la fuerza de unión a la dentina lo que afecta a los resultados.40 En última instancia, la eficacia del tratamiento se determina por el tiempo que dura la disminución o eliminación.
Las decisiones de tratamiento deben basarse en la gravedad y etiología de la hipersensibilidad dentinaria. Algunos tratamientos en el consultorio brindan un alivio inmediato que se puede seguir con una variedad de remedios caseros. Se puede justificar una combinación de técnicas para proporcionar alivio a largo plazo.
CONCLUSIONES CLAVE
-
- La teoría hidrodinámica es la causa más comúnmente acordada de hipersensibilidad dentinaria.
- Los túbulos dentinales abiertos muestran una alta conductancia hidráulica, contribuyendo así a la sensibilidad; por el contrario, el flujo de fluido disminuye si los túbulos están bloqueados. Esto proporciona un medio para varios enfoques de tratamiento.
- La prevalencia de esta afección es ligeramente superior entre las mujeres3,con caninos y premolares de ambos arcos más comúnmente involucrados.4
- Típicamente, el dolor de hipersensibilidad es localizado y de corta duración; esto difiere del dolor pulpar, que es prolongado, sordo, doloroso, mal localizado y dura más que el estímulo aplicado.
- El uso de un dique de goma puede ser útil cuando se intenta aislar el diente o dientes sujetos a hipersensibilidad.
- Los médicos pueden recomendar una variedad de terapias para uso en el hogar o en el consultorio. Los tratamientos más comunes incluyen agentes antiinflamatorios, precipitantes de proteínas, agentes ocluyentes de túbulos y selladores de túbulos.
- Las decisiones de tratamiento deben basarse en la gravedad de la sensibilidad y la etiología, y puede justificarse una combinación de técnicas para proporcionar un alivio efectivo.
-
-
- Addy M. hipersensibilidad de la Dentina: Nuevas perspectivas sobre un viejo problema. Int Dent J. 2002; 52: 367-375.
- Addy M. Etiología e implicaciones clínicas de la hipersensibilidad a la dentina. Dent Clin North Am. 1990;34:503–514.
- Flyn J, Galloway R, Orchardson R. La incidencia de dientes hipersensibles en el oeste de Escocia. J Dent. 1985;13:230–236.
- Addy M, Mostafa P, Newcombe RG. Hipersensibilidad a la dentina: Distribución de la recesión, sensibilidad y placa. J Dent. 1987;15:242–248.
- Dababneh RH, Khouri AT, Addy M. Hipersensibilidad a la dentina – ¿un enigma? Una revisión de la terminología, los mecanismos, la etiología y la gestión. Br Dent J. 1999; 187: 606-611.
- Holland GR, Narhi MN, Addy M, Gangarosa L, Orchardson R. Guidelines for the design and conduct of clinical trials on dentine hipersensibilidad. J Clin Periodontol. 1997;24:803–813.
- Li Y. Innovaciones para combatir la hipersensibilidad a la dentina: estado actual de la técnica. Compend Contin Educ Dent. 2012; 33 (Suppl): 10-16.
- Kramer IRH. La relación entre sensibilidad a la dentina y movimientos en el contenido de los túbulos dentinarios. Br Dent J. 1955; 98: 391-392.
- Brännström M. La inducción del dolor en la dentina y la pulpa humanas mediante estímulos químicos. Arch Oral Biol. 1962;7:59–62.
- Pashley DH. Complejo dentina-predentina y su permeabilidad: resumen fisiológico. J Dent Res. 1985; 64 (Suppl): 613-620.
- Magloire H, Maurin JC, Couble ML, et al. Revisión de temas. Dolor dental y odontoblastos: hechos e hipótesis. Dolor Orofac. 2010;24:335–349.
- Camilotti V, Zilly J, Nassar CA, Nassar PO. Tratamientos desensibilizantes para la hipersensibilidad a la dentina: un ensayo clínico aleatorizado de boca dividida. Braz Oral Res. 2012; 26: 263-268.
- Chabanski MB, Gillam DG, Bulman JS, Newman HN. Prevalencia de sensibilidad a la dentina cervical en una población de pacientes remitidos a un departamento de periodoncia especializado. J Clin Periodontol. 1996;23:989–992.
- Uchida A, Wakano Y, Fukuyama O, Miki T, Iwayama Y, Okada H. Evaluación clínica controlada de un dentífrico de cloruro de estroncio al 10% en el tratamiento de la hipersensibilidad a la dentina tras cirugía periodontal. J Periodontol. 1980;51:578–581.
- Absi EG, Addy M, Adams D. Hipersensibilidad a la dentina – el efecto del cepillado de dientes y los compuestos dietéticos sobre la dentina in vitro: un estudio SEM. J Rehabilitación Oral. 1992;19:101–110.
- Kahler W. El enigma del diente agrietado: terminología, clasificación, diagnóstico y manejo. Soy J Dent. 2008;21:275–282.
- Bartlett DW. The role of erosion in tooth wear: aetiology, prevention and management (en inglés). Int Dent J. 2005; 55 (Suppl): 277-284.
- Zero DT, Lussi A. Erosión-factores químicos y biológicos de importancia para el odontólogo. Int Dent J. 2005; 55: 285-290.
- Lambrechts P, Van Meerbeek B, Perdigão J, Gladys S, Braem M, Vanherle G. Terapia restaurativa para la lesión erosiva. Eur J Sci Oral. 1996;104:229–240.
- Grippo JO. Lesiones cervicales no múltiples: la decisión de ignorar o restaurar. J Esthet Dent. 1992;4:55–64.
- Abrahamsen TC. La dentición desgastada-patrones patognomónicos de abrasión y erosión. Int Dent J. 2005; 55 (Supl):268–276.
- McIntyre F. Restauración estética y guía anterior en dientes anteriores desgastados. Un enfoque multidisciplinario conservador. J Am Dent Assoc. 2000;131:1279–1283.
- Michael JA, Townsend GC, Greenwood LF, Kaidonis JA. Abfracción: separando los hechos de la ficción. Aust Dent J. 2009; 54: 2-8.
- Lee WC, Eakle WS. Posible papel de la tensión de tracción en la etiología de las lesiones erosivas cervicales de los dientes. J Prosthet Dent. 1984;52:374–380.
- Swift EJ Jr.Sensibilidad dental y blanqueamiento. Compend Contin Dent Educ Dent.2005; 26 (Suppl): 4-10.
- Consejo Consultivo Canadiense sobre Hipersensibilidad a la Dentina. Recomendaciones consensuadas para el diagnóstico y manejo de la hipersensibilidad dentinaria. J Can Dent Assoc. 2003;69:221–226.
- Al-Saud LM, Al-Nahedh HN. Efecto oclusivo del láser Nd:YAG y diferentes agentes desensibilizantes de dentina en túbulos dentinarios humanos in vitro: una investigación de microscopía electrónica de barrido. Operación. 2012;37:340–355.
- Poulsen S, Errboe M, Hovgaard O, Worthington HW. Pasta de dientes con nitrato de potasio para la hipersensibilidad a la dentina. Cochrane Database Syst Rev. 2001; 2: CD001476.
- Orchardson R, Gillam DG. Manejo de la hipersensibilidad a la dentina. J Dent Assoc. 2006;137:990–998.
- Borges BC, Souza-Junior EJ, da Costa Gde F, et al. Efecto del pretratamiento de la dentina con una pasta de fosfato cálcico fosfopeptídico amorfo de caseína (CPP-ACP) sobre la fuerza de unión de la dentina en cavidades tridimensionales. Acta Odontol Scand. 2013;71:271–277.
- Forsback AP, Areva S, Salonen JI. Mineralización de dentina inducida por tratamiento con vidrio bioactivo S53P4 in vitro. Acta Odontol Scand. 2004;62:14–20.
- Karlinsey RL, Mackey AC. Preparación de estado sólido y aplicación dental de un fosfato cálcico modificado orgánicamente. J Mater Sci. 2009;44:346–349.
- Panagakos F, Schiff T, Guignon A. Hipersensibilidad a la dentina: tratamiento eficaz con una pasta desensibilizante en el consultorio que contiene 8% de arginina y carbonato de calcio. Soy J Dent. 2009; 22 (Suppl):3A–7A.
- García-Godoy A, García-Godoy F. Efecto de una pasta desensibilizante al 8,0% de arginina y carbonato de calcio en el consultorio sobre la resistencia a la unión cortante de compuestos al esmalte dental humano. Soy J Dent. 2010;23:324–326.
- Camilotti V, Zilly J, Busato Dop M, Nassar CA, Nassar PO. Tratamientos desensibilizantes para la hipersensibilidad a la dentina: un ensayo clínico aleatorizado de boca dividida. Braz Oral Res. 2012; 26: 263-268.
- Sethna GD, Prabhulji MLV, Karthikeyan BV. Comparación de dos formas diferentes de barnices en el tratamiento de la hipersensibilidad a la dentina: un estudio clínico aleatorizado ciego. Prevención de Salud Bucal. 2011;9:143–150.
- Dijkman GE, Jongebloed WL, de Vries J, Ogaard B, Arends J. Cierre de túbulos dentinales mediante tratamiento con glutaraldehído, un estudio de microscopía electrónica de barrido. Scand J. Dent Res. 1994; 102: 144-150.
- Sköld-Larsson K, Sollenius O, Petersson LG, Twetman S. Efecto de las aplicaciones tópicas de una nueva fórmula de barniz de clorhexidina y timol sobre el desarrollo de estreptococos mutantes y caries en fisuras oclusales de molares permanentes. J Clin Dent. 2009;20:223–226.
- Lan WH, Lee BS, Liu HC, Lin CP. Estudio morfológico del uso del láser Nd:YAG en el tratamiento de la hipersensibilidad dentinaria. J Endod. 2004;30:131–134.
- Ide M, Morel AD, Wilson RF, Ashley FP. El papel de un agente de unión de dentina en la reducción de la sensibilidad a la dentina cervical. J Clin Periodontol. 1998;25:286–290.
- Yu X, Liang B, Jin X, Fu B, Hannig M. Estudio comparativo in vivo sobre la eficacia desensibilizante de los desensibilizadores de dentina y los adhesivos de autograbado de una botella. Operación. 2010;35:279–286.
- Douglas de Oliveira DW, Marques DP, Aguiar-Cantuária IC, Flecha OD, Gonçalves PF. Efecto de la cobertura de defectos quirúrgicos sobre la hipersensibilidad y la calidad de vida de la dentina cervical. J Periodontol. 2013;84:768–775.
- Orhan K, Aksoy U, Can-Karabulut DC, Kalender A. Terapia láser de bajo nivel de hipersensibilidad a la dentina: un ensayo clínico a corto plazo. Láseres Med Sci. 2011;26:591–598.
-