- Protocolos
- Producción de hibridomas
- Representación esquemática de fusión celular
- Equipo necesario
- Medio y otros reactivos (Consulte el Apéndice A para obtener más información)
- Antes de comenzar (consulte el Apéndice A para obtener más detalles)
- Descongelación y crecimiento de las células del mieloma
- El proceso de fusión
- Tres días antes – Prepare las células de mieloma para la fusión
- Un día antes – prepare el medio
- Día de la fusión
- Día después de la fusión
- Apéndice I
Protocolos
Producción de hibridomas
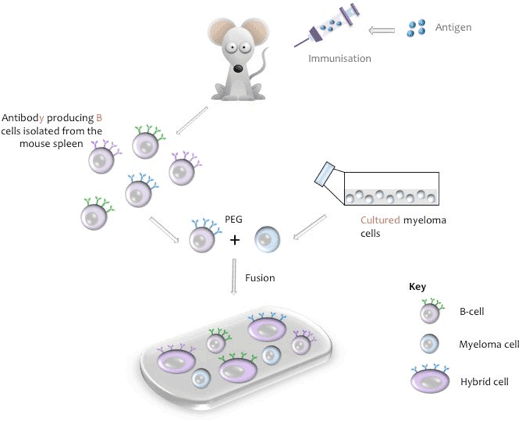
Un hibridoma es una línea celular que surge de una célula híbrida que es capaz de segregar un anticuerpo monoclonal específico de un epítopo de su antígeno de forma permanente en cultivo. La célula híbrida se produce a través de la fusión de células B productoras de anticuerpos específicos de un animal inmunizado (generalmente un ratón, rata o conejo) y que tiene una vida útil finita, con una célula de una línea celular de mieloma cultivada «inmortal» (por ejemplo, ratón NS-1 o NS-0).
Producción de una célula híbrida de ratón
Durante el proceso de fusión, las células B se aíslan del bazo de ratón, se mezclan con la línea celular de mieloma de ratón y se induce la fusión con polietilenglicol (PEG, véase el Apéndice I). (La línea de mieloma pertinente se utiliza cuando se utilizan células B de otras especies animales). Los hibridomas resultantes se cultivan en un medio de cultivo de tejidos que contiene Hipoxatina, Aminopterina y Timidina (HAT), un paso que mata las células de mieloma no fusionadas que podrían superar a las otras células de hibridoma más débiles. Las células B no fusionadas tienen poderes de división limitados y morirán de forma natural en cultivo. Diez días después del proceso de fusión, se recoge el sobrenadante de cultivo y se analiza la presencia del anticuerpo deseado.
Representación esquemática de fusión celular
Equipo necesario
- Un entorno estéril, en el que preparar y manipular celdas (flujo laminar o gabinete de clase II)
- Una incubadora a 37 ° C, con 5% de CO2 y humedad del 95%
- Un microscopio invertido
- Un baño de agua de 37 ° C que se puede colocar en el gabinete
- Una centrifugadora con rotor basculante
- Instrumentos de disección estériles, idealmente dos juegos, cada uno compuesto por dos pares de tijeras y pinzas (una curvada y una roma).
- matraces de cultivo de Corning de tejido de 75 ml-Ref. 15430641
- placas de halcón de 24 pozos-Ref. 353047
- Pipetas estériles
- Llenador de pipetas
- Pipetas pasteur estériles
- Un temporizador
Medio y otros reactivos (Consulte el Apéndice A para obtener más información)
- RPMI 1640 bicarbonato tamponado, con L-Glutamina (Lonza Ref. BE12-702F)
- RPMI 1640 Hepes tamponado, sin L-Glutamina
- Suero fetal Bovino de buena calidad (probado por lotes) (Genycell Ref. GCS0101-500)
- Penicilina / Estreptomicina (Gibco Ref. 15070-063)
- Ultraser G (Pall Ref. 15950-017)
- SOMBRERO (Hipoxatina, Aminopterina, Timidina) (Gibco Ref. 21060-017)
- PEG 1500 (Roche Ref. 10783641001)
Antes de comenzar (consulte el Apéndice A para obtener más detalles)
- Hacer 500 ml de A
- Hacer 500 ml de medio A+
- Hacer 100 ml de medio B
- Hacer 100 ml de medio C
- Hacer 500 ml de medio D
Descongelación y crecimiento de las células del mieloma
Descongelar la línea celular del mieloma y crecer en el medio A. Utilice el siguiente método para descongelar y cultivar la línea celular de mieloma.
- Retire el vial congelado de células de mieloma del almacenamiento de LN2.
- Coloque las celdas en un baño de agua a 37 ° C.
- Mantenga la tapa del vial de congelación por encima de la superficie del agua para disminuir las posibilidades de contaminación.
- Cuando las células estén casi descongeladas (solo queda un pequeño trozo de hielo), muévase a la capucha de cultivo de tejidos.
- Limpie la parte exterior del vial con etanol al 70% y retire la parte superior.
- Retire con cuidado la suspensión celular utilizando una pipeta Pasteur estéril.
- Transferir el contenido a un tubo de centrífuga que contiene 10 ml de medio A (véase el apéndice A)
- Girar suavemente la suspensión celular a 300 g durante 5 min.
- Retirar el sobrenadante y resuspender las células en 10 ml de medio fresco A y colocarlas en un matraz pequeño (25 cm2).
- Tomar 1 ml de suspensión del matraz original y añadirlo a otro con 9 ml de medio A. De este modo se garantiza que, si la concentración en el primer matraz es demasiado alta, se dispone de una segunda concentración (inferior) de células.
- Coloque los matraces en la incubadora de CO2. Recuerde dejar las tapas del matraz ligeramente abiertas para permitir el intercambio gaseoso.
El proceso de fusión
Tres días antes – Prepare las células de mieloma para la fusión
Las células de mieloma deben estar en fase de crecimiento exponencial cuando las use y esto necesita experiencia. Sin embargo, si configura dos matraces de 75 cm2 de células de mieloma, uno a una dilución de 1:40 y otro a 1:60 (ver más abajo), 3 días antes de la fusión, uno de los matraces debería ser ideal el día de la fusión. (La configuración inicial de frascos adicionales en diluciones por encima y por debajo de las que se dan aquí debe proporcionarle la experiencia necesaria para juzgar la tasa de crecimiento de las células de mieloma para las fusiones posteriores).
Un día antes – prepare el medio
Lo siguiente debe hacerse y precalentarse a 37 ° C(puede colocarlos en su incubadora durante la noche).
- Dos x 200 ml de medio A+ en dos matraces de 75 cm2
- 100 ml de medio B
- 100 ml de medio C
- 1×4 ml PEG 1500 transferido a una lámina envuelta (la CLAVIJA es sensible a la luz) universal estéril
- Un mini baño de agua, hecho de un vaso de precipitados de 200 ml que contiene aproximadamente 100 ml de agua destilada y cruzado con cinta lo suficientemente ancha para que haya una abertura para sostener un tubo Falcon de 50 ml en posición vertical
Día de la fusión
- Matar al ratón (siguiendo las pautas institucionales), extraer el bazo y ponerlo en un recipiente estéril que contenga 5 ml de medio C.
- Todos los pasos posteriores deben realizarse en una campana de flujo laminar.
- Coloque el bazo y el medio en una placa de petri.
- Mueva el bazo con fórceps estériles para lavarlo. Retire las adherencias y transfiera el bazo a una segunda placa de petri
- Corte el bazo en dos. Sostenga una mitad con pinzas romas y, usando otro par de pinzas curvas, extraiga suavemente las células de la cápsula del bazo, teniendo cuidado de extraer tantas células como sea posible. Repetir utilizando la segunda mitad del bazo
- Retirar los restos de la cápsula del bazo y, utilizando una pipeta Pasteur estéril, mezclar bien las células, pero muy suavemente.
- Transfiera la suspensión celular a un tubo de 15 ml y use otros 5 ml de C medio para enjuagar la placa de petri y agregarla a las células del bazo en el tubo.
- Cuente el mieloma y las células del bazo.
- Se necesita una proporción de 1 célula de mieloma por cada 10 células del bazo
- Agregar las células de mieloma a un tubo cónico de 50 ml.
- Centrifugar las células del bazo (tubo de 15 ml) y las células del mieloma (tubo de 50 ml) durante 300 g durante 10 minutos.
- Vierta con mucho cuidado el sobrenadante de ambos tubos y resuspenda suavemente los gránulos cada uno en 10 ml de medio B. La ausencia de FBS hasta que se complete el proceso de fusión es extremadamente importante, ya que las células no se fusionarán si hay FBS presente)
- Combine las células del bazo resuspendidas y las pastillas de mieloma en un tubo centrífugo de 50 ml.
- Centrifugar durante 5 minutos a 300 g.
- Vierta con mucho cuidado la mayor cantidad de sobrenadante posible.
- Resuspenda el pellet golpeando suavemente el tubo en el banco. No golpee el gránulo o la pipeta, ya que esto distribuirá las células alrededor del tubo, reduciendo el número de células disponibles para la fusión.
- Coloque el tubo en el baño de agua casero.
- Agregue 1,2 ml de PEG gota a gota durante un minuto, revolviendo suavemente cada pocas gotas.
- Agregue 1 ml de B medio, gota a gota durante un minuto, revolviendo suavemente cada pocas gotas.
- Agregue 2 ml más de B medio, gota a gota durante dos minutos, revolviendo suavemente cada pocas gotas.
- Agregue otros 4 ml de B medio, gota a gota durante cuatro minutos, revolviendo suavemente cada pocas gotas.
- Al final del tiempo, agregue 8 ml de medio C.
- Centrifugar el tubo de células durante 5 minutos 300 g.
- Decantar con mucho cuidado el sobrenadante y resuspender el gránulo celular durante 1 minuto con 10 ml de medio A+. Para hacer esto, agregue unos pocos ml del medio para comenzar a romper el gránulo. Succione estos grupos de células muy suavemente y muévase hacia arriba y hacia abajo en la pipeta. Expulsa estas células y repite el proceso. Sea muy suave, no fuerce el pellet, puede tener pequeños grupos de células cuando termine. Las células son extremadamente frágiles en esta etapa.
- Coloque los 10 ml de mezcla de fusión resuspendida en 190 ml de medio cálido A +
- El volumen final es de 200 ml
- Coloque 1 ml de esta suspensión en cada pocillo de placas de 8 x 24 pocillos (2 ml). (192 pocillos en total)
- Deje las placas en la incubadora durante la noche (aproximadamente 24 horas).
Día después de la fusión
- Añadir 8 ml de SOMBRERO en 200 ml de medio A+.
- Coloque 1 ml de este medio selectivo en cada pocillo de las 8 placas.
- Deje las placas en la incubadora. Las colonias aparecerán entre 7 y 10 días

Apéndice I
Medio de cultivo A:
Medio RPMI 1640 con L-Glutamina (tamponado con bicarbonato) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicilina (100U/ml)/Estreptomicina (100 mg/l) (Gibco Ref. 15070-063)
Medio de cultivo A+:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
Culture Medium B (no FBS):
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium C:
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium D:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
+ HAT (Hypoxathine, Aminopterin, Thymidine) supplement which is usually 50X (dilute 10ml in 500mls of medium) (Gibco Ref. 21060-017)