- Plasticidad de los CMV en Fisiología y Enfermedad
- Las CMV afectan las Respuestas Inmunitarias Adventicias en Ratones hiperlipidémicos
- el Envejecimiento o la Cronicidad o Ambos?
- Las Estructuras Adventicias de Nueva Formación Participan en la Función atlo promoviendo la Recirculación de linfocitos
- La Formación de Atlo está Altamente Territorializada, lo que indica que las Señales se Transmiten desde las Placas a la Adventicia a través de CMV tipo Organizador de Tejido Linfoide
- Los CMV contribuyen Directamente a la Inmunidad Adventicia en la Aterosclerosis
- Conclusión
- Contribuciones de los autores
- Financiación
- Declaración de Conflicto de Intereses
Plasticidad de los CMV en Fisiología y Enfermedad
Las células musculares lisas vasculares (CMV) son los componentes principales de las arterias de tamaño mediano y grande. Aunque los mecanismos de aterogénesis en gran medida aún no se han definido, los estudios han demostrado que la progresión de la enfermedad implica la diafonía entre las células inmunitarias con EC y CMVV. Algunas de estas interacciones promueven el crecimiento de la placa, mientras que otras atenúan el tamaño, la composición celular y la estabilidad de las placas ateroscleróticas (1, 2) (Figura 1, Tabla 1). Las CMV muestran una plasticidad notable en respuesta a la lesión vascular, la inflamación y la acumulación de lipoproteínas durante la progresión de la enfermedad a través de la reprogramación de la expresión génica y el cambio a un fenotipo proliferativo, pro-migratorio y activado, es decir, el cambio de fenotipo (5). En la Figura 1, representamos interruptores moleculares críticos que se han propuesto como reguladores importantes de la progresión de la enfermedad(3, 6, 8, 11). Durante el inicio de la aterosclerosis, los monocitos derivados de la sangre, que han sido reclutados en la íntima, acumulan lípidos dándoles una apariencia espumosa. Estas células de espuma contribuyen a la formación de rayas grasas que constituyen la etapa más temprana y posiblemente reversible de las placas ateroscleróticas. Las rayas de grasa se desarrollan gradualmente en ateromas / placas que finalmente conducen a placas expandidas que contienen CMV, células T y células mieloides (Figura 1) (33). Curiosamente, la composición de una placa aterosclerótica en lugar de su tamaño determina su estabilidad, ya que el grosor de la tapa fibrosa y el tamaño del núcleo necrótico son características potenciales de una placa estable vs.inestable, respectivamente (4, 9). Tradicionalmente, las CMV en la capa íntima se consideran beneficiosas durante la aterogénesis porque producen componentes de matriz extracelular, promoviendo así la formación de tapas fibrosas más fuertes, lo que resulta en protección contra la ruptura de la placa (4, 9). Es cada vez más evidente que los CMV experimentan una gran cantidad de transformaciones fenotípicas estructurales y funcionales e incluso pueden perder por completo sus características nativas para adquirir características de otros tipos de células, incluidos los macrófagos. Los datos indican que las CMV pueden adquirir fenotipos dicotómicos con una naturaleza tipo cabeza Janus, es decir, propiedades pro vs.antiaterogénicas, dependiendo del entorno tisular y la acción de los factores de riesgo (3). Los CMV liberan citocinas para estimular las CE adyacentes para expresar moléculas de adhesión y liberar citocinas, y/o mejorar la quimiotaxis de monocitos / macrófagos en la placa (3, 34, 35) (Tabla 1). Estos datos indican que la acumulación de CMV en la tapa fibrosa o íntima es beneficiosa, mientras que su pérdida o transición a un fenotipo inflamatorio es perjudicial, y que el equilibrio entre proliferación/migración vs muerte/senescencia determina la ateroprogresión vs estabilidad de la placa (3). Varios aspectos adicionales de la biología de VSMC en salud y enfermedad fueron cubiertos recientemente por una serie de excelentes revisiones (https://academic.oup.com/cardiovascres/issue/114/4) y no serán cubiertos aquí. A continuación, por lo tanto, centramos la atención en el papel de la adventicia y el impacto potencial de los VSMCS en la formación de ATLO.

Figura 1. Los fenotipos de CMV durante la progresión de la aterosclerosis revelan una plasticidad extraordinaria. ECs y CMV en placas ateroscleróticas muestran fenotipos activados (ERS) (3, 4). Algunos de los VSMCS se originan en los medios de comunicación después del reclutamiento en la íntima; otros CMV pueden derivarse de la médula ósea o pueden provenir de células mieloides en la circulación (➋) (3). Una fracción de los CMV proliferan ( ➌ ) (3, 5). Las VSMC secretan componentes de matriz extracelular; el factor de transcripción pluripotente, es decir, Klf4, puede desempeñar un papel importante en un proceso conocido como cambio de fenotipo (➍) (6, 7). En los intentos de proteger la placa aterosclerótica de la ruptura letal, la Oct4 puede controlar un proceso que se ha denominado de retorno para formar una tapa fibrosa (ERS) (4, 8-10). La senescencia y la apoptosis desencadenan la generación de citocinas inflamatorias adicionales para formar un núcleo necrótico que inicia un círculo vicioso con consecuencias clínicas letales durante las últimas etapas de la enfermedad (ERS) (3, 4, 11).
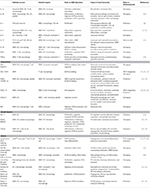
Tabla 1. Mediadores inflamatorios clave implicados en la inmunidad aterosclerosis mediada por VSMC.
Las CMV afectan las Respuestas Inmunitarias Adventicias en Ratones hiperlipidémicos
Durante las últimas dos décadas, se hizo cada vez más evidente que la adventicia es un tejido altamente complejo e inmunológicamente activo que alberga células tan diversas como las células estromales, los nervios, los vasos linfáticos, la vasora y los leucocitos/células progenitoras residentes, todos los cuales tienen la capacidad de afectar el progreso de la enfermedad (36, 37). Observamos que la adventicia de ApoE – / – ratones sufre importantes eventos de reestructuración durante todas las etapas de la aterosclerosis: Tanto las células inmunitarias innatas como las adaptativas se acumulan adyacentes a las placas ateroscleróticas vecinas (Figura 2). Por otra parte, nuestros estudios en ratones experimentales se corroboraron en arterias enfermas humanas: Nosotros y otros observamos estructuras similares a ATLO en la adventicia de pacientes que presentaban aneurismas aórticos ateroscleróticos (38, 39) y, más recientemente, Akhavanpoor et al. se observaron ATLOs bien desarrollados en la adventicia de un porcentaje considerable de pacientes con cardiopatía isquémica (40). En la aterosclerosis murina, la neogénesis de los vasos linfáticos, el venulo endotelial alto (VHE) y los vasos sanguíneos son características prominentes de este proceso de reestructuración (16, 41).
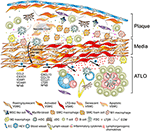
Figura 2. Las células del músculo liso vascular (CMSV) participan en la inmunidad adventicia durante la formación de placa. Las CMV intercaladas entre placas ateroscleróticas y la adventicia adoptan un fenotipo tipo organizador de tejido linfoide tras la activación a través de señales derivadas de placa (ERS) y posteriormente se transdiferencian en células similares a LTo (ERS). Por medio de su fenotipo proliferativo y de expresión de citoquinas, afectan la reestructuración y la escultura de la adventicia, incluida la angiogénesis, la formación de VHE y la neogénesis de los vasos linfáticos (ERS). El cambio de fenotipo también resulta en la expresión y secreción de quimiocinas linforganogénicas, es decir, CXCL13 y CCL21, promoviendo así la formación de ATLO representada esquemáticamente en la parte inferior del gráfico (➍).
el Envejecimiento o la Cronicidad o Ambos?
Es importante destacar que el envejecimiento fue un determinante importante de la reestructuración y escultura adventicia. Los ATLOs completamente desarrollados se forman durante las etapas avanzadas de la aterosclerosis, pero sus etapas tempranas, es decir, los agregados de células T/B, emergen en paralelo a la formación de placas ateroscleróticas (16, 27, 41, 42). De hecho, estos ATLOS tempranos se forman a la edad de ~30 semanas y alcanzan etapas más avanzadas alrededor de las 52 semanas para alcanzar su punto máximo a las 78 semanas (16, 41). Se han observado estadios de desarrollo similares dependientes de la edad de los TLO en otras enfermedades crónicas no solucionables (1, 42). Estos datos indican que el desarrollo de ATLO depende de la edad y el envejecimiento se asocia positivamente con la escultura adventicia (Figura 2). Sin embargo, la relación entre el envejecimiento y la cronicidad es difícil de estudiar en la aterosclerosis murina, ya que el desarrollo de placa aterosclerótica comienza en el arco aórtico, luego viaja sembrado por la aorta para llegar a la aorta abdominal en etapas posteriores de la enfermedad, por lo que toma largos períodos de tiempo. Se necesita más trabajo para aclarar la importante cuestión de si la senescencia de las células inmunitarias y/o VSMC contribuye a la formación de ATLO y qué tipos de células, p. ej., VSMC, EC y / o células inmunitarias comprometidas. Los estudios en otras formas de formación de TLO, como los que ocurren en el pulmón y el tracto gastrointestinal, indicarían que es la cronicidad de una reacción inflamatoria tisular persistente, en lugar de los eventos de envejecimiento genuino del sistema inmunitario, lo que contribuye de manera crucial a la formación de ATLOs (43, 44).
Las Estructuras Adventicias de Nueva Formación Participan en la Función atlo promoviendo la Recirculación de linfocitos
Los estadios ATLO avanzados incluyen agregados de células T/B, centros germinales dentro de folículos de células B activados, vasos linfáticos, VEV en áreas de células T y redes de conductos extracelulares (16). Estos cambios importantes se asemejan a estructuras que recuerdan a las que se encuentran en los órganos linfoides secundarios, donde promueven aspectos fundamentales de las respuestas inmunitarias hacia el antígeno, incluida la recirculación de linfocitos naïve para encontrar sus antígenos/autoantígenos cognitivos, y la organización de la maduración de afinidad de las células B hacia los autoantígenos potenciales. Mediante estudios de transferencia adoptiva de linfocitos, observamos que los ATLOs mejoran en gran medida el reclutamiento de linfocitos en la pared arterial al promover la inmigración y la atenuación concomitante de la emigración de linfocitos sin experiencia en antígenos (27). Después de su reclutamiento, las células T se activan, comienzan a proliferar, y algunas de las células colaboradoras T CD4 se convierten en células reguladoras T inducidas. Estos datos revelan que el sistema inmunitario en la adventicia es altamente sensible a la reacción inflamatoria tisular subyacente de la pared arterial. Además, las células B que forman centros germinales en folículos activados de células B parecen experimentar una reacción del centro germinal en presencia de células dendríticas foliculares donde algunas se convierten en células B de memoria mientras que otras abandonan los centros germinales para convertirse en células plasmáticas (45). Cuando se toman en conjunto, estos datos indican que los ATLOS en lugar de los órganos linfoides secundarios (como se pensaba anteriormente) organizan la inmunidad a la aterosclerosis.
La Formación de Atlo está Altamente Territorializada, lo que indica que las Señales se Transmiten desde las Placas a la Adventicia a través de CMV tipo Organizador de Tejido Linfoide
Otro aspecto de la reestructuración adventicia durante la aterogénesis es que la formación de ATLO está altamente territorializada, estando en gran medida restringida a los segmentos adventicia adyacentes a las placas ateroscleróticas en la aorta abdominal en ratones (16, 45). Los ATLOs solo se encuentran ocasionalmente en la adventicia de la arteria innominada o del arco aórtico, donde la aterosclerosis es más prominente. Las células inmunitarias de los segmentos torácicos de la aorta se componen principalmente de agregados de células T en comparación con los ATLOs de la aorta abdominal (16, 41). Todavía se desconoce el mecanismo exacto de territorialidad de la formación de ATLOs en la aorta abdominal. Los TLO parecen ser una característica de muchas enfermedades inflamatorias crónicas irresolubles y son distintivos prominentes de las enfermedades autoinmunes (42). La celularidad y las estructuras de los TLO en la aterosclerosis son similares a los TLO en muchas otras enfermedades crónicas, incluida la formación de TLO asociada al cáncer (46, 47). El campo de la biología de la OTT se ha expandido dramáticamente en los últimos años, lo que aumenta la importante posibilidad de que se pueda identificar una nueva diana terapéutica a través de la comprensión de la función de la OTT en cada una de las enfermedades asociadas a la OTT. Sin embargo, los diversos tipos de TLO revelan algunas características específicas de la enfermedad, que en última instancia pueden determinar si las respuestas inmunitarias asociadas son dañinas o protectoras. Estas características específicas de la enfermedad posiblemente surgen a través de uno de varios mecanismos, incluida la especificidad de los órganos y la naturaleza del daño tisular (1, 42). El desarrollo de órganos linfoides es un proceso complejo que involucra células inductoras de tejido linfoide hematopoyético (LTi), células organizadoras de tejido linfoide estromal no hematopoyéticas (LTo) y señalización LTßR. Nuestros estudios in vitro de CMV de aorta de ratón indicaron que, con una estimulación adecuada, pueden servir como células similares a LTo (20), identificadas originalmente durante el desarrollo embrionario durante la formación de tejidos linfoides secundarios, incluidos los ganglios linfáticos y el bazo (48, 49) (ver más abajo). Es importante tener en cuenta que los ATLO parecen involucrar a los CMV como participantes importantes, mientras que otros TLO involucran otras células mesenquimales similares a LTo (50). El denominador común de todas las formas de TLO, sin embargo, parece ser, a diferencia de los órganos linfoides secundarios, una reacción inflamatoria crónica del tejido que impulsa al sistema inmunitario a formar estas estructuras linfoides cercanas o, en algunos casos, dentro del tejido enfermo (42, 43).
Los CMV contribuyen Directamente a la Inmunidad Adventicia en la Aterosclerosis
En vista de la naturaleza altamente territorializada de los ATLOS adyacentes a las placas ateroscleróticas, razonamos que los CMV pueden estar involucrados en la formación de ATLO y, por la misma razón, pueden adoptar un papel funcional en la progresión de la aterosclerosis. Los CMV expresan en gran medida el LTßR constitutivamente (16), mientras que su ligando LTa1ß2 se expresa en varias células inmunitarias denominadas células LTi (51). Se supone que los CMV se activan a través de la vía de señalización LTßR-LT por las células LTi involucradas en la neogénesis secundaria del tejido linfoide. El origen de las células LTi aún no se ha determinado claramente, aunque los macrófagos activados y otras células inmunitarias en la placa íntima son candidatos para esta actividad en la neogénesis LTO. En respuesta a mediadores celulares y solubles, los CMV parecen experimentar un tipo distinto de fenotipo que cambia a un fenotipo similar a LTo por secreción paracrina de las quimiocinas linforganogénicas, es decir, CXCL13 y CCL21, atrayendo así células inmunitarias, por ejemplo, macrófagos/células dendríticas, células T y células B al medio local de adventicia, lo que lleva a la formación de ATLO en la adventicia (27, 41, 45) (Tabla 1). La deficiencia de LTßR global o específica de VSMC en ratones APOE/ apoe hiperlipidémicos de edad avanzada demostró un aumento de la formación de placa aterosclerótica, lo que indica que la LTßR de VSMC tiene la capacidad de atenuar el desarrollo de aterosclerosis en algunas condiciones experimentales (27). Otros estudios, sin embargo, mostraron que los ratones jóvenes globales ApoE−/− LTbR−/−mantenidos bajo una dieta alta en grasas (HFD) revelaron una carga de placa aórtica menor que sus homólogos ApoE-/− alimentados con dieta normal (52). Estos datos aparentemente contradictorios indican que los roles de LTßR en ratones jóvenes y en condiciones de hiperlipidemia excesiva pueden ser diferentes en los dos modelos. Alternativamente, la dieta alta en grasas que conduce a niveles dramáticos y posiblemente intoxicantes de lípidos en plasma, puede ser responsable de estas diferencias. Dado que no usamos regularmente una dieta alta en grasas en ratones ApoE, estas discrepancias siguen siendo problemas sin resolver, aunque se ha demostrado que el sistema inmunológico puede estar abrumado por niveles extremos de lípidos en plasma . Estos datos requieren estudios adicionales para examinar la base molecular de la dicotomía aparente de la LTßR en la progresión de la aterosclerosis en ratones jóvenes vs. ancianos y / o aterosclerosis temprana vs.avanzada. Además, los macrófagos derivados de la médula ósea pueden funcionar como células LTi independientes de LTßR y desencadenar la expresión de CCL19, CCL20 y CXCL16 por CMV (53) (Tabla 1). Por lo tanto, los CMV pueden participar en la formación de TLO en la aterosclerosis mediante la regulación ascendente de quimiocinas linforganogénicas para promover agregados de células inmunitarias en la adventicia. Como se mencionó anteriormente, los ATLO son comunes en humanos agobiados por enfermedad coronaria isquémica (40) y en aneurismas aórticos ateroscleróticos humanos (38, 39). En conjunto, la aparición de ATLOs en ratones experimentales y en aterosclerosis humana plantea preguntas importantes sobre la naturaleza de la aterosclerosis como enfermedad autoinmune: es concebible que durante la aterogénesis se generen células T autoinmunes y células B autoinmunes dirigidas contra autoantígenos aún no identificados. El aislamiento de estos linfocitos autoinmunes, incluida la secuenciación de sus receptores de células T y/o receptores de células B, permitiría probar hipótesis principales en aterosclerosis. De hecho, la investigación de la aterosclerosis sufriría un cambio importante y las pruebas de clones de linfocitos autoinmunes individuales en sistemas funcionales in vitro e in vivo serían posibles.
Conclusión
La aterosclerosis es una enfermedad inflamatoria de las arterias. Los CMV se comunican tanto con las CE como con las células inmunitarias en las placas ateroscleróticas y con las células residentes en la adventicia. Esta capacidad permite que los CMV afecten la inmunidad a la aterosclerosis de manera importante, incluida la formación de ATLOs. Se requiere más trabajo para delinear el papel de los CMV durante las diferentes etapas de la aterosclerosis, determinar su papel en las arterias jóvenes frente al envejecimiento y dilucidar aún más sus papeles dicotómicos en la progresión de la enfermedad. Una mejor comprensión de estos procesos puede abrir el camino para desarrollar estrategias terapéuticas para intervenciones futuras en etapas avanzadas clínicamente importantes de la enfermedad.
Contribuciones de los autores
Todos los autores contribuyeron al diseño, redacción y edición del manuscrito enviado, y lo aprobaron para su publicación.
Financiación
Declaración de Conflicto de Intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un conflicto de intereses potencial.
4. Clarke MC, Figg N, Maguire JJ, Davenport AP, Goddard M, Littlewood TD et al. La apoptosis de las células musculares lisas vasculares induce características de vulnerabilidad de la placa en la aterosclerosis. Nat Med. (2006) 12:1075–80. doi: 10.1038 / nm1459
Resumen de PubMed / Texto completo de CrossRef | Google Scholar
5. Owens GK, Kumar MS, Wamhoff BR. Regulación molecular de la diferenciación celular del músculo liso vascular en el desarrollo y la enfermedad. Physiol Rev. (2004) 84:767-801. doi: 10.1152 / physrev.00041.2003
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
6. Shankman LS, Gomez D, Cherepanova OA, Salmon M, Alencar GF, Haskins RM, et al. La modulación fenotípica dependiente de KLF4 de las células musculares lisas tiene un papel clave en la patogénesis de la placa aterosclerótica. Nat Med. (2015) 21:628–37. doi: 10.1038/nm.3866
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
7. Gómez D, Owens GK. Conmutación fenotípica de células musculares lisas en aterosclerosis. Cardiovasc Res. (2012) 95: 156-64. doi: 10.1093/cvr / cvs115
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
8. Cherepanova OA, Gomez D, Shankman LS, Swiatlowska P, Williams J, Sarmento OF, et al. La activación del factor de pluripotencia OCT4 en las células musculares lisas es ateroprotectora. Nat Med. (2016) 22:657–65. doi: 10.1038/nm.4109
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
10. Yla-Herttuala S, Bentzon JF, Daemen M, Falk E, Garcia-Garcia HM, Herrmann J, et al. Estabilización de placas ateroscleróticas. Documento de posición del Grupo de Trabajo sobre aterosclerosis y biología vascular de la Sociedad Europea de Cardiología (ESC). Trombo Hemostático. (2011) 106:1–19. doi: 10.1160 / TH10-12-0784
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
11. Grootaert MOJ, Moulis M, Roth L, Martinet W, Vindis C, Bennett MR, et al. Muerte celular del músculo liso vascular, autofagia y senescencia en aterosclerosis. Cardiovasc Res. (2018) 114:622-34. doi: 10.1093/cvr / cvy007
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
14. Akhavanpoor M, Akhavanpoor H, Gleissner CA, Wangler S, Dosch AO, Katus HA, et al. Las dos caras de la Interleucina-17A en la Aterosclerosis. Objetivos de Drogas Curr. (2017) 18:863–73. doi: 10.2174/1389450117666161229142155
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
15. Jia G, Cheng G, Gangahar DM, Agrawal DK. El factor de crecimiento similar a la insulina-1 y el TNF-alfa regulan la autofagia a través de las vías de la cinasa N-terminal c-jun y Akt en las células lisas vasculares ateroscleróticas humanas. Biol de Células Inmunológicas. (2006) 84:448–54. doi: 10.1111 / j. 1440-1711. 2006. 01454.x
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
16. Grabner R, Lotzer K, Dopping S, Hildner M, Radke D, Beer M, et al. La señalización del receptor beta de linfotoxina promueve la organogénesis linfoide terciaria en la adventicia de la aorta de ratones ApoE/ ratones de edad avanzada. J Exp Med. (2009) 206:233–48. doi: 10.1084 / jem.20080752
Texto completo de CrossRef / Google Scholar
17. Damas JK, Smith C, Oie E, Fevang B, Halvorsen B, Waehre T, et al. Expresión mejorada de las quimiocinas homeostáticas CCL19 y CCL21 en aterosclerosis clínica y experimental: posible papel patógeno en la desestabilización de la placa. Trombo Arterioscleroso Vasc Biol. (2007) 27:614–20. doi: 10.1161 / 01.ATV.0000255581.38523.7c
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doring Y, Noels H, van der Vorst EPC, Neideck C, Egea V, Drechsler M, et al. Vascular CXCR4 limits atherosclerosis by maintaining arterial integrity: evidence from mouse and human studies. Circulation. (2017) 136:388–403. doi: 10.1161/CIRCULATIONAHA.117.027646
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Akhtar S, Gremse F, Kiessling F, Weber C, Schober A. CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells in Apoe-deficient mice. Arterioscler Thromb Vasc Biol. (2013) 33:679–86. doi: 10.1161/ATVBAHA.112.301162
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lotzer K, Dopping S, Connert S, Grabner R, Spanbroek R, Lemser B, et al. Mouse aorta smooth muscle cells differentiate into lymphoid tissue organizer-like cells on combined tumor necrosis factor receptor-1/lymphotoxin beta-receptor NF-kappaB signaling. Arterioscler Thromb Vasc Biol. (2010) 30:395–402. doi: 10.1161 / ATVBAHA.109.191395
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
21. Smedbakken LM, Halvorsen B, Daissormont I, Ranheim T, Michelsen AE, Skjelland M, et al. Aumento de los niveles de la quimiocina homeostática CXCL13 en la aterosclerosis humana: posible papel en la estabilización de la placa. Aterosclerosis. (2012) 224:266–73. doi: 10.1016 / j.aterosclerosis.2012.06.071
Texto completo de CrossRef / Google Scholar
22. Higashi Y, Sujanov S, Shai SY, Danchuk S, Tang R, Snarski P, et al. La deficiencia del receptor del factor de crecimiento 1 similar a la insulina en macrófagos acelera la aterosclerosis e induce un fenotipo de placa inestable en ratones deficientes en apolipoproteína E. Circulación. (2016) 133:2263–78. doi: 10.1161 / CIRCULATIONAHA.116.021805
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
23. Alexander MR, Owens GK. Control epigenético de la diferenciación de células musculares lisas y conmutación fenotípica en el desarrollo vascular y la enfermedad. Annu Rev Physiol. (2012) 74:13–40. doi: 10.1146 / anurev-fisiol-012110-142315
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
24. He C, Medley SC, Hu T, Hinsdale ME, Lupu F, Virmani R, et al. La señalización PDGFRbeta regula la inflamación local y se sinergiza con la hipercolesterolemia para promover la aterosclerosis. Nat Commun. (2015) 6:7770. doi: 10.1038 / ncomms8770
Resumen de PubMed / Texto completo de CrossRef | Google Scholar
26. Da Ros F, Carnevale R, Cifelli G, Bizzotto D, Casaburo M, Perrotta M, et al. La Interleucina-1beta Dirigida Protege de los Aneurismas Aórticos Inducidos por la Alteración de la Señalización beta del Factor de Crecimiento Transformador. Inmunidad. (2017) 47:959-73 e9. doi: 10.1016 / j.immuni.2017.10.016
Texto completo de CrossRef / Google Scholar
27. Hu D, Mohanta SK, Yin C, Peng L, Ma Z, Srikakulapu P, et al. Los órganos linfoides terciarios de la arteria controlan la inmunidad a la aorta y protegen contra la aterosclerosis a través de los receptores beta de linfotoxina de células de músculo liso vascular. Inmunidad. (2015) 42:1100–15. doi: 10.1016 / j.immuni.2015.05.015
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
29. Paramel Varghese G, Folkersen L, Strawbridge RJ, Halvorsen B, Yndestad A, Ranheim T, et al. Expresión y activación del inflamasoma NLRP3 en la aterosclerosis humana. J Am Heart Assoc. (2016) 5:e003031. doi: 10.1161 / JAHA.115.003031
Texto completo de CrossRef / Google Scholar
30. de Jong RJ, Paulin N, Lemnitzer P, Viola JR, Winter C, Ferraro B, et al. Aptitud protectora de la anexina A1 en la formación de neoíntima arterial en ratones propensos a la aterosclerosis-breve informe. Trombo Arterioscleroso Vasc Biol. (2017) 37:312–5. doi: 10.1161 / ATVBAHA.116.308744
Texto completo de CrossRef / Google Scholar
32. van Gils JM, Derby MC, Fernandes LR, Ramkhelawon B, Ray TD, Rayner KJ, et al. La guía neuroinmune netrin – 1 promueve la aterosclerosis al inhibir la emigración de macrófagos de las placas. Nat Immunol. (2012) 13:136–43. doi: 10.1038 / ni.2205
Texto completo de CrossRef / Google Scholar
35. Tchkonia T, Zhu Y, van Deursen J, Campisi J, Kirkland JL. Senescencia celular y fenotipo secretor senescente: oportunidades terapéuticas. J Clin Invest. (2013) 123:966–72. doi: 10.1172 / JCI64098
Resumen de PubMed / Texto completo de CrossRef | Google Scholar
37. Majesky MW, Horita H, Ostriker A, Lu S, Regan JN, Bagchi A, et al. Las células diferenciadas de músculo liso generan una subpoblación de células progenitoras vasculares residentes en la adventicia regulada por Klf4. Circ Res. (2017) 120:296-311. doi: 10.1161 / CIRCRESAHA.116.309322
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
40. Akhavanpoor M, Gleissner CA, Akhavanpoor H, Lasitschka F, Dosch AO, Katus HA, et al. Clasificación de órganos linfoides terciarios adventicios en aterosclerosis humana. Cardiovasc Patol. (2018) 32:8–14. doi: 10.1016 / j. carpath.2017.08.002
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
41. Moos MP, John N, Grabner R, Nossmann S, Gunther B, Vollandt R, et al. La lámina adventicia es el principal sitio de acumulación de células inmunitarias en ratones con deficiencia de apolipoproteína E alimentados con chow estándar. Trombo Arterioscleroso Vasc Biol. (2005) 25:2386–91. doi: 10.1161 / 01.ATV.0000187470.31662.fe
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
42. Mohanta SK, Yin C, Peng L, Srikakulapu P, Bontha V, Hu D, et al. Los órganos linfoides terciarios arteriales contribuyen a las respuestas inmunitarias innatas y adaptativas en la aterosclerosis avanzada de ratón. Circ Res. (2014) 114:1772-87. doi: 10.1161 / CIRCRESAHA.114.301137
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
43. Buettner M, Lochner M. Development and function of secondary and tertiary lymphoid organs in the small intestine and the colon. Inmunol Frontal. (2016) 7:342. doi: 10.3389 / fimmu.2016.00342
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
45. Srikakulapu P, Hu D, Yin C, Mohanta SK, Bontha SV, Peng L, et al. Los órganos linfoides terciarios arteriales controlan las respuestas de aterosclerosis territorializada de múltiples capas de células B en ratones ApoE/ URAL de edad avanzada. Trombo Arterioscleroso Vasc Biol. (2016) 36:1174–85. doi: 10.1161 / ATVBAHA.115.306983
Texto completo de CrossRef / Google Scholar
48. van de Pavert SA, Mebius RE. Nuevos conocimientos sobre el desarrollo de los tejidos linfoides. Nat Rev Immunol. (2010) 10:664–74. doi: 10.1038 / nri2832
Texto completo Cruzado / Google Scholar
50. Barone F, Gardner DH, Nayar S, Steinthal N, Buckley CD, Luther SA. Fibroblastos estromales en estructuras linfoides terciarias: un nuevo objetivo en la inflamación crónica. Inmunol Frontal. (2016) 7:477. doi: 10.3389 / fimmu.2016.00477
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
51. Scandella E, Bolinger B, Lattmann E, Miller S, Favre S, Littman DR, et al. Restauración de la integridad de los órganos linfoides mediante la interacción de células inductoras de tejido linfoide con estroma de la zona de células T. Nat Immunol. (2008) 9:667–75. doi: 10.1038 / ni.1605
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
52. Grandoch M, Feldmann K, Gothert JR, Dick LS, Homann S, Klatt C, et al. Deficiency in lymphotoxin beta receptor protects from atherosclerosis in apoE-deficient mice. Circ Res. (2015) 116:e57–68. doi: 10.1161/CIRCRESAHA.116.305723
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Guedj K, Khallou-Laschet J, Clement M, Morvan M, Gaston AT, Fornasa G, et al. M1 macrophages act as LTbetaR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis. Cardiovascular research. (2014) 101:434–43. doi: 10.1093/cvr/cvt263
PubMed Abstract | CrossRef Full Text | Google Scholar