Antecedentes
La encefalopatía de Hashimoto (HE) es un síndrome neuropsiquiátrico raro asociado con anticuerpos tiroideos y fue reportado por primera vez por Brain en 1996 (Brain et al., 1966). Presenta una amplia gama de síntomas clínicos, que incluyen manifestaciones neurológicas como episodios similares a accidentes cerebrovasculares, convulsiones, confusión, mioclonía, ataxia, temblores y demencia, así como manifestaciones psiquiátricas, que incluyen psicosis aguda, trastornos depresivos, cambios de personalidad, alucinaciones y esquizofrenia (Kirshner, 2014; Menon et al., 2017). En este reporte de caso, describimos a un paciente con HE cuyos síntomas clínicos y resultados de pruebas de laboratorio imitaban la encefalitis viral.
Reporte de un caso
Un hombre de 59 años que presentó fiebre, dolor de cabeza y habla torpe que se manifestó específicamente como habla lenta y poco clara, fue ingresado en el hospital. Negó infecciones recientes como gripe o gastroenteritis, viajes y otras posibles razones, que podrían ser responsables de la fiebre, que alcanzó un máximo de 39,5°C. La historia clínica previa reveló gota durante 20 años, pero no se recetaron medicamentos. Su examen neurológico y tomografía computarizada (TC) craneal y resonancia magnética (RM) (Figura 1) fueron normales. Los resultados del EEG mostraron irregularidades menores en las ondas (5-20 µv 14-20 Hz β) emitidas desde los hemisferios bilaterales. La rutina sanguínea, la proteína C reactiva, la vitamina B12 sérica y el ácido fólico, así como otros fabricantes de autoinmunidad que contenían anticuerpos antinucleares (ANA), anticuerpos citoplásmicos antianutrofílicos (ANCA) y factores reumatoideos, fueron todos comunes. El líquido cefalorraquídeo (LCR) mostró un aumento del recuento de glóbulos blancos (GB) (104 × 106/L, rango de referencia 0-8 × 10^6/L) y niveles elevados de proteínas (1,68 g/L, rango de referencia 0,15–0,45 g/L). El cultivo, el frotis y los anticuerpos bacterianos, fúngicos, virales y de bacilo de tubérculos en el suero y el líquido cefalorraquídeo fueron negativos. Fue diagnosticado con encefalitis viral y tratado con agentes antivirales. Sus síntomas se aliviaron en una semana y fue dado de alta del hospital. Cinco meses más tarde, fue remitido a nuestro hospital de nuevo debido a una fiebre de 38,5°C y a una confusión ocasional de la sentencia. Se realizó otra punción lumbar, el LCR tuvo un recuento de leucocitos de 39 × 10^6 / L y el contenido de proteína fue de 1,32 g / L. Los resultados de la RM craneal y de las pruebas de laboratorio fueron casi normales, excepto la disminución de la función tiroidea y el aumento de los niveles de autoanticuerpos antitiroideos (ATA) en el suero y el LCR. Los hallazgos iniciales fueron los siguientes: en el suero, la concentración de hormona estimulante de la tiroides (TSH) fue de 43,39 UiU/ml (rango de referencia (RR): 0,27–4,2 UiU/ml), la concentración de triyodotironina libre (FT3) fue de 2,89 pmol/ml (RR: 3,1–6,8 pmol/ml), la concentración de tiroxina libre (FT4) fue de 7,18 pmol/ml (RR: 12,0–22,0 pmol/ml) ml), la concentración total de triyodotironina (TT3) fue de 1,17 pmol/ml (RR: 1,3–3.1 pmol/ml), and total thyroxine (TT4) concentration was 44.26 pmol/ml (RR: 66–181 pmol/ml); the titer of anti-thyroglobulin autoantibodies (TgAb) was 1274 IU/ml (RR: < 115 IU/ml) and the titer of anti-thyroperoxidase autoantibodies (TPOAb) was 600 IU/ml (RR: < 35 IU/ml). In the CSF, ATA was positive (TPOAb 17.06 IU/ml, TgAb 16.02 IU/ml). Ultrasound imaging indicated diffuse lesions of the thyroid. Los análisis de anticuerpos anti-NMDAR, AMPA1, AMPA2, LGI1, CASPR2, GABA, GAD, anti-Hu, Yo, Ri, MAI, MA2, CV2, Anfifisina, SOX-1, Tr, Zic4 y GAD65 fueron negativos tanto en suero como en LCR. El paciente fue finalmente diagnosticado con HE, Tiroiditis de Hashimoto e hipotiroidismo y se le recetó metilprednisolona y Euthyrox. La metilprednisolona se inició a una dosis de 80 mg / día durante 1 semana y se redujo a 40 mg / día en las 2 semanas; posteriormente, se prescribió prednisolona oral, que se destetó a una velocidad de 5 mg por semana, es decir, se utilizó prednisolona oral durante un total de 8 semanas. Sus síntomas se aliviaron en 3 días. El paciente permaneció sano durante un período de seguimiento de 1 año.FIGURA
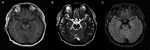
Gráfico 1 Imágenes por resonancia magnética del cerebro. No hay hallazgos anormales en las imágenes de resonancia magnética cerebral del paciente. (A) Imagen ponderada en T1; (B) Imagen ponderada en T2; (C) imagen FLAIR.
Discusión
La tasa de prevalencia estimada de HE es de 2,1 en 100.000 y la proporción de sexos (mujeres a hombres) es de 4:1 (Ferracci et al., 2004). El curso de ÉL puede ser progresivo, remitente-recidivante, o incluso autolimitante. En el presente caso, el paciente parecía tener un curso de recidiva-remitente.
Combinado con los síntomas del paciente, los resultados normales de RMN, los títulos altos de ATA en el suero y la positividad ATA del LCR, el paciente finalmente fue diagnosticado con HE después de excluir otras causas potenciales, como accidente cerebrovascular, tumor, infección del sistema nervioso central, encefalitis autoinmune y síndrome paraneoplásico.
En general, la fisiopatología de HE todavía no es concluyente. Sobre la base de los hallazgos neuropatológicos, se ha propuesto un mecanismo de vasculitis autoinmune. En un estudio previo, las biopsias cerebrales revelaron que la infiltración linfocítica alrededor de las vénulas y arteriolas puede estar involucrada (Duffey et al., 2003). Otro posible mecanismo involucrado es que los ATA atacan antígenos que son compartidos por la tiroides y el cerebro, y por esta razón, los títulos altos de ATA, incluidos los anticuerpos TPOAb, TgAb y anti-receptor de TSH (TSH-R) en el suero y, a veces, en el LCR, se consideran características distintivas de HE (Yoneda, 2018). De manera similar, se encontraron títulos altos de ATA y LCR-ATA en nuestro caso. En un estudio previo, la terapia de intercambio de plasma resultó en una mejora profunda de los síntomas de los pacientes (Tran et al., 2018). En conjunto, estos hallazgos sugieren que ATA juega un papel importante en la educación superior. Sin embargo, los niveles elevados de ATA en el suero también se encuentran en la población general y son especialmente comunes en personas de edad avanzada. Además, el grado de elevación de ATA no está relacionado con la gravedad de la HE. Aunque los niveles séricos de ATA de los pacientes seguían siendo altos después del tratamiento con metilprednisolona, sus síntomas se resolvieron (título de autoanticuerpos antitiroglobulina (TgAb): 041 UI / ml, RR: < 115 UI/ml; título de autoanticuerpos antitiroperoxidasa (TPOA): 600 UI/ml, RR: <35 UI / ml). Nuestros resultados confirman que no hay relación entre el grado de elevación de ATA y la gravedad de la HE.
Aunque la correlación entre ATA y HE aún no está clara (Kirshner, 2014), un equipo de expertos en Neurología Lancet propuso criterios diagnósticos para HE en 2016. Los criterios son los siguientes: (1) encefalopatía con convulsiones, mioclonía, alucinaciones o episodios similares a un accidente cerebrovascular; (2) enfermedad tiroidea abierta subclínica o leve (generalmente hipotiroidismo); (3) hallazgos normales o anomalías inespecíficas mostradas por resonancia magnética cerebral; (4) presencia de anticuerpos tiroideos en el suero (peroxidasa tiroidea, tiroglobulina); (5) ausencia de anticuerpos neuronales bien caracterizados en el suero y el líquido cefalorraquídeo; y (6) exclusión razonable de causas alternativas. Puede ser diagnosticado si un paciente cumple con todos los criterios (Graus et al., 2016). Nuestro paciente cumplió con todos los criterios anteriores y, por lo tanto, pudo ser diagnosticado con HE. La mayoría de los pacientes con HE responden bien a los esteroides; sin embargo, cuando los pacientes son resistentes a los esteroides, otros tratamientos de inmunosupresión, como el intercambio de plasma, IgIV, metotrexato y micofenolato, han demostrado ser eficaces. Las dosis altas de metilprednisolona (500-1000 mg) se usan con mayor frecuencia. Debido a que el paciente mostró síntomas leves y rechazo al uso de dosis altas de metilprednisolona, le recetamos una dosis baja de metilprednisolona. Nuestro paciente se sometió a terapia con esteroides y desde entonces se ha mantenido sano. El paciente no recibió ningún otro tratamiento de inmunoterapia durante el seguimiento. En un estudio observacional retrospectivo realizado por Mamoudjy et al. (2013) los resultados de la investigación indicaron que algunos pacientes con HE sufrieron una recaída, incluso un tercer ataque, que tuvo un intervalo de tiempo más corto (media de 18 días) en comparación con el del segundo ataque (media de 213 días). Los pacientes con recaídas necesitaban metilprednisolona o terapia inmunosupresora de nuevo (Mamoudjy et al., 2013). Nuestro paciente sufrió una recaída unos 150 días después del primer ataque y la terapia con esteroides fue efectiva. Las secuelas, como dolor de cabeza, trastornos de la memoria, etc., también fueron frecuentes (Mamoudjy et al., 2013), sin embargo, nuestro paciente afortunadamente no tuvo secuelas.
La encefalopatía de Hashimoto es difícil de diagnosticar con precisión, debido a su asociación con una amplia gama de síntomas clínicos, así como su presentación inespecífica de neuroimágenes y electroencefalogramas. Un artículo anterior informó de un caso de HE que inicialmente fue diagnosticado erróneamente como encefalitis viral(He et al., 2013), en la que el paciente presentaba deterioro progresivo de la función cognitiva y convulsiones incontroladas sin fiebre. En nuestro caso, el aumento del recuento de leucocitos y de la proteína del LCR, junto con la fiebre y el dolor de cabeza, nos llevan a diagnosticarlo como encefalitis viral. Se ha descrito fiebre en varios pacientes con HE con y sin trastornos tiroideos (Huang et al., 2011; Lu et al., 2015). Aunque la razón de la fiebre en ÉL no está clara, Lu et al. (2015) sugirieron que puede ser un resultado directo de la inflamación combinada con la vasculitis autoinmune.
La encefalopatía de Hashimoto puede manifestarse de muchas maneras diferentes, incluidos episodios similares a accidentes cerebrovasculares, convulsiones, confusión, mioclonía, psicosis aguda, trastornos depresivos y alucinaciones, lo que hace que se confunda con otras enfermedades. Uwatoko et al. (2018) reportaron un caso de un paciente que presentó parkinsonismo y una lesión similar a un tumor revelada por resonancia magnética cerebral. Después de la biopsia, se encontró que la lesión no era un tumor, y finalmente se confirmó (Uwatoko et al., 2018). Los pacientes con HE también pueden presentar síntomas inusuales como parálisis pseudobulbar, polineuropatía sensitivomotora, síntomas catatónicos, vértigo, debilidad muscular, corea, opsoclono y cefalea tipo neuralgia del trigémino, entre otros (Beckmann et al., 2011; Salazar et al., 2012; Sharan et al., 2015; Ueno et al., 2016; Karthik et al., 2017; Emeksiz et al., 2018; Oz Tuncer et al., 2018). La demencia rápidamente progresiva, como una manifestación común de HE, hace necesario distinguir HE de otras enfermedades causadas por factores vasculares, infecciosos, metabólicos tóxicos y autoinmunes, metástasis / neoplasia, errores iatrogénicos / congénitos del metabolismo, enfermedades neurodegenerativas y enfermedades sistémicas/convulsiones (Paterson et al., 2012).
Conclusión
En conclusión, el diagnóstico de HE es bastante complejo pero valioso debido a su respuesta dramática a la terapia inmunosupresora. Cuando los médicos se enfrentan a encefalitis inexplicable, la función tiroidea y los niveles de ATA deben considerarse pruebas convencionales. Se puede excluir la HE como diagnóstico para pacientes con niveles séricos normales de ATA. Para los pacientes con niveles elevados de ATA, debe considerarse después de descartar otras posibles enfermedades.
Declaración de disponibilidad de datos
Los conjuntos de datos generados para este estudio están disponibles a petición del autor correspondiente.
Declaración de Ética
Los estudios con participantes humanos fueron revisados y aprobados por el Comité de Ética del Primer Hospital de la Universidad de Jilin, China. Los pacientes / participantes proporcionaron su consentimiento informado por escrito para participar en este estudio. Se obtuvo el consentimiento informado por escrito de la persona o personas para la publicación de cualquier imagen o dato potencialmente identificable incluido en este artículo.
Contribuciones de los autores
HM contribuyó a la concepción y diseño del manuscrito. Mi escribió el primer borrador del manuscrito. YY, XM, YX y NS escribieron secciones del manuscrito. Todos los autores contribuyeron a la revisión del manuscrito, leyeron y aprobaron la versión presentada.
Financiación
Este trabajo fue apoyado por el Programa Nacional Clave R& D de China (No. 2017YFC0110304).
Conflicto de intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un conflicto de intereses potencial.
Beckmann, Y. Y., Top, D., and Yigit, T. (2011). Presentaciones inusuales de la encefalopatía de Hashimoto: cefalea neurálgica del trigémino, desviación oblicua, hipomanía. Endocrine 40, 495-496. doi: 10.1007 / s12020-011-9506-x
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Brain, L., Jellinek, E. H., and Ball, K. (1966). Enfermedad de Hashimoto y encefalopatía. Lancet 2, 512-514.
Google Scholar
Duffey, P., Yee, S., Reid, I. N., and Bridges, L. R. (2003). Encefalopatía de Hashimoto: hallazgos postmortem después de estado epiléptico fatal. Neurology 61, 1124-1126.
Resumen de PubMed | Google Scholar
Emeksiz, S., Kutlu, N. O., Alacakir, N., and Caksen, H. (2018). Un caso de encefalopatía de Hashimoto resistente a esteroides con polineuropatía sensitivomotora. Turk. J. Pediatr. 60, 310–314. doi: 10.24953 / turkjped.2018.03.012
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Ferracci, F., Bertiato, G., and Moretto, G. (2004). La encefalopatía de Hashimoto: datos epidemiológicos y consideraciones patogenéticas. J. Neurol. Sci. 217, 165–168.
Resumen de PubMed | Google Scholar
Graus, F., Titulaer, M. J., Balu, R., Benseler, S., Bien, C. G., Cellucci, T., et al. (2016). Un enfoque clínico para el diagnóstico de la encefalitis autoinmune. Lanceta Neurológica. 15, 391–404.
Google Scholar
He, L., Li, M., Long, X. H., Li, X. P., and Peng, Y. (2013). Un caso de encefalopatía de Hashimoto mal diagnosticado como encefalitis viral. Ser. J. Caso De La República 14, 366-369.
Google Scholar
Huang, W., Xia, C., and Chatham, M. (2011). Brotes de enfermedad infecciosa o encefalopatía de Hashimoto: reporte de un caso. Incautación 20, 717-719. doi: 10.1016 / j.incautación.2011.04.011
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Karthik, M. S., Nandhini, K., Subashini, V., and Balakrishnan, R. (2017). Encefalopatía de Hashimoto que presenta Trastornos de Comportamiento Inusuales en una Adolescente. Representante del Caso Med. 2017, 3494310. doi: 10.1155/2017/3494310
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Kirshner, H. S. (2014). Encefalopatía de Hashimoto: una breve reseña. Curr. Neurol. Neurociencia. República 14:476.
Google Scholar
Lu, T., Zhou, Z., Wu, A., Qin, B., and Lu, Z. (2015). Encefalopatía febril de Hashimoto asociada a Hashitoxicosis. Acta Neurológica. Belg. 115, 811–813.
Google Scholar
Mamoudjy, N., Korff, C., Maurey, H., Blanchard, G., Steshenko, D., Loiseau-Corvez, M. N., et al. (2013). Encefalopatía de Hashimoto: identificación y desenlace a largo plazo en niños. EUR. J. Paediatr. Neurol. 17, 280–287. doi: 10.1016 / j. ejpn.2012.11.003
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Menon, V., Subramanian, K., and Thamizh, J. S. (2017). Presentaciones psiquiátricas que anuncian la encefalopatía de Hashimoto: una revisión sistemática y análisis de casos reportados en la literatura. J. Neurocirujano. Rural. Pract. 8, 261–267. doi: 10.4103 / jnrp.jnrp_440_16
Resumen de PubMed | Texto Completo de CrossRef | Google Scholar
Oz Tuncer, G., Teber, S., Kutluk, M. G., Albayrak, P., and Deda, G. (2018). Encefalopatía de Hashimoto que se presenta como parálisis pseudobulbar. Nerv de Childs. Syst. 34, 1251–1254. doi: 10.1007 / s00381-018-3720-2
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Paterson, R. W., Takada, L. T., and Geschwind, M. D. (2012). Diagnóstico y tratamiento de las demencias de progresión rápida. Neurol Clin. Pract. 2, 187–200.
Resumen de PubMed | Google Scholar
Salazar, R., Mehta, C., Zaher, N., and Miller, D. (2012). Opsoclono como manifestación de la encefalopatía de Hashimoto. J. Clin. Neurociencia. 19, 1465–1466. doi: 10.1016 / j. jocn.2012.02.012
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Sharan, A., Sengupta, S., Mukhopadhyay, S., and Ghosh, B. (2015). Encefalopatía de Hashimoto con Corea. J. Assoc. Physicians India 63, 83-84.
Resumen de PubMed | Google Scholar
Tran, M. H., Mkhikian, H., Sy, M., Perez-Alvarez, I., and Demetriou, M. (2018). Intercambio de plasma a largo plazo como terapia de mantenimiento para la encefalopatía de Hashimoto de tipo cerebeloso, un reporte de caso. Transfus. Apher. Sci. 57, 418–420. doi: 10.1016 / j.transci.2018.05.027
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Ueno, H., Nishizato, C., Shimazu, T., Watanabe, H., Mizukami, T., Kosuge, H., et al. (2016). Encefalopatía de Hashimoto con vértigo y debilidad muscular en un paciente pediátrico masculino. No Hattatsu 48, 45-47.
Resumen de PubMed | Google Scholar
Uwatoko, H., Yabe, I., Sato, S., Abe, M., Shirai, S., Takahashi, I., et al. (2018). Encefalopatía de Hashimoto que imita un tumor cerebral y sus hallazgos patológicos: un informe de caso. J. Neurol. Sci. 394, 141–143. doi: 10.1016 / j.jns.2018.09.008
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Yoneda, M. (2018). Encefalopatía de Hashimoto y Autoanticuerpos. Nervio cerebral 70, 305-314. doi: 10.11477 / mf.1416201004
Resumen de PubMed / Texto completo Cruzado / Google Scholar