Figura 4: Estructura de los ojos.Esta imagen está tomada de Chirstie (ref. 4) y se restringe el derecho de autor de acuerdo con la fuente dada (es decir, no es el propio trabajo de los autores).
Estructura del ojo: El área dentro del ojo (ver figura 4) que detecta la luz y el color se llama Retina. Los dos tipos de células de detección presentes, barras y conos, procesan la información que pasa por el Cristalino y la envían por el nervio óptico al cerebro. Las células bastón (de las cuales hay alrededor de 100 millones) detectan el grado de ligereza que entra en el ojo y su sensibilidad depende de la cantidad de rodopsina presente que a su vez se genera dentro de las células. Sin embargo, la rodopsina se destruye al blanquearse al exponerse a la luz y, por lo tanto, las células bastoncillos solo funcionan con poca luz en una iluminación elevada el nivel reducido de este pigmento fotosensible conduce a una sensibilidad muy baja. Las células cónicas (de las cuales hay alrededor de 3 millones) también son sensibles a los niveles de luz, pero mantienen su función hasta una alta iluminación a través del uso del pigmento yodopsina.La detección del color es una función de los tres tipos de células cónicas presentes en la retina: entre ellas cubren el espectro visible. Esto se debe a que cada tipo es sensible a un rango diferente de longitudes de onda con una respuesta máxima a rojo (largo), verde (medio) o azul (corto).
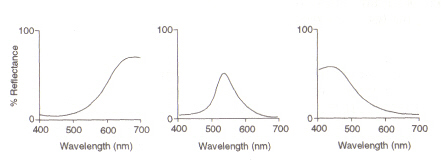
Figura 5: Máximos de células cónicas rojas, verdes y azules (de la izquierda), respectivamente. Esta imagen está tomada de Chirstie (ref. 4) y está restringido el derecho de autor de acuerdo con la fuente dada (es decir, no es obra propia de los autores).
El mecanismo de la rodopsina dentro de las células de Rodadura: La proteína Rodopsina contiene el complejo de base protonatado de Schiff-retinal, que se encuentra naturalmente en la bolsa entre membranas formada por los siete receptores helicoidales a de trans-membrana. Hay muchos discos planos de rodopsina dentro del segmento externo de la célula arod que, tras la detección de luz, experimentan un cambio foto-isomérico de rodopsina (11-cis) a retiniana totalmente trans. Después de la cascada de fotoisomerización que se produce a través de 5 intermedios de vida corta (diagrama de flujo 1), la retina trans se difunde y se convierte de nuevo en 11 cisretinas antes de volver a entrar en el ciclo. Este proceso se produce a través de la reducción de todo el retinol trans seguido de oxidación/isomerización en la oscuridad. La rodopsina fotoexcitada (4º de los 5 intermedios) desencadena un proceso enzimático en cascada que produce hidrólisis de GMP. Esto, a su vez, cierra los canales catiónicos específicos dentro de la membrana de las células bastón, que están naturalmente abiertos al influjo de Na+en la oscuridad, y debido al efecto de la hiperpolarización, el cuerpo sinático interno envía una señal nerviosa a otras neuronas de la Retina. Finalmente, la disminución de los niveles de calcio inducida por la luz ayuda a la recuperación de las neuronas excitadas a un estado pasivo, «oscuro»y el ciclo comienza de nuevo al detectar la luz. Los receptores fotoeléctricos de células cónicas también son siete receptores a-helicales con 11 cis-retinianos como cromóforo. El rango de detección varía de verde a rojo, ya que los tres residuos no polares que contienen hidroxilo nearretinianos se reemplazan secuencialmente por residuos polares.

Figura 6 izquierda: Posición de la retina 11-cis dentro de la rodopsina. Esta imagen está tomada de Stryer (ref. 6) y los derechos de autor están restringidos de acuerdo con la fuente dada (es decir, no es el trabajo propio de los autores).
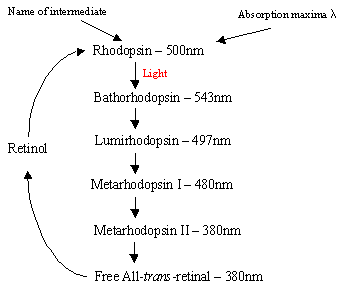
Haga Flowchart1: Los 5 intermedios del ciclo de rodopsina.
Wheredoes Rodopsina vienen?
Los seres humanos no pueden fabricar hodopsina, sino que utilizan una fuente externa, el b-caroteno, que se encuentra en los alimentos para sintetizarlo:
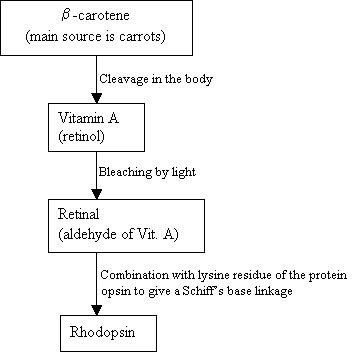 |
Diagrama de flujo 2: Síntesis de rodopsina Nueva imagen = Figura 7: Las estructuras de b-caroteno (arriba), VitaminA (en el centro) y retina 11-cis (abajo). |
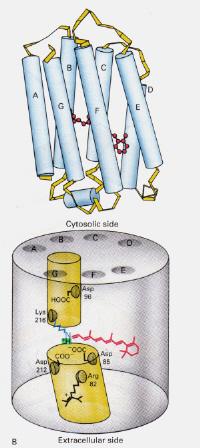
¿Cómo funciona el mecanismo de ofBacteriorhodopsin encuentra en Halobacteria diferir de la de la Rodopsina encontrado inRod las células del ojo humano?: Esta vez la retina protonada-el complejo base de Schiff bloquea naturalmente un canal a través de la membrana que de otro modo estaría formado por dos cámaras adyacentes. El complejo trans protonado dona un protón al Asp-85, que luego permite la salida de ese mismo protón al lado extracelular. La fotoisomerización a la estructura 13-cis permite que la base de Schiff recoja un protón del residuo Asp-96 en el lado citosólico. Tras la reorientación de la forma cis al trans, el ciclo de isomerización y bombeo de protones continúa.