El muestreo del seno petrosal inferior (IPSS) es un procedimiento invasivo en el que se muestrean los niveles de hormona adrenocorticotrópica (ACTH) de las venas que drenan la glándula pituitaria; estos niveles luego se comparan con los niveles de ACTH en la sangre periférica para determinar si un tumor pituitario (en lugar de una fuente ectópica de ACTH) es responsable del síndrome de Cushing dependiente de ACTH. El IPSS también se puede usar para establecer en qué lado de la glándula pituitaria se encuentra el tumor.
La enfermedad de Cushing es el resultado de una producción excesiva de cortisol debido a niveles elevados de ACTH producidos por un tumor hipofisario. Por el contrario, el síndrome de Cushing incluye todas las condiciones de hipercortisolismo debido a causas dependientes de ACTH (por ejemplo, enfermedad de Cushing o secreción ectópica de ACTH por un tumor no pituitario) o causas independientes de ACTH (por ejemplo, secreción autónoma excesiva de cortisol de un tumor adrenocortical hiperfuncionante).
Otras afecciones más raras que pueden llevar al síndrome de Cushing incluyen secreción ectópica de hormona liberadora de corticotropina (CRH), hiperplasia suprarrenal nodular pigmentada bilateral primaria, hiperplasia suprarrenal macronodular, acciones ectópicas de péptidos inhibidores gástricos y otros síndromes, como el síndrome de McCune-Albright y el síndrome de Carney. Se pueden encontrar estados pseudo-Cushing con presentaciones clínicas similares en la depresión y la dependencia al alcohol. Las características cushingoides también se pueden encontrar en la obesidad.
Diferenciar la enfermedad de Cushing dependiente de ACTH de la independiente de ACTH es a menudo sencillo, pero puede ser difícil diferenciar la enfermedad de Cushing del hipercortisolismo causado por secreción ectópica de ACTH (es decir, de una fuente no pituitaria) debido a la secreción cíclica e intermitente de los tumores secretores de ACTH y a las diferentes sensibilidades y especificidades de las diversas pruebas bioquímicas. De acuerdo con Prabhu et al (2002), el valor de las imágenes transversales en el síndrome de Cushing dependiente de ACTH también está restringido porque los pequeños incidentalomas hipofisarios no funcionales están presentes en hasta el 10% de las imágenes por resonancia magnética realizadas en personas jóvenes sanas.
La escasa sensibilidad de las imágenes para los microadenomas de la hipófisis es otro problema. Los adenomas hipofisarios secretores de ACTH son difíciles de identificar en la RMN estándar de 1,5 T o 3 T, así como con imágenes de contraste dinámico. En la mayoría de los casos, la RMN ponderada en T1 mejorada con contraste de corte delgado de rutina puede proporcionar detalles anatómicos y ayudar a identificar el patrón de drenaje IPS. En algunos casos, cuando no se puede identificar el patrón de drenaje, incluso la resolución espacial no ayuda a retratar la anatomía compleja. En tal situación, el IPSS solo ayuda a diferenciar la enfermedad de Cushing del síndrome de Cushing debido a tumores secretores de ACTH ectópicos y, por lo tanto, sigue siendo el estándar de oro para el diagnóstico de adenomas hipofisarios secretores de ACTH. Está bien establecido que el IPSS puede diagnosticar con precisión la enfermedad de Cushing y también se sabe que la RMN proporciona una mayor precisión en la localización del sitio del adenoma. Kakade et al. han sugerido que en caso de hallazgos equívocos de IRM hipofisaria, el IPSS previo puede evitar una cirugía transesfenoidal innecesaria. Un estudio informa que la resonancia magnética de 7 T puede ayudar a detectar la enfermedad de Cushing estándar de 1,5 T y 3 T con resonancia magnética negativa y puede adelantarse a la IPSS en el futuro.
Antecedentes de muestreo del seno petrosal
El IPSS fue introducido en 1977 por Corrigan et al, que relataron el uso de cateterismo selectivo unilateral y muestreo venoso para localizar la secreción de ACTH en un paciente con un cuadro clínico y de laboratorio desconcertante compatible con secreción ectópica de ACTH o síndrome de Cushing hipofisario dependiente. Más tarde, se estableció que los niveles de ACTH en el drenaje venoso pituitario pueden ser asimétricos, debido a la ubicación del adenoma corticotropo o a variaciones asimétricas en la anatomía venosa.
El drenaje venoso pituitario suele ser ipsilateral, por lo que el drenaje venoso en el lado contralateral en relación con el adenoma no suele tener una alta concentración de ACTH. Doppman et al (1984) sugirieron muestreos simultáneos de ambos senos petrosales inferiores (IPSs) para evitar resultados falsos negativos en presencia de adenoma corticotrofo hipofisario. Este procedimiento se denominó muestreo bilateral del seno petroso inferior (BIPSS).
Muchos adenomas corticotropos son susceptibles a la estimulación por HCR administrada exógenamente, como fue descrito por primera vez en 1991 por Oldfield et al para aumentar la sensibilidad del BIPSS. Se han utilizado dos formas diferentes de RHC en los diversos estudios reportados: la RHC ovina (rHOC) y la RHC humana (RHC). Nieman et al (1989) han informado que las respuestas periféricas de ACTH y cortisol a la hCRC fueron significativamente más altas que con la HCR humana.
Futuro y controversias
Algunos centros han reportado una mejor precisión y localización intraselar con el muestreo bilateral de senos cavernosos, pero hay un mayor riesgo de parálisis del nervio craneal, por lo que esta técnica aún no ha ganado popularidad.
El muestreo venoso yugular interno también se ha intentado como una alternativa técnicamente más fácil al BIPSS. Radvany et al. se compararon los VJIS con los SPI en 30 pacientes consecutivos con síndrome de Cushing dependiente de ACTH negativo en resonancia magnética. Sus resultados indican que el IJVS no es tan útil como el IPSS en el diagnóstico de la hipófisis como fuente de ACTH excesiva. Aunque el IJV tiene una especificidad similar a la del BIPSS, tiene una sensibilidad más baja (83% versus 94%), según Ilias et al.
Utilizando muestras extraídas de IPSS, Oklu et al han identificado 3 biomarcadores potenciales compuestos pequeños de la enfermedad de Cushing (piridoxato, ácido desoxicólico y adipato de trimetilo). Estos pueden dilucidar la biología del tumor y sugerir, en el futuro, posibles sondas de diagnóstico por imágenes moleculares y dianas terapéuticas en pacientes con enfermedad recidivante después de la cirugía.
Anatomía relevante
Miller y Doppman (1991) han proporcionado una descripción detallada de la anatomía de IPS (ver imagen de abajo).
 Anatomía del Seno Petrosal Inferior
Anatomía del Seno Petrosal Inferior En la mayoría de los individuos, la IPS se estrecha para convertirse en una sola vena, vaciándose en la vena yugular interna ipsilateral (VJI). En aproximadamente el 25% de los individuos, el drenaje IPS forma un plexo de canales que desembocan en el IJV. En el 0,6% -7% de los individuos, no hay conexión entre el IJV y el IPS, lo que hace imposible el muestreo estándar.
En aproximadamente el 60% de los individuos, el drenaje venoso pituitario es simétrico, con la mayor parte del efluente venoso de cada lado de la pituitaria drenando hacia el IPS ipsilateral. Como resultado, en la mayoría de las personas, el BIPSS puede ser una herramienta eficaz para lateralizar los adenomas corticotropos y evitar resultados falsos negativos.
Doppman et al (1999) atribuyeron el 0.prevalencia del 8% de resultados falsos negativos para un IPS hipoplásico o anómalo. Shiu et al (1968) describieron por primera vez un sistema de clasificación para las variantes anatómicas IPS. Bonelli et al (2000) han descrito una modificación del sistema de clasificación de Shiu et al, de la siguiente manera:
-
Tipo I( ver imagen de abajo): Un IPS anastomosándose con el IJV; la vena condilar anterior está ausente o se une al IPS en un origen definido; el segmento corto de la vena desde el punto de esta anastomosis hasta el VCI se denomina confluencia condilar inferior
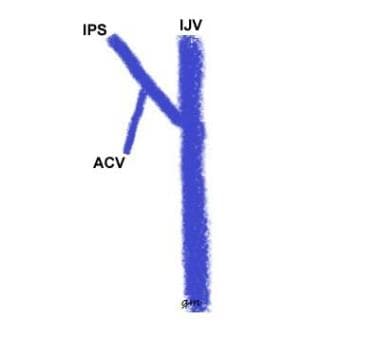 variante IPS tipo 1
variante IPS tipo 1 -
Tipo II (ver imagen de abajo): Un origen común del IPS y la vena condilar anterior con el IJV
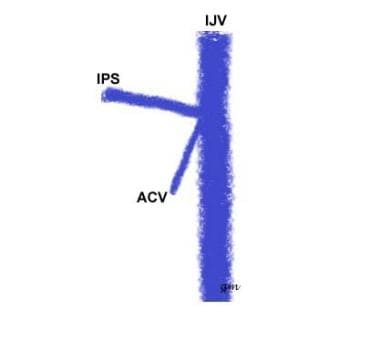 variante IPS tipo 2
variante IPS tipo 2 -
Tipo III (ver imagen de abajo): Una IPS compuesta por varios canales pequeños que se comunican con el IJV
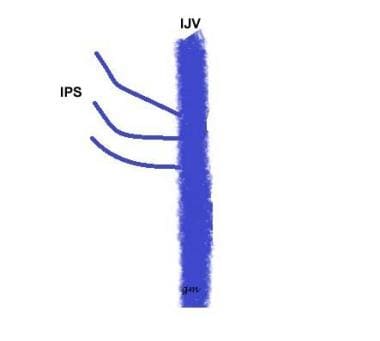 Variante IPS tipo 3
Variante IPS tipo 3 -
Tipo IV (ver imagen de abajo): Un IPS que se comunica con la vena condilar anterior y no con el IJV
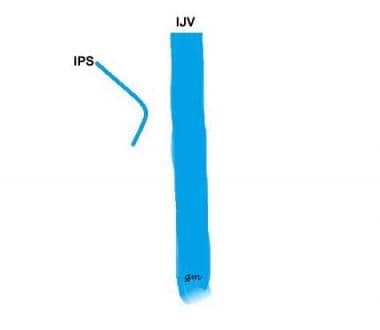 variante IPS tipo 4
variante IPS tipo 4
 variante IPS tipo 1
variante IPS tipo 1  variante IPS tipo 2
variante IPS tipo 2  Variante IPS tipo 3
Variante IPS tipo 3  variante IPS tipo 4
variante IPS tipo 4