Reacciones de apertura de anillos de epóxido-SN1 vs. SN2, regioselectividad y estereoselectividad
Las reacciones de apertura de anillos no enzimáticas de los epóxidos proporcionan una buena visión general de muchos de los conceptos que ya hemos visto en este capítulo. Las reacciones de apertura de anillo pueden proceder por mecanismos SN2 o SN1, dependiendo de la naturaleza del epóxido y de las condiciones de reacción. Si el epóxido es asimétrico, la estructura del producto variará según el mecanismo que predomine. Cuando un epóxido asimétrico sufre solvólisis en metanol básico, la apertura del anillo se produce por un mecanismo SN2, y el carbono menos sustituido es el sitio del ataque nucleofílico, lo que lleva a lo que nos referiremos como producto B:

Por el contrario, cuando se produce solvólisis en metanol ácido, la reacción se produce por un mecanismo con un carácter sustancial SN1, y el carbono más sustituido es el sitio del ataque. Como resultado, predomina el producto A.

Ambos son buenos ejemplos de reacciones regioselectivas. En una reacción regioselectiva, dos (o más) isómeros constitucionales diferentes son posibles como productos, pero uno se forma preferentemente (o a veces exclusivamente).
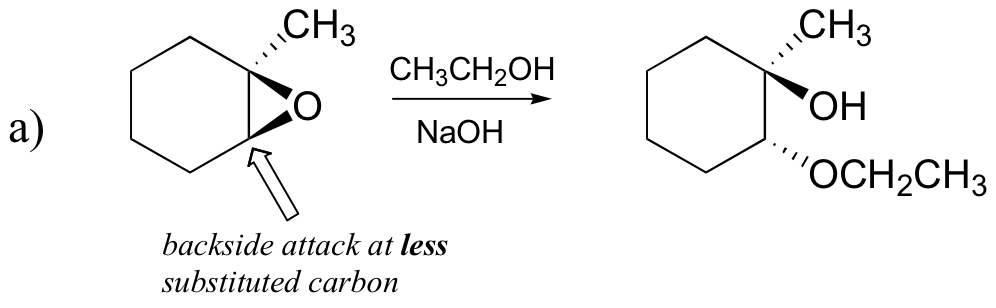
Examinemos primero el caso básico SN2. El grupo saliente es un anión alcóxido, porque no hay ácido disponible para protonar el oxígeno antes de la apertura del anillo. Un alcóxido es un grupo de salida pobre, y por lo tanto es poco probable que el anillo se abra sin un ‘empuje’ del nucleófilo.

El nucleófilo en sí es potente: un ion metóxido desprotonado y cargado negativamente. Cuando una reacción de sustitución nucleofílica implica un grupo saliente pobre y un nucleófilo poderoso, es muy probable que proceda por un mecanismo SN2.
¿y el electrófilo? Hay dos carbonos electrofílicos en el epóxido, pero el mejor blanco para el nucleófilo en una reacción SN2 es el carbono que está menos obstaculizado. Esto explica el resultado regioquímico observado. Al igual que en otras reacciones SN2, el ataque nucleofílico tiene lugar desde la parte trasera, lo que resulta en una inversión en el carbono electrofílico.
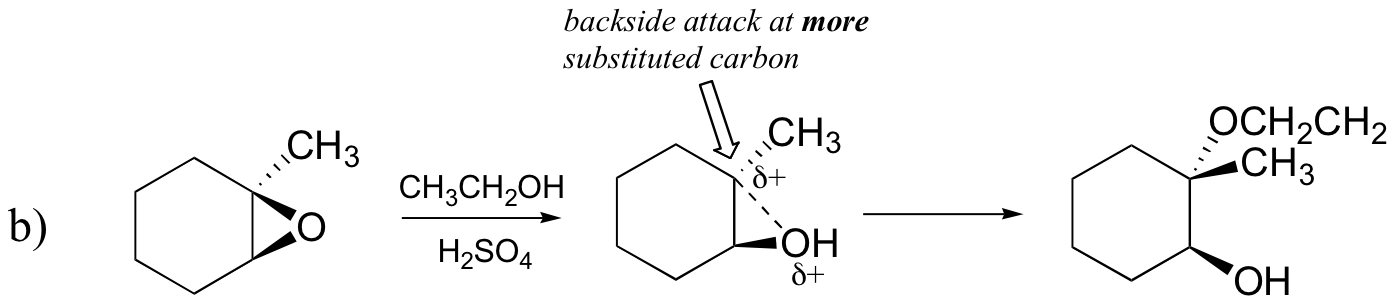
Probablemente la mejor manera de representar la reacción de apertura del anillo de epóxido catalizado por ácido es como un híbrido, o cruzamiento, entre un mecanismo SN2 y SN1. En primer lugar, el oxígeno se protona, creando un buen grupo de salida (paso 1 a continuación) . Luego, el enlace carbono-oxígeno comienza a romperse (paso 2) y la carga positiva comienza a acumularse en el carbono más sustituido (recuerde la discusión de la sección 8.4 B sobre la estabilidad del carbocatión).

A diferencia de una reacción SN1, el nucleófilo ataca el carbono electrofílico (paso 3) antes de que se forme un intermediario de carbocatión completo.

El ataque tiene lugar preferentemente desde la parte trasera (como en una reacción SN2) porque el enlace carbono-oxígeno todavía está en cierto grado en su lugar, y el oxígeno bloquea el ataque desde la parte frontal. Observe, sin embargo, cómo el resultado regioquímico es diferente de la reacción catalizada por la base: en el proceso catalizado por ácido, el nucleófilo ataca al carbono más sustituido porque es este carbono el que tiene un mayor grado de carga positiva.
Ejercicio 8.17:
Predecir el(los) producto (s) principal (es) de la reacción de apertura del anillo que ocurre cuando el epóxido que se muestra a continuación se trata con:
a) etanol y una pequeña cantidad de hidróxido de sodio
b) etanol y una pequeña cantidad de ácido sulfúrico

Sugerencia: ¡asegúrese de considerar tanto la regioquímica como la estereoquímica!
Khan academy videos

Anillo de apertura bajo condiciones ácidas: