26 de octubre de 2020, por Personal del NCI
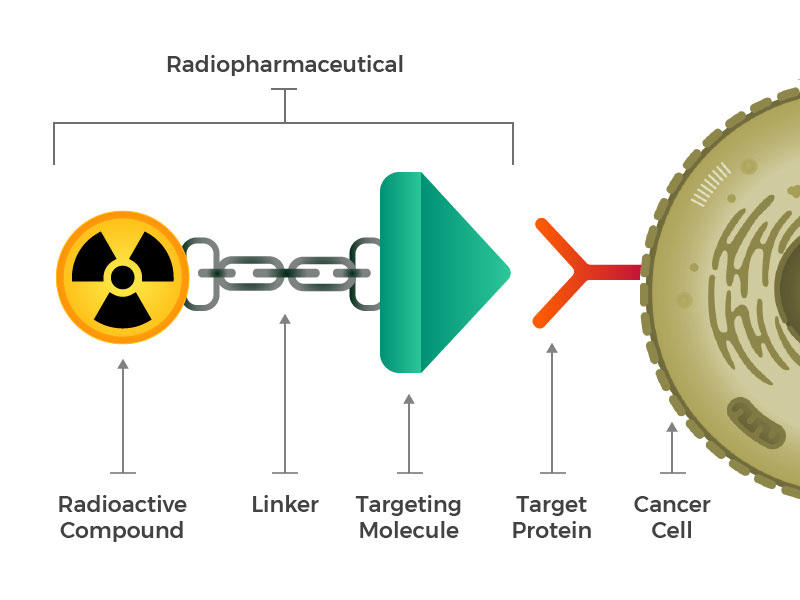
Los radiofármacos consisten en una molécula radiactiva, una molécula objetivo y un enlazador que une a los dos.Crédito
Las últimas dos décadas han traído un cambio radical en la forma en que se tratan muchos tipos de cáncer. Las terapias dirigidas bloquean proteínas específicas en las células cancerosas que las ayudan a crecer, dividirse y diseminarse. Las inmunoterapias estimulan o suprimen el sistema inmunitario del cuerpo para ayudar a combatir el cáncer. Sin embargo, los tratamientos de uso prolongado (cirugía, quimioterapia y radioterapia) siguen siendo la columna vertebral del tratamiento para la mayoría de los cánceres.
La radioterapia se utilizó por primera vez para tratar el cáncer hace más de 100 años. Aproximadamente la mitad de todos los pacientes de cáncer todavía lo reciben en algún momento durante su tratamiento. Y hasta hace poco, la mayoría de la radioterapia se administraba como hace 100 años, mediante la entrega de haces de radiación desde el exterior del cuerpo para matar los tumores dentro del cuerpo.
Aunque eficaz, la radiación externa también puede causar daños colaterales. Incluso con equipos modernos de radioterapia, «se necesita tejido normal para llegar a un tumor», dijo el doctor Charles Kunos, del Programa de Evaluación de Terapia Oncológica (CTEP, por sus siglas en inglés) del NCI. Los efectos secundarios resultantes de la radioterapia dependen del área del cuerpo tratada, pero pueden incluir pérdida del gusto, cambios en la piel, caída del cabello, diarrea y problemas sexuales.
Ahora, los investigadores están desarrollando una nueva clase de medicamentos llamados radiofármacos, que administran radioterapia directa y específicamente a las células cancerosas. En los últimos años se ha producido una explosión de investigaciones y ensayos clínicos para probar nuevos radiofármacos.
En estos estudios se indicó que la radioterapia dirigida a nivel celular tiene el potencial de reducir el riesgo de efectos secundarios a corto y largo plazo del tratamiento y, al mismo tiempo, permitir que incluso depósitos diminutos de células cancerosas se destruyan en todo el cuerpo.
«Creo que van a transformar la oncología radioterápica en los próximos 10 a 15 años», dijo el Dr. Kunos.
Construir sobre una Afinidad natural
La entrega de radiación directamente a las células no es en sí un enfoque nuevo. Una de estas terapias, llamada yodo radiactivo, se ha utilizado para tratar algunos tipos de cáncer de tiroides desde la década de 1940. El yodo se acumula naturalmente en las células tiroideas. Se puede producir una versión radiactiva del elemento en el laboratorio. Cuando se ingiere (en forma de pastilla o líquido), se acumula y destruye las células cancerosas que quedan después de la cirugía de tiroides.
Posteriormente se aprovechó una afinidad natural similar para desarrollar medicamentos para tratar el cáncer que se ha diseminado a los huesos, como el dicloruro de radio 223 (Xofigo), que se aprobó en 2013 para tratar el cáncer de próstata metastásico. Cuando las células cancerosas crecen en el hueso, hacen que el tejido óseo que invaden se descomponga. El cuerpo luego intenta reparar este daño reemplazando ese hueso, un proceso llamado recambio óseo.
El elemento radiactivo radio «se parece a una molécula de calcio, por lo que se incorpora a las áreas del cuerpo donde el recambio óseo es más alto», como las áreas donde crece el cáncer, explicó el Dr. Kunos. El radio es capaz de destruir las células cancerosas cercanas.
Todos estos compuestos radiactivos viajan a las células cancerosas sin ayuda. Los investigadores se preguntaron si sería posible diseñar nuevas moléculas radiactivas que se dirigieran específicamente a otros cánceres.
Imaginaron radiofármacos diseñados que constan de tres bloques de construcción principales: una molécula radiactiva, una molécula dirigida (que reconoce y se fija específicamente a las células cancerosas) y un enlazador que une los dos. Estos compuestos se pueden inyectar, infundir, inhalar o ingerir, y luego llegar al torrente sanguíneo.
La idea de vincular una molécula dirigida al cáncer con una molécula que mata las células cancerosas tampoco es nueva. Por ejemplo, se han aprobado varios fármacos llamados conjugados anticuerpo–fármaco, en los que un anticuerpo que se une a células cancerosas específicas está vinculado a un fármaco tóxico, para tratar el cáncer.
Pero los esfuerzos para crear tales medicamentos han tenido un éxito limitado, explicó el Dr. Kunos, porque no es suficiente que las toxinas se acerquen a una célula cancerosa. Las toxinas tienen que ser tomadas dentro y permanecer dentro de las células el tiempo suficiente para causar daño. Muchas células cancerosas tienen o desarrollan mecanismos para simplemente bombear toxinas de vuelta antes de que eso pueda suceder.
Los radiofármacos también funcionan mejor cuando los medicamentos pueden entrar en las células. Pero eso no es necesario para que sean eficaces. Una vez que un radiofármaco se ha adherido a una célula cancerosa, el compuesto radiactivo se descompone de forma natural. Esta descomposición libera energía que daña el ADN de las células cercanas. Y cuando el ADN de una célula está dañado irreparablemente, esa célula muere. Las células cancerosas son particularmente sensibles al daño del ADN inducido por la radiación.
Dependiendo del tipo de compuesto radiactivo utilizado, la energía resultante puede penetrar en la célula unida al radiofármaco, así como en unas 10 a 30 células que la rodean. Esto aumenta el número de células cancerosas que se pueden destruir con una sola molécula radiofarmacéutica.
A mediados de la década de 2010, la Administración de Alimentos y Medicamentos (FDA) había aprobado dos radiofármacos que se dirigen a moléculas de ciertas células B para tratar a algunas personas con linfoma no Hodgkin, un tipo de cáncer de la sangre. Pero estas drogas nunca fueron ampliamente adoptadas. Pocos médicos que trataban a pacientes con linfoma estaban capacitados para administrar estos tipos de compuestos radiactivos. Y los radiofármacos se enfrentaban a la competencia de fármacos no radioactivos más nuevos.
El cambio de juego para el campo llegó en 2018, dijo el doctor Jacek Capala, del Programa de Investigación de Radiación del NCI, cuando la FDA aprobó el lutecio Lu 177-dotatato (Lutatera) para el tratamiento de ciertos tumores neuroendocrinos cancerosos (TNE) que afectan el tracto digestivo.
«Esto demostró que los tumores sólidos también se pueden dirigir de esta manera», con un radiofármaco construido desde cero, dijo. En este caso, los objetivos son ciertos receptores hormonales que se encuentran en abundancia en la superficie de las células NETAS.
El lutecio Lu 177-dotatato fue mejor para desacelerar el crecimiento neto que cualquier otro fármaco probado anteriormente, explicó el doctor Aman Chauhan, de la Universidad de Kentucky, quien lidera varios ensayos clínicos nuevos del fármaco. «Este fue un gran paso adelante para nuestro campo», dijo.
Adaptación de fármacos a partir de Compuestos de diagnóstico por imágenes
Los investigadores ahora están diseñando y probando radiofármacos para una gama de cánceres tan diversos como el melanoma, el cáncer de pulmón, el cáncer colorrectal y la leucemia, dijo el Dr. Capala. Cualquier tumor que tenga una molécula objetivo en la superficie de sus células y un buen suministro de sangre, suficiente para administrar medicamentos, podría tratarse potencialmente con radiofármacos, agregó el Dr. Chauhan.
Muchos de estos fármacos más nuevos son versiones rediseñadas de compuestos existentes utilizados para la obtención de imágenes nucleares. Las pruebas de imágenes nucleares, como la tomografía por emisión de positrones (TEP), a veces utilizan compuestos débilmente radiactivos vinculados a moléculas que se unen a objetivos específicos en la superficie de las células cancerosas. Las cámaras especializadas pueden revelar incluso pequeños depósitos de células cancerosas, lo que ayuda a medir la propagación del cáncer a través del cuerpo.
Los investigadores ahora han reutilizado estas moléculas dirigidas para transportar compuestos radioactivos más potentes, o isótopos, que podrían matar células cancerosas en lugar de simplemente ayudar a visualizarlas.
El cáncer de próstata ha sido un campo de pruebas inicial para esta reutilización. Una proteína llamada PSMA se encuentra en grandes cantidades, y casi exclusivamente—en las células de la próstata. Al fusionar una molécula que se une al PSMA con un compuesto radiactivo utilizado en las imágenes por TEP, los científicos han podido visualizar pequeños depósitos de cáncer de próstata que son demasiado pequeños para ser detectados por imágenes convencionales.
Varios tratamientos radiofarmacéuticos dirigidos a la PSMA se están probando en ensayos clínicos.
La mayoría de los cánceres de próstata son muy sensibles a la radiación, y la radiación externa se usa comúnmente para tratar la enfermedad, explicó el doctor Frank Lin, del Centro de Investigación del Cáncer del NCI, quien lidera un ensayo clínico de un radiofármaco dirigido a PSMA en el Centro Clínico de los NIH.
La mayoría de los hombres que reciben radiación como tratamiento inicial no experimentarán una recurrencia del cáncer. Pero si lo hacen, a veces se disemina por todo el cuerpo, con muchos depósitos pequeños de células cancerosas en muchos órganos, explicó.
«Cuando el tumor se ha diseminado así, ya no se puede hacer radiación de haz externo, porque la radiación externa solo se puede enfocar y tratar una pequeña parte de su cuerpo a la vez», dijo la Dra. Lin.
Tener un radiofármaco dirigido al PSMA es una mejor manera de administrar radiación en estos casos, ya que se puede infundir directamente en el torrente sanguíneo y circular ampliamente, uniéndose a las células cancerosas de próstata que se han diseminado por todo el cuerpo, explicó.
Y una gran ventaja de tener moléculas de diagnóstico por imágenes y tratamiento que utilizan el mismo objetivo es que las imágenes pueden dar a los médicos una vista previa de si es probable que el tratamiento funcione, agregó el Dr. Lin.
Por ejemplo, en el ensayo del Dr. Lin, los hombres deben hacerse una TEP con la versión de diagnóstico por imágenes del compuesto antes del tratamiento. Si el compuesto de diagnóstico por imágenes llega a las células cancerosas y se detecta en la TEP, los investigadores pueden suponer que el tratamiento radiofarmacéutico correspondiente alcanzará su objetivo.
«Este desarrollo complementario de diagnósticos junto con terapias farmacológicas hace que este campo sea mucho más emocionante», dijo el Dr. Chauhan. «De esta manera podemos saber que estamos administrando la terapia directamente a las células tumorales.»
Pasar a terapias combinadas
Aunque los radiofármacos han demostrado ser prometedores en los primeros estudios, también, como es el caso de otros tipos de medicamentos contra el cáncer, es poco probable que eliminen un tumor por sí solos.
Por ejemplo, el lutecio Lu 177-dotatato duplicó con creces el número de personas a las que se les encogieron los tumores neuroendocrinos después del tratamiento, pero ese número seguía siendo modesto: alrededor del 17%, frente al 7% sin el medicamento, explicó el Dr. Chauhan.
«Todavía hay mucho margen de mejora», dijo.
El uso de radiofármacos en combinación con otras terapias puede ser una forma de impulsar esa mejoría. Algunos investigadores están probando radiofármacos combinados con sensibilizadores de radiación, fármacos que hacen que las células cancerosas sean aún más vulnerables a la radiación. Por ejemplo, el Dr. Chauhan está liderando un ensayo clínico de lutecio Lu 177-dotatato combinado con un sensibilizante a la radiación llamado triapina, que impide que las células produzcan los compuestos necesarios para reparar el ADN después del daño inducido por la radiación.
En otro ensayo, el Dr. Lin está probando el lutecio Lu 177-dotatato con un tipo de medicamento llamado inhibidor de PARP. Estos medicamentos, que ya están aprobados para tratar algunos tipos de cáncer de mama, ovario y otros, bloquean el proceso de reparación del ADN en sí. «Por lo tanto, la radiación causaría el daño al ADN, y el inhibidor de PARP evitaría que las células tumorales sanaran su ADN después de la radiación», explicó.
Otros investigadores están combinando radiofármacos con inmunoterapias para tratar de aumentar la eficacia de estos medicamentos. «Estudios recientes han demostrado que los radiofármacos pueden hacer que los tumores respondan mejor a la inmunoterapia», dijo el Dr. Capala.
Muchos tumores son tumores «fríos», explicó, ya que las células inmunitarias no los reconocen o no funcionan correctamente en el microambiente alrededor de los tumores, explicó.
Pero cuando la radiación destruye las células cancerosas, las proteínas y el ADN de esas células pueden derramarse en el torrente sanguíneo para que las células inmunitarias las vean, lo que puede permitir que las células inmunitarias reconozcan y destruyan otras células cancerosas en todo el cuerpo. La radioterapia también puede hacer que el microambiente tumoral sea más hospitalario para las células inmunitarias, agregó la Dra. Capala.
Juntos, estos efectos pueden convertir un tumor frío en un tumor» caliente»: uno que tiene una abundancia de células inmunitarias y puede responder a los medicamentos de inmunoterapia. Algunos estudios han intentado usar radiación externa para crear este tipo de respuesta.
» Pero hay datos que sugieren que funciona mejor si cada tumor, cada metástasis, se expone a la radiación. Por lo tanto, la terapia radiofarmacéutica tiene una ventaja allí, ya que una vez que está en el cuerpo, alcanza todas las metástasis», explicó el Dr. Capala.
Incluso puede tener sentido combinar radiofármacos con radiación externa, siempre que una planificación cuidadosa del tratamiento pueda garantizar una dosis de radiación general segura, agregó el Dr. Capala. «La radioterapia externa es muy buena para atacar tumores grandes, y luego se podría combinar con la terapia radiofarmacéutica para atacar metástasis», dijo.
Desafíos y advertencias
El campo de los radiofármacos todavía está en sus primeros días. Uno de los problemas que deberá superar el enfoque antes de que pueda utilizarse más ampliamente es la escasez de médicos capacitados para administrar esos medicamentos.
«El número de médicos de medicina nuclear en los Estados Unidos es pequeño», dijo el Dr. Lin, quien tiene capacitación en medicina nuclear y oncología médica. «Y creo que solo entrenamos a unas 70 u 80 personas nuevas al año.»
Hasta ahora, esta escasez de personal ha impedido que los radiofármacos alcancen su verdadero potencial como tratamiento personalizado, explicó el Dr. Capala. Ese potencial refleja el hecho de que, a diferencia de otros tipos de medicamentos contra el cáncer, los médicos pueden usar imágenes para medir exactamente la cantidad de radiofármaco que ha llegado a un tumor, casi en tiempo real, y ajustar la dosis en consecuencia.
Pero este tipo de planificación del tratamiento requiere experiencia multidisciplinaria que no está ampliamente disponible y ha dejado a las personas que usan radiofármacos más como «quimioterapia radiactiva», con una dosis única para todos, agregó. «Esto significa que muchos pacientes no están recibiendo un tratamiento óptimo», dijo el Dr. Capala.
También se necesitan estudios de seguridad a largo plazo, añadió el Dr. Chauhan. Las personas tratadas con radioterapia externa pueden experimentar algunos efectos secundarios, llamados efectos tardíos, como el desarrollo de segundos cánceres, meses o años después del tratamiento. Aunque la investigación hasta la fecha no ha mostrado una alta tasa de efectos tardíos del tratamiento radiofarmacéutico, «estos son agentes muy nuevos, y tenemos que seguir siendo cautelosos y monitorizarlos», dijo.
Suavizar colaboraciones
Debido a que estos medicamentos son relativamente nuevos, incluso con los ensayos en curso, «solo estamos arañando la superficie del desarrollo de medicamentos para radiofármacos», dijo el Dr. Chauhan.
En 2019, para impulsar aún más los ensayos de nuevos radiofármacos prometedores, el NCI lanzó la Iniciativa de Desarrollo Radiofarmacéutico (RDI, por sus siglas en inglés) para acelerar la incorporación de nuevos fármacos prometedores a las pruebas clínicas.
Una de las cosas que el NCI espera lograr con el I + D + I es organizar más ensayos utilizando combinaciones de medicamentos producidos por diferentes compañías farmacéuticas que de otra manera no podrían colaborar, explicó el Dr. Kunos, quien lidera la iniciativa. La preocupación por la propiedad intelectual y la falta de confianza pueden detener estos proyectos antes de que comiencen, explicó el Dr. Kunos.
«Este tipo de colaboraciones no necesariamente ocurrirían a menos que el NCI fuera el intermediario honesto», dijo. En este momento, solo alrededor del 2% de los ensayos de fase inicial respaldados por el NCI están probando radiofármacos, pero con la I + D + I, esto puede crecer exponencialmente en los próximos años, agregó.
«No vamos a eliminar las máquinas u otras técnicas que usamos en la radioterapia», dijo el Dr. Kunos. «Pero con su naturaleza específica, creemos que los radiofármacos van a transformar la forma en que usamos la radiación.»