Calmodulina
¡Esta es una introducción en video a la proteína de señalización de calcio, calmodulina, desde la perspectiva de un químico inorgánico!
La calmodulina, o CaM, es un polipéptido ubicuo en todas las células eucariotas. Esta proteína se conoce como calmodulina porque es una proteína modulada por calcio que desempeña un papel vital en el proceso de transducción de señales de calcio. La transducción de señales de calcio es el proceso a través del cual las interacciones entre los iones de calcio y numerosas proteínas median la comunicación entre las células. la función de la calmodulina, por lo tanto, es necesaria en todas las células eucariotas, y algunas de las tareas que ayuda a lograr son la señalización nerviosa, el movimiento del músculo esquelético y la memoria. Al detectar iones de calcio en el medio ambiente, la calmodulina se activa y posteriormente actúa como un intermediario, iniciando la unión de proteínas importantes como las quinasas, ayudando a nuestras células en la función básica y sofisticada («Calmodulina»).
El siguiente video muestra el cambio estructural que ocurre dentro de la CaM durante la unión al calcio (códigos PDB 3CLN y 1CFD).
La proteína en sí es de 148 aminoácidos de longitud con dos regiones globulares que contienen 2 motivos de manos EF cada una, que son sitios característicos de polipéptidos mediados por calcio. Cuando se activa, la calmodulina contiene 4 iones Ca2+ que cambian drásticamente la forma de la proteína. Cuando la calmodulina se une a los iones de calcio, la proteína se abre de su forma apo a su forma de halo, exponiendo una hélice alfa que se conoce como la región de enlace o atadura central. Acuñada por su flexibilidad, la región central de la correa es la ubicación de la proteína en la que las proteínas asociadas se unen y contribuyen a la cascada que es el mensaje secundario del calcio. Basándose en su estructura y su necesidad de iones de calcio para funcionar, la calmodulina debe ser capaz de seleccionar iones de calcio en el citoplasma, y las interacciones entre el ion y los ligandos en los dominios de la mano de la FE apoyan esta idea de selectividad (Bertini et. al., 635-638).
Esta imagen es una representación de cómo un motivo EF-hand se asemeja a una mano. El diagrama de cinta de la izquierda muestra uno de los cuatro motivos característicos de la mano EF hélice-giro-hélice de calmodulin. (Código AP 3CLN)
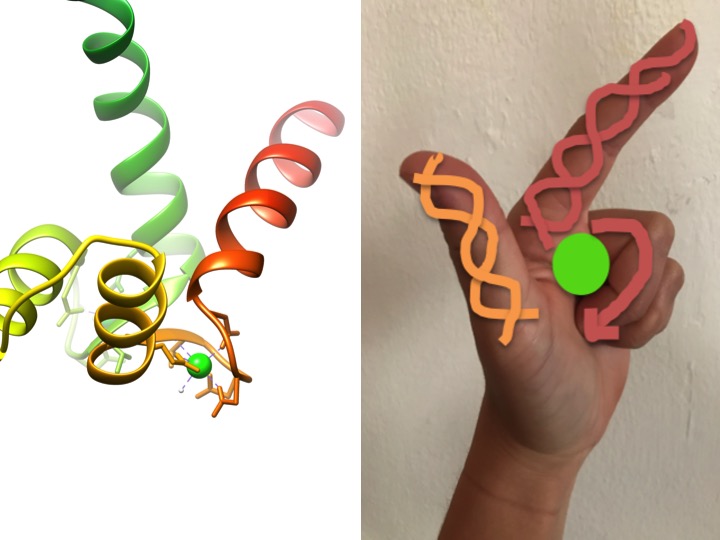
Los motivos de la mano EF son regiones estructurales altamente conservadas de proteínas involucradas en la unión del calcio. Estas regiones se conocen como motivos de» mano » porque se asemejan a una mano que está hecha en forma de L, donde el ion metálico se encuentra en el centro del puño, las hélices alfa se indican con el dedo índice que apunta hacia arriba y el pulgar que mira hacia adentro, y los dedos rizados representan la región de giro o bucle. Esto se demuestra en la figura anterior. En un motivo característico de la mano EF, los aminoácidos, incluidos los glutamatos, las asparaginas, los ácidos aspárticos y los ácidos glutámicos, se unen al Ca, así como al agua (Bertini et. al. 639). La secuencia típica de enlace de dominio EF-hand se muestra en la figura a continuación.
Esta caricatura ilustra los aminoácidos coordinados en un dominio típico de manos EF (¡La composición exacta de aminoácidos varía!). La línea discontinua representa la coordinación de Ca con el oxígeno de un carbonilo troncal, mientras que las líneas sólidas indican la coordinación con las cadenas laterales o el agua.
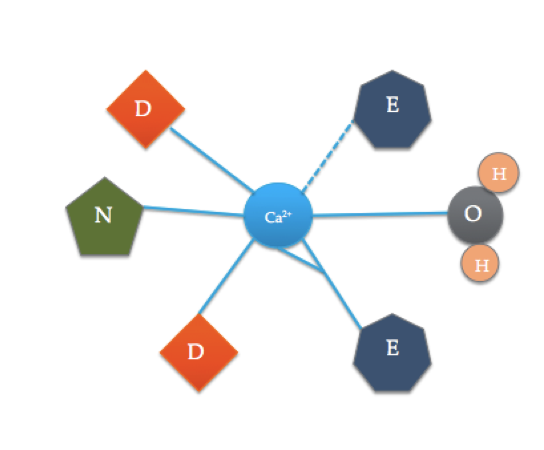
El sitio de unión de calmodulina es algo diferente del dominio de mano de FE más típico que se muestra arriba. Los 6 ligandos de calmodulina incluyen las cadenas laterales de tres ácidos asparáticos (D), 1 ácido glutámico (E) que forma dos enlaces covalentes coordinados con el ion, 1 molécula de agua de la solución y 1 molécula de carbonilo de la columna vertebral. El sitio de unión de la calmodulina consiste en un ion Ca2+ rodeado de 6 ligandos mientras forma 7 enlaces.
Uno puede notar que el motivo de FE dentro de calmodulin incluye muchos de los mismos ligandos, solo en lugares diferentes. Esta conformación puede dar una idea de por qué la calmodulina es selectiva para el calcio y cómo solo la presencia de un ion de calcio puede satisfacer el sitio de unión que hace que la proteína se active. Esto está relacionado con la termodinámica de la calmodulina dentro de la célula y cómo responde a la presencia de iones de calcio.
Para entender la termodinámica que combina la activación de la calmodulina, primero se debe entender la concentración de iones como el calcio y el magnesio dentro de una célula eucariota, incluida la de un ser humano. La concentración de estos iones debe regularse de cerca. Dentro de la célula, la señalización de calcio se acompaña de un aumento temporal en la concentración de iones de calcio, que es detectada por proteínas como la calmodulina (Bertini et. al., 636). Este aumento de calcio podría deberse a proteínas G intracelulares que inducen al retículo rugoso y liso a liberar calcio, o los iones de calcio podrían ser traídos desde el espacio extracelular. En el caso de la calmodulina, por lo general está respondiendo al calcio que se introduce en la célula desde el exterior, lo que ocurre durante procesos como la señalización nerviosa (Bertini et. al. 637). Antes de que la concentración de calcio se eleve momentáneamente, la concentración dentro de la célula suele estar entre 10-100 nm, mientras que durante la breve afluencia de iones, la concentración aumenta a 1.000-100.000 nm. El cambio en la concentración hace que la calmodulina detecte los iones de calcio, los ate e inicie una mayor transducción de señales(Bertini et. al., 635).
¿Cómo, entonces, la calmodulina se une definitivamente a los iones de calcio y no, por ejemplo, a los iones de magnesio? Los iones Mg2 + son en realidad bastante similares a los iones de calcio: se involucrarían en interacciones electrostáticas en lugar de covalentes, y se consideran átomos duros. La razón por la que la calmodulina parece favorecer a los iones de calcio en lugar de los iones de magnesio está relacionada con las constantes de unión de cada ion. La calmodulina puede existir mientras se une a otros iones, como el magnesio, pero si hay una mayor concentración de calcio, los iones de calcio competirán inmediatamente con los iones de magnesio para ocupar los sitios de unión al calcio. Esto se debe a que la constante de unión de CaM y Ca2+ (Ka) es mayor que la de CaM y Mg2+, como se muestra en la Figura 7. Esto indica que cuando se une a iones de calcio, la calmodulina produce más productos. Uno debe considerar todas estas ideas teniendo en cuenta que este proceso ocurre innumerables veces por segundo, y el recambio de esta proteína cambia para responder a la concentración de calcio siempre modulada de la célula.
¿Por qué la unión de calmodulina con iones de calcio es más favorable que con otros metales? Podría deberse al tamaño de los iones en relación con el obstáculo estérico inducido por los ligandos. El sitio de unión se caracteriza por 6 ligandos que forman 7 enlaces coordinados. Debido a que los iones de calcio son más grandes que los iones de magnesio, como se demuestra en la Figura 8, es posible que el calcio sea favorecido porque aumenta la distancia de los ligandos entre sí, disminuyendo así las interacciones estéricas entre los ligandos. La propia estructura de la proteína también podría plantear una razón para la selectividad de los iones de calcio. En general, se sabe que debido a la termodinámica basada en la concentración celular variable de iones de calcio, la calmodulina detectará el aumento de iones, los unirá y ayudará a llevar a cabo su función.
CaM + Ca2+ <
CaM + Mg2+<Mg> Mg2+CaM (KCaM-Mg)
Mg2+-CaM + Ca2+<
porque KCaM-Ca > KCaM-Mg
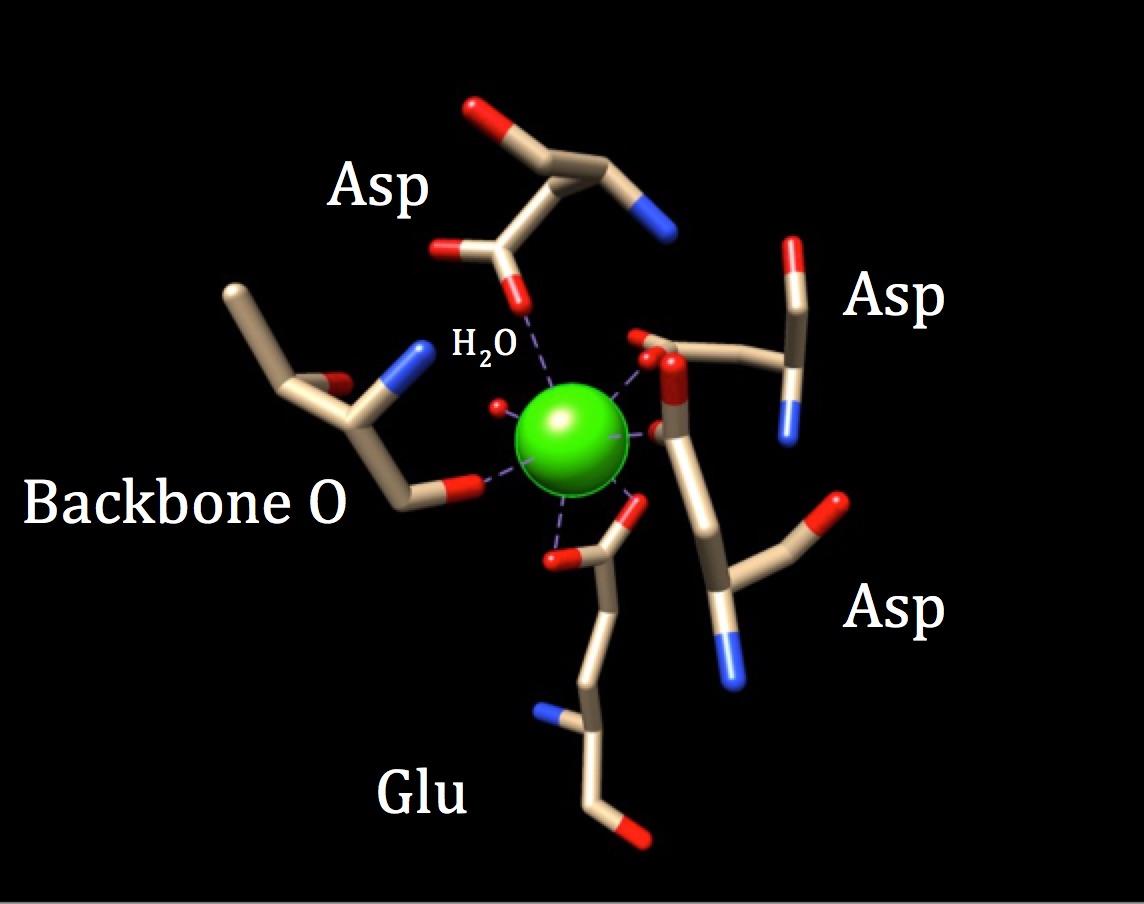
En una discusión adicional de la química del sitio de unión de calmodulina, se debe explorar la geometría de coordinación. Debido a que el ion de calcio interactúa con siete átomos donantes, el sistema se conoce como sistema heptadentado. Debido a que la calmodulina está rodeada por seis ligandos, uno asumiría una geometría de coordinación octaédrica. Pero, debido a que uno de los ligandos interactúa de manera bidentada con el ion, lo que significa que tiene dos enlaces covalentes coordinados que provienen de diferentes átomos en un aminoácido, el complejo de coordinación adquiere una forma octaédrica distorsionada. La coordinación específica se describe en el gráfico que figura a continuación.
La geometría de coordinación del sitio de unión al calcio de calmodulina. El ion metálico de calcio central está rodeado por tres asparaginas( Asp), un oxígeno troncal, un ácido gluátmico (Glu) y una molécula de agua. (Código AP 3CLN)
También podemos referirnos a la teoría del efecto quelato para comprender mejor la capacidad de la calmodulina para unirse a iones metálicos con alta afinidad. Un quelante es un átomo que es capaz de unirse a más de un átomo donante. El enlace polidentado está relacionado con el efecto quelato, que establece que cuando un ligando se une con muchos grupos de donantes (poli), los enlaces covalentes coordinados son mucho más fuertes o más apretados. Esta teoría está respaldada por la termodinámica, específicamente que la unión de polidentados aumenta la entropía de un sistema, haciéndolo más positivo (más desorden), lo que es termodinámicamente favorable. La aplicación de esta teoría a la calmodulina ayuda a explicar no solo la importancia de la unión de polidendatos dentro de los propios sitios, sino también la necesidad de que la proteína se una a 4 iones de calcio diferentes para activar su función. Al requerir esencialmente la unión de cuatro iones Ca2 + dentro de los sitios, el sistema fomenta un aumento de la entropía al introducir más sustratos/reactivos para formar un mayor número de productos. Esto ocurre debido al mayor número de enlaces dentro de las interacciones del ligando de cada sitio de enlace. En general, la unión del ion de calcio en los sitios del polipéptido está respaldada por la teoría del efecto quelato y arroja luz sobre la eficiencia de la calmodulina en la unión del calcio.
Los motivos EF-hand tienen una cierta estructura basada en el hecho de que el calcio es el metal central. Esto también se aplica a los lugares de unión a calmodulina. El ion Ca2 + se une con átomos similares en las estructuras de ciertos aminoácidos basados en una teoría llamada Teoría Ácido-Base Duro/Blando. Esta teoría separa metales y ligandos en dos categorías basadas en la polarizabilidad y su relación carga / radio. Los ácidos duros y las bases son iones más pequeños que tienen una relación carga / tamaño más grande, y esto los lleva a interactuar de manera electrostática (lo que significa atracciones entre cargas + y–), mientras que los ácidos blandos y las bases son de mayor tamaño y, por lo tanto, tienen una relación carga / radio más pequeña, lo que los lleva a formar enlaces con carácter covalente. La frase «lo similar se une con lo similar» se refiere al hecho de que los ácidos duros y las bases tienden a interactuar con otros átomos duros, y lo mismo ocurre con los ácidos blandos y las bases. El Ca2+ se caracteriza como un ácido duro porque, aunque tiene un radio grande, interactúa con los ligandos en su mayoría de forma electrostática. Al observar el sitio de unión al calcio de la calmodulina, se puede ver que el ion de calcio se une a los átomos de oxígeno de los 3 ácidos aspárticos, el ácido glutámico, el agua y el carbonilo troncal. Esta unión está en línea con «enlaces similares con similares» porque el agua y los ligandos de aminoácidos, ácido glutámico y ácido asparático, se unen a través de donantes de oxígeno que se caracterizan como bases duras. La Figura 10 revisita los sitios de unión de la calmodulina, al tiempo que muestra las cadenas laterales negativas de los aminoácidos que interactuarían con los iones de calcio indicados en azul.
Con respecto a los átomos donantes de los ligandos unidos y su capacidad de donar pares de electrones al complejo de coordinación, la serie espectroquímica explica cómo los átomos interactúan con el metal central. En el caso del sitio de unión al calcio, los oxígenos que interactúan con el ion Ca2+ se consideran donantes σ y donantes π porque los oxígenos donantes poseen 2 o más pares de electrones. Las categorías de los anillos espectroquímicos que especifican disponibilidad y donación de electrones tienen implicaciones en la designación de espín (bajo o alto), que designa cómo los electrones d llenan sus orbitales, y el tamaño delta (Δ) entre los orbitales d del metal, pero esto no hace una diferencia para el calcio porque los orbitales d del calcio están desocupados debido a la ausencia de electrones de valencia d. Esto hace que los orbitales d sean esencialmente insignificantes en la mayoría de las conversaciones sobre la proteína. Una excepción está relacionada con la consideración de la labilidad del ion de calcio en el sistema.
La falta de electrones en los orbitales d de Ca produce energía de estabilización de campo de ligando cero, y explica la alta labilidad del ion de calcio. La labilidad se refiere a la velocidad a la que los ligandos pueden ser reemplazados en complejos de coordinación, y por lo tanto describe la cinética de un sistema. Los átomos son lábiles si intercambian ligandos rápidamente. Debido a su función pertinente en todas las células eucariotas, se espera que la calmodulina se una y libere iones de calcio millones de veces por segundo para enviar y recibir mensajes de las células circundantes a través de la transferencia de iones de calcio. Cuando se trata de la capacidad de la calmodulina para unirse y liberar Ca2+ rápidamente, es importante considerar la ocupación de los orbitales de electrones d de valencia. Como se ha dicho, el calcio posee orbitales d de valencia vacíos. Estos orbitales desocupados pueden dar lugar a una explicación de la labilidad de un ion Ca2+. Debido a que todos los orbitales d del ion de calcio están vacíos, posee una energía de estabilización de campo de ligando (LFSE) de 0. Esto indica que el calcio es inestable cuando se considera LFSE debido al hecho de que las moléculas estables generalmente tienen un valor negativo para LFSE. La inestabilidad en este caso se traduce en una disposición a reaccionar rápidamente y moverse dentro y fuera de los complejos, lo que respalda la afirmación de que los iones Ca2+ fomentan reacciones rápidas y pueden caracterizarse como lábiles. Aunque esto parece ser contradictorio a la discusión que involucra el efecto quelato, se entiende que estas dos teorías no se contradicen entre sí. La estabilidad de los enlaces de coordinación apretados que sugiere el efecto quelato alienta a la calmodulina a permanecer estable el tiempo suficiente para unirse a las proteínas de los suplementos. Una vez que se completa y la concentración de calcio vuelve a la normalidad, es eficiente para eliminar el sitio de los iones de calcio.
La calmodulina, basada en su estructura y la composición de su sitio de unión vital, desempeña una parte integral de innumerables procesos llevados a cabo por las células eucariotas. A través de la aceptación y unión de iones de calcio en la transducción de señales, la calmodulina actúa como un componente fundamental del funcionamiento básico y de alto nivel en organismos como los humanos. Al aplicar la teoría bioinorgánica y comprender el entorno delicadamente monitoreado de una célula eucariótica, se puede comprender adecuadamente la capacidad de la calmodulina para seleccionar iones de calcio y fomentar un mayor funcionamiento que involucra a más de 100 proteínas asociadas.