Tratamiento con vitamina E para Pacientes con Esteatohepatitis No Alcohólica
Jhonathan Ferney Vélez M. (1), Gustavo Amador Crespo H. (1), Juan Carlos Restrepo G. MD. Esp, MSc, PhD. (2)
(1) Estudiante de Medicina en la Facultad de Medicina de la Universidad de Antioquia en Medellín, Colombia.
(2) Profesor Asociado del Departamento de Medicina Interna y del Grupo de Gastrohepatología de la Universidad de Antioquia y Hepatólogo del Hospital Pablo Tobón Uribe de Medellín, Colombia. [email protected]
Recibido: 12-02-14 Aceptado: 05-11-14
Resumen
La esteatohepatitis no alcohólica (EHNA) se caracteriza histológicamente por el inflamiento de hepatocitos, inflamación lobular y esteatosis. Si se sospecha este diagnóstico, es importante excluir otras causas de daño hepático, especialmente el consumo excesivo de alcohol. Sin embargo, hasta la fecha, la biopsia es el único método disponible para confirmar el diagnóstico. La vitamina E debe considerarse una terapia de primera línea para el tratamiento de esta enfermedad porque varios estudios clínicos han demostrado que una dosis de 800 UI/día mejora la histología de adultos no diabéticos que sufren de EHNA, incluso cuando no hay un impacto significativo en la fibrosis. Estos resultados fueron confirmados por biopsias. A pesar de los beneficios comprobados del uso de este medicamento, es importante tener en cuenta que su uso no puede reemplazar los cambios en la dieta y el ejercicio, sino que debe verse como un complemento de estas medidas.
Palabras clave
Esteatohepatitis no alcohólica, vitamina E, estrés oxidativo.
INTRODUCCIÓN
La EHNA se caracteriza histológicamente por el inflamiento de hepatocitos, inflamación lobular y esteatosis (1, 2). Actualmente, el NASH solo se puede diagnosticar a través de una biopsia hepática, que es el estándar de oro diagnóstico. También proporciona información sobre la presencia y el grado de inflamación, necrosis y fibrosis, que son importantes para establecer el pronóstico del paciente (2-5). Las diferencias entre NASH y esteatohepatitis alcohólica son microscópicamente pequeñas, lo que dificulta la diferenciación histológica entre ellas. Por esta razón, es importante obtener información del paciente sobre sus hábitos de consumo de alcohol (4).
La EHNA es parte de una entidad mucho más amplia llamada EHGNA (enfermedad hepática grasa no alcohólica) que incluye las primeras etapas de la esteatosis hepática: esteatosis sin inflamación y esteatosis con inflamación leve. En última instancia, la EHGNA se convierte en la condición inflamatoria característica de la EHNA que progresa a fibrosis y finalmente a cirrosis (1, 2, 5). Todavía no está completamente claro que los individuos progresen de la esteatosis simple al estado inflamatorio. Las interacciones entre la susceptibilidad genética, los trastornos metabólicos y el estrés oxidativo son los factores más importantes (6, 7).
La EHGNA es la enfermedad hepática más prevalente en todo el mundo (2, 4, 6). Se estima que la prevalencia de EHGNA oscila entre el 20% y el 30%, y se cree que la prevalencia de EHNA oscila entre el 2% y el 3% en la población general del mundo occidental (8).
Debido a sus cualidades antioxidantes, la vitamina E se ha recomendado en las directrices estadounidenses actuales para el tratamiento de la EHNA. «La vitamina E (α-tocoferol) administrada a dosis diarias de 800 UI / día mejora la histología hepática en adultos no diabéticos con NASH probado mediante biopsia» Esto no obsta a la importancia de la intervención en el estilo de vida y la dieta del paciente como parte del tratamiento básico para los pacientes con NASH (9, 10). En este artículo revisamos la fisiopatología de NASH con énfasis en el papel de la vitamina E en el tratamiento de pacientes con esta enfermedad.
FISIOPATOLOGÍA
Si bien la patogénesis de la EHNA aún no está completamente clara, la hipótesis mejor aceptada propuesta hasta la fecha para explicar los eventos que condujeron a la esteatosis y posteriormente a la esteatohepatitis es la teoría de «dos hits». El primer golpe en el inicio de esta enfermedad es la sobrecarga de grasa (11, 12). Un estilo de vida sedentario, los factores genéticos y el aumento de la ingesta de calorías hacen que las personas sean más susceptibles al desarrollo de resistencia a la insulina e hiperinsulinemia, lo que conduce a un aumento en la síntesis de lípidos hepáticos y la liberación de ácidos grasos libres del tejido adiposo. Si el hígado se mantiene en este estado, se vuelve incapaz de metabolizar todos los ácidos grasos que produce y que se eliminan de la circulación. Esta condición eventualmente conduce al segundo golpe que es esteatosis hepática y estrés oxidativo (4, 5, 13).
El estrés oxidativo es un desequilibrio que favorece a los prooxidantes sobre los antioxidantes (3). Durante la esteatosis hepática, los hepatocitos entran en un estado hipermetabólico que conduce a un aumento de la producción de radicales libres en los orgánulos celulares (13). El aumento de las cantidades de especies reactivas de oxígeno (ROS) en los hepatocitos conduce a la peroxidación lipídica, que es una reacción que proporciona un suministro continuo de radicales libres adicionales con efectos potencialmente devastadores (14, 15).
Un antioxidante es la vitamina E (tocoferol) que reacciona con los peróxidos lipídicos para reducirlos a ácidos grasos. Forman el tocoferoxilo radical relativamente estable que persiste el tiempo suficiente para pasar de nuevo al tocoferol por medio de una reacción con vitamina C en la superficie celular (12). Debido a esta característica, se ha considerado el uso de vitamina E como tratamiento para pacientes con EHNA (13, 16).
MANIFESTACIONES Y DIAGNÓSTICO
La EHGNA es un síndrome común que va desde la esteatosis simple hasta la esteatohepatitis (EHNA) con fibrosis y cirrosis posteriores (5). Aunque en el momento del diagnóstico la mayoría de los pacientes son asintomáticos, algunos pacientes, especialmente los niños, pueden quejarse de fatiga y malestar. La incomodidad en el cuadrante superior derecho del abdomen, la sospecha debido al aumento de los niveles de aminotransferasas y una ecografía abdominal con una enfermedad hepática brillante son signos de esta enfermedad. La obesidad, la diabetes y la dislipidemia también deben tenerse en cuenta durante la evaluación de las afecciones que podrían estar asociadas con EHGNA y EHNA (5, 17).
Durante la evaluación diagnóstica se deben excluir otras causas comunes de enfermedad hepática, pero en última instancia, la biopsia hepática es el único método disponible para confirmar el diagnóstico. También es importante para definir el pronóstico del paciente (Tabla 1) (3, 4). A pesar de su gran valor clínico, una biopsia es costosa y conduce a un ligero aumento de la morbilidad y, en raras ocasiones, resulta en mortalidad. Esta herramienta solo debe considerarse para pacientes en los que se sospecha la presencia de esteatosis hepática no alcohólica y que tienen un alto riesgo de esteatohepatitis y fibrosis avanzada (obesidad, diabetes mellitus tipo II, dislipidemia y síndrome metabólico) y en casos de diagnóstico incierto (3, 9).

PAPEL DE LA VITAMINA E EN EL TRATAMIENTO DE LA ESTEATOHEPATITIS NO ALCOHÓLICA
En LA actualidad no hay un tratamiento eficaz para la EHNA. Sin embargo, teniendo en cuenta el importante papel de la vitamina E como factor antioxidante, se han realizado varios ensayos clínicos para demostrar sus beneficios en la evolución clínica e histopatológica de esta enfermedad (Tabla 2).
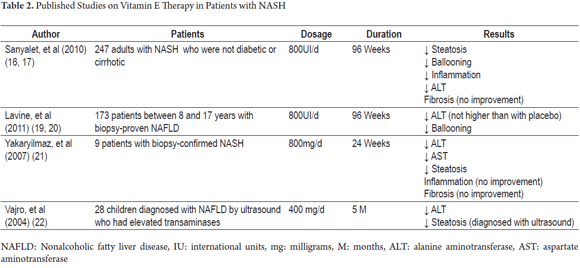
Entre ellos se encuentra el ensayo PIVENS (pioglitazona versus vitamina E versus placebo para el tratamiento de pacientes no diabéticos con esteatohepatitis no alcohólica). Este fue un estudio multicéntrico, doble ciego, controlado con placebo en el que se evaluó la mejoría histológica en 247 pacientes no diabéticos y no cirróticos que tenían EHNA. Los pacientes se asignaron al azar para recibir una dosis diaria de pioglitazona (80 pacientes), vitamina E (84 pacientes) o un placebo (83 pacientes) durante noventa y seis semanas (18). Las dosis diarias fueron de 30 mg para pioglitazona y 800 U para vitamina E. Este estudio encontró que el 43% de los pacientes que recibieron vitamina E (P = 0,001) mejoraron frente al 34% de los que recibieron pioglitazona (P = 0,04) y el 19% de los que recibieron placebos. La diferencia en las tasas de mejoría entre pioglitazona y placebos no fue estadísticamente significativa, mientras que la diferencia entre las tasas de mejoría de vitamina E y placebos sí lo fue. Sin embargo, ambos fármacos se asociaron con una mejoría de los niveles de aminotransferasas, reducción de la esteatosis y de la inflamación lobular, pero ninguno de los dos dio lugar a una mejoría de la fibrosis. El mismo estudio mostró que, después de suspender el tratamiento con vitamina E, los niveles de aminotransferasas aumentaron, lo que indica que puede ser necesaria la administración indefinida del tratamiento. Además, no se encontraron diferencias significativas entre los efectos adversos de la vitamina E y los efectos adversos de los placebos (19).
Una reevaluación del ensayo PIVENS realizada por Hoofnagle et al. se centró en la respuesta de la ALT sérica en pacientes que recibieron vitamina E o placebos y en la asociación de esta respuesta con los cambios clínicos e histológicos iniciales y las interacciones con cambios en el peso corporal. Encontraron que los cambios en la ALT eran más comunes entre aquellos que recibieron vitamina E (48%) que en aquellos que recibieron placebos (16%; p <0.001). En el grupo que recibió vitamina E, las respuestas a ALT se asociaron con una disminución de la actividad de la enfermedad del hígado graso no alcohólico (EHGNA), pero no hubo mejoría de la fibrosis después del final del tratamiento a las 96 semanas. Los niveles de ALT aumentaron en el grupo de vitamina E una vez finalizada la administración, pero no aumentaron en el grupo de placebo una vez finalizada la administración. Ambos grupos de tratamiento tenían niveles de ALT casi idénticos en la semana 120. Estos resultados son similares a los que se muestran en la cohorte completa de la publicación principal del ensayo PIVENS. Además, los resultados mostraron que la pérdida de peso (2 kg o más) también se asocia con la respuesta a la ALT, con una mejora de la EHGNA (<0,001) y una mejora de la fibrosis (p <0,02), pero la vitamina E tuvo mayores efectos en la EHGNA independientemente de los cambios en el peso corporal. Por último, cabe señalar que los efectos de la vitamina E y la pérdida de peso sobre la respuesta e histología de la ALT son independientes, lo que significa que incluso aquellos pacientes que pierden peso se beneficiarían de la terapia con vitamina E (20).
El ensayo TÓNICO (Tratamiento de la enfermedad del hígado graso no alcohólico en niños) fue otro ensayo multicéntrico, doble ciego, controlado con placebo. Se incluyeron 173 pacientes que tenían entre ocho y diecisiete años de edad. Los pacientes se asignaron al azar para recibir vitamina E (58 pacientes), metformina (57 pacientes) o placebos (58 pacientes) durante 96 semanas. Las dosis fueron de 400 UI dos veces al día para la vitamina E y de 500 mg dos veces al día para la metformina (21). Ninguno de los agentes fue superior a los placebos para lograr reducciones sostenidas de al menos el 50% en los niveles basales de ALT o niveles sostenidos de ALT de 40 U/L o menos. Las mediciones se realizaron cada 12 semanas desde la semana 48 hasta la semana 96. Este estudio también encontró que la resolución de NASH fue significativamente mayor en el grupo de pacientes tratados con vitamina E que en el grupo de placebo. Este resultado se atribuyó a la disminución significativa del globo hepatocelular que se encontró en pacientes tratados con vitamina E. Esto es similar a los resultados de PIVENS, a pesar de que el ensayo TÓNICO no consideró la disminución del globo hepatocelular como un resultado primario debido a las diferencias histopatológicas entre NALFD en pacientes pediátricos y adultos. El estudio TÓNICO no encontró mejoría en la fibrosis (22).
Antes de estos dos estudios grandes, se habían realizado otros estudios más pequeños con resultados con grandes diferencias en los resultados primarios evaluados. Además de poblaciones mucho más pequeñas, estos estudios tuvieron menos tiempo de monitoreo y algunos de ellos no se controlaron con grupos de placebo.
Un estudio de 2007 de Yakaryilmaz et al. se examinó el efecto de la vitamina E en nueve pacientes cuyos diagnósticos de EHNA se habían verificado mediante biopsia. El estudio evaluó el efecto de la vitamina E en el receptor gamma activado por proliferadores de peroxisomas (PPARG) y en la resistencia a la insulina. A los pacientes se les administró 800 mg de vitamina E al día durante 24 semanas. Antes de iniciar el tratamiento, los hígados de los pacientes se evaluaron bioquímica e histológicamente. Estas evaluaciones se repitieron una vez finalizado el tratamiento. Al final de las 24 semanas, se encontraron disminuciones estadísticamente significativas de AST, ALT y esteatosis, pero no se encontraron cambios histológicos en el nivel de inflamación y fibrosis. Ningún paciente experimentó efectos adversos con esta dosis de vitamina E (23).
Vajro, et al. (2004) realizó un estudio de un grupo de 28 niños con disfunción hepática relacionada con la obesidad. Los pacientes se dividieron en dos grupos. La edad promedio del grupo fue uno 9.88 (+/- 3.97) años, y del grupo dos, fue de 10,7 (+/- 3.45). Los pacientes fueron evaluados para determinar si había algún efecto beneficioso del tratamiento con vitamina E en la pérdida de peso, los niveles de transaminasas y la esteatosis medidos por ultrasonido. Todos los niños incluidos en este estudio tenían hipertransaminasemia crónica (niveles de AST o ALT 1,5 veces por encima del valor normal durante más de 6 meses) y signos de esteatosis en ultrasonido. El estudio tuvo un diseño ciego simple en el que los pacientes fueron aleatorizados en uno de dos grupos: Grupo 1 (placebo más dieta) y Grupo 2 (dieta con vitamina E+). Posteriormente, cada grupo se subdividió en función del cumplimiento del tratamiento por parte de los pacientes. El Grupo 1 se dividió en el Subgrupo 1A para los que cumplían con la dieta y el Subgrupo 1B para los que no lo habían hecho. El Grupo 2 se dividió en el Subgrupo 2A para aquellos que habían cumplido con la terapia con vitamina E y el Subgrupo 2B para aquellos que no habían cumplido con la terapia con vitamina E. El subgrupo 2A se dividió en el Subgrupo 2A1 para los que no cumplían con la dieta y el Subgrupo 2A2 para los que sí cumplían con la dieta. El estudio encontró que la dosis de 400 mg/día de vitamina E produjo disminuciones significativas en los valores de ALT para los pacientes del Subgrupo 2A que se acercaron a la normalización independientemente de cualquier cambio en el peso. Por otro lado, aquellos pacientes que alcanzaron altos niveles séricos de vitamina E y también perdieron peso lograron normalización de ALT y remisión de esteatosis. Además, una comparación entre el Subgrupo 1A que cumplió solo con la dieta y el Subgrupo 2A1 que cumplió solo con la terapia con vitamina E encontró que ambos grupos de pacientes tenían niveles reducidos de ALT a los dos meses de monitoreo, pero que hubo una mayor disminución en el Subgrupo 1A (cumplió solo con la dieta) que en el Subgrupo 2A1 (cumplió solo con la vitamina E) a los cinco meses de monitoreo. Todos los signos de esteatosis desaparecieron de las imágenes ecográficas en el subgrupo 2A2 que perdió peso durante el tratamiento con 400 mg de vitamina E. Estos resultados destacan la importancia de promover una alimentación saludable como una de las principales intervenciones de tratamiento para los pacientes con EHNA, pero también debemos señalar que muchos pacientes no cumplen con los regímenes dietéticos, lo que lleva al fracaso de la intervención. Esto subraya la importancia de utilizar antioxidantes como la vitamina E como una buena terapia alternativa para estos pacientes (24).
Un estudio piloto de Kugelmas, et al. (2003) evaluaron los efectos de la Etapa 1 de la dieta de la American Heart Association combinada con un aumento del ejercicio aeróbico con y sin administración diaria de vitamina E en los perfiles de citocinas (TNF alfa, IL-8, IL-6) y los niveles de enzimas hepáticas en 16 pacientes entre 18 y 65 años de edad con NASH comprobado mediante biopsia. Este fue un estudio ciego simple en el que los pacientes se asignaron al azar para recibir 800 UI de vitamina E al día. Los pacientes que no recibieron vitamina E recibieron placebos. La prueba se llevó a cabo durante un período de 12 semanas. Los valores de citoquinas no disminuyeron significativamente con la pérdida de peso con o sin administración de vitamina E durante el estudio. Los cambios en el estilo de vida se asociaron con mejoras en las enzimas hepáticas y el colesterol plasmático en pacientes con EHNA, mientras que la dosis de vitamina E utilizada en este estudio no mostró ningún beneficio adicional. Este resultado puede deberse al pequeño tamaño de la muestra, al corto tiempo de seguimiento o a la dosis de vitamina E utilizada (25, 26).
Una revisión publicada en noviembre de 2013 sobre las opciones actualmente disponibles para el tratamiento de pacientes con NASH reconoció la recomendación actual para el uso de vitamina E como terapia de primera línea en pacientes con NASH confirmado por biopsia que no son cirróticos y que no tienen diabetes, pero también destacó el hecho de que esta terapia solo ha demostrado un beneficio significativo en menos de la mitad de los pacientes. Por esta razón, la revisión concluyó que las estrategias de tratamiento futuras deben basarse en las vías patógenas de la enfermedad si se va a desarrollar un tratamiento eficaz para los pacientes con EHNA (27).
Ji H-F et al. se realizó un metanálisis para evaluar el efecto de la vitamina E en la disminución de las aminotransferasas en pacientes con EHGNA, EHNA y hepatitis C crónica (CHC). Los cuatro estudios que examinaron incluyeron pacientes con EHNA que recibieron suplementos de vitamina E. Los estudios incluyeron los ensayos TÓNICO y PIVENS. Descubrieron que la vitamina E podía optimizar los niveles de AST y ALT en estos pacientes. Sin embargo, cabe señalar que este metanálisis se vio limitado por la incapacidad de excluir los efectos de las intervenciones que implican cambios en el estilo de vida, el ejercicio y el uso de otros antioxidantes, y la incapacidad de excluir los efectos de otros factores de riesgo para la enfermedad hepática crónica, como el consumo de alcohol y drogas, además de esto, se debe tener en cuenta la heterogeneidad de los estudios, ya que limita el análisis general y tiene menos especificidad para los niveles de aminotransferasas que las biopsias tomadas en el momento del diagnóstico y la evaluación de la enfermedad hepática (28).
Aunque entre los principales estudios para evaluar el efecto del uso de vitamina E en pacientes con EHNA no hemos encontrado diferencias estadísticamente significativas con el uso de placebos y otras opciones terapéuticas a corto plazo, existe preocupación por los posibles efectos adversos del uso prolongado de vitamina E.
Una revisión sistemática de nueve ensayos aleatorizados incluyó nuevos ensayos aleatorizados controlados con placebo para evaluar los efectos de la vitamina E durante un período de al menos un año en la incidencia general de accidentes cerebrovasculares, así como subtipos de accidentes cerebrovasculares. Se encontró un aumento del riesgo de ictus hemorrágico (RR = 1,22, IC del 95%: 1,0 a 1,48, p = 0,045). Debido a los resultados obtenidos de su revisión, los investigadores recomiendan evitar el uso indiscriminado de vitamina E debido a las graves consecuencias de los accidentes cerebrovasculares hemorrágicos en la morbimortalidad (29).
En un estudio aleatorizado controlado con placebo que incluyó a 35.533 pacientes seguidos durante un mínimo de siete años, se estudiaron los riesgos de la vitamina E relacionados con el cáncer de próstata. Comparó un grupo de placebo con un grupo que recibía vitamina E en una dosis diaria de 400 UI. Hubo un aumento significativo en el riesgo de cáncer de próstata entre los que tomaron Vitamina E (HR 1.17; 99% CI, 1.004-1.360; p = 0,008). El aumento absoluto del riesgo fue de 1,6 por 1.000 personas-año (30).
Otro metanálisis ha analizado la relación dosis-respuesta de la suplementación con vitamina E y la mortalidad total en adultos. Mostró que los pacientes que recibieron dosis altas de vitamina E (mayores o iguales a 400 UI/día) tuvieron un aumento de la mortalidad por todas las causas. Este metanálisis limitó su búsqueda a ensayos controlados aleatorios cuyas muestras de pacientes consistieron en adultos que recibieron tratamiento con vitamina E sola o en combinación con otras vitaminas o minerales y que excluyeron a mujeres embarazadas y que tuvieron un mínimo de 1 año de tratamiento y monitoreo. Los resultados proporcionados por este metanálisis deben considerarse con precaución, ya que varios de los estudios tienen tamaños de muestra pequeños y se realizaron entre pacientes con varias enfermedades crónicas. Esto limita la capacidad del estudio para generalizar los resultados a la población adulta sana (31).
CONCLUSIÓN
Aunque actualmente no existe un tratamiento farmacológico eficaz para los pacientes con EHNA, la evidencia mostrada por el estudio PIVENS sugiere que la administración adecuada de vitamina E mejora la histología hepática en pacientes adultos no cirróticos con EHNA que no tienen diabetes. Sin embargo, se necesitan más estudios antes de que esta recomendación se pueda extender a los pacientes diabéticos o a los pacientes que tienen cirrosis con EHNA. Los estudios realizados en pacientes pediátricos con EHNA no han encontrado evidencia suficiente para apoyar el uso de vitamina E. Además de la administración de vitamina E, se ha demostrado que la pérdida de peso reduce la esteatosis y la inflamación hepática. En todos los pacientes se debe recomendar la pérdida de peso a través de una dieta baja en calorías combinada con un aumento de la actividad física. En cuanto a los efectos secundarios, no hemos encontrado diferencias estadísticamente significativas en el uso a corto plazo de vitamina E con placebos y otras opciones de tratamiento. Sin embargo, no se recomienda el uso indiscriminado de vitamina E durante largos períodos de tiempo, ya que hay evidencia que sugiere un mayor riesgo de cáncer de próstata, accidente cerebrovascular hemorrágico y muerte por todas las causas.
1. Abbas AK, Fausto N. Hígado, vesícula biliar y vías biliares. En: Robbins SL, Mitchell RN, Kumar V, Abbas AK, Fausto N. Patología funcional y estructural. 8va Ed. Barcelona: Elsevier; 2012. p. 645-687.
2. Brunt E, Neuschwander-Tetri B, Burt AD. Enfermedad del hígado graso: alcohólica y no alcohólica. En: Burt AD, Ferrell, L Portmann BC. La patología hepática de MacSween. 6ª edición. Reino Unido: Elservier; 2012. p. 293-359.
3. Corrado RL, Torres DM, Harrison SA. Revisión de las Opciones de Tratamiento para la Enfermedad del Hígado Graso No Alcohólico. Med Clin N Am 2014; 98: 55-72.
4. Koek GH, Liedorp PR, Bast A. El papel del estrés oxidativo en la esteatohepatitis no alcohólica. Clinica Chimica Acta 2011; 412: 1297-1305.
5. Cortez-Pinto H, Ermelinda Camilo M. Enfermedad hepática grasa no alcohólica / esteatohepatitis no alcohólica (EHGNA/EHNA): diagnóstico y evolución clínica. Best Practice & Research Clinical Gastroenterology 2004; 18 (6): 1089-104.
6. Mishra A, Younossi ZM. Epidemiología e Historia Natural de la Enfermedad del Hígado Graso No Alcohólico. Journal of Clinical and Experimental Hepatology 2012; 2 (2): 135-44.
7. Rolo AP, Teodoro JS, Palmeira CM. Papel del estrés oxidativo en la patogénesis de la esteatohepatitis no alcohólica. Gratis Radic Biol Med 2012; 52 (1): 59-69.
8. Machado MV, Cortez-Pinto H. Diagnóstico no invasivo de la enfermedad del hígado graso no alcohólico. Una valoración crítica. Journal of Hepatology 2013; 58 (5): 1007-19.
9. Chalasani N, et al. El Diagnóstico y Manejo de la Enfermedad del Hígado Graso No Alcohólico: Guía de Práctica de la Asociación Americana para el Estudio de Enfermedades Hepáticas, el Colegio Americano de Gastroenterología y la Asociación Americana de Gastroenterología. Hepatología 2012; 55.
10. Mazzella N, Ricciardi LR, Mazzotti A, Marchesini G. El papel de los Medicamentos para el Manejo de Pacientes con EHGNA. Clin Liver Dis 2014; 18: 73-89.
11. Chunga MY, Yeunga SF, Parka HJ, Volekb JS, Brunoa RS. La suplementación dietética con α y γ – tocoferol atenúa el estrés oxidativo inducido por lipopolisacáridos y las respuestas relacionadas con la inflamación en un modelo de ratón obeso de esteatohepatitis no alcohólica. Journal of Nutritional Biochemistry 2010; 21: 1200-1206.
12. Día CP, James DE. Esteatohepatitis: ¿Una historia de dos hits? Gastroenterology 1998; 114: 842-4.
13. Harper HA, Murray RK, Rodwell VW, Bender DA. Bioquímica ilustrada, 28 ed. México: McGraw-Hill Interamericana; 2010. p. 484-485.
14. Neuschwander-Tetri BA. Lipotoxicidad hepática y patogénesis de la esteatohepatitis no alcohólica: el papel central de los metabolitos de ácidos grasos no triglicéridos. Hepatology 2010; 52 (2): 774-88.
15. Le T, Loomba R. Manejo de la Enfermedad Hepática Grasa No alcohólica y Esteatohepatitis. Journal of Clinical and Experimental Hepatology 2012; 2: 156-173.
16. Verdam FJ, Dallinga JW, Driessen, de Jonge C, Moonen E, van Berkel J, Luijk J, Bouvy ND, Buurman AW, Rensen SS, Greve JW. Esteatohepatitis no alcohólica: Diagnóstico no invasivo mediante análisis de la respiración exhalada. Journal of Hepatology 2013; 58: 543-548.
17. Palmentieri B, de Sio I, La Mura V, et al. El papel del patrón de eco hepático brillante en el examen ecográfico B-mod en el diagnóstico de esteatosis hepática. Dig Liver Dis 2006; 38: 485-9.
18. Sanyal AJ, et al. Pioglitazona versus vitamina E versus placebo para el tratamiento de pacientes no diabéticos con esteatohepatitis no alcohólica: diseño del ensayo PIVENS. Contemp Clin Trials 2009; 30 (1): 88-96.
19. Sanyal AJ, Chalasani N, Kowdley KV, McCullough A, Diehl AM, Bass NM, et al. Pioglitazona, vitamina E o placebo para la esteatohepatitis no alcohólica. N Engl J Med 2010; 362( 18): 1675-85.
20. Hoofnagle JH, Van Natta ML, Kleiner DE, Clark JM, Kowdley KV, Loomba R, et al. Vitamina E y cambios en los niveles séricos de alanina aminotransferasa en pacientes con esteatohepatitis no alcohólica. Aliment Pharmacol Ther 2013; 38 (2): 134-43.
21. Lavine JE, Schwimmer JB, Molleston JP, Scheimann AO, Murray KF, Abrams SH, et al. Tratamiento de la enfermedad hepática grasa no alcohólica en niños: diseño de ensayos tónicos. Contemp Clin Trials 2010; 31 (1): 62-70.
22. Lavine JE, Schwimmer JB, Van Natta ML, et al. Efecto de la vitamina e o metformina para el tratamiento de la enfermedad del hígado graso no alcohólico en niños y adolescentes: The tonic randomized controlled trial. JAMA 2011; 305( 16): 1659-68.
23. Yakaryilmaz F, Guliter S, Savas B, Erdem O, Ersoy R, Erden E, et al. Efectos del tratamiento con vitamina E sobre la expresión del receptor alfa activado por proliferadores de peroxisomas y la resistencia a la insulina en pacientes con esteatohepatitis no alcohólica: resultados de un estudio piloto. Intern Med J 2007; 37 (4): 229-35.
24. Vajro P, Mandato C, Franzese A, Ciccimarra E, Lucariello S, Savoia M, et al. Tratamiento con vitamina E en enfermedades hepáticas relacionadas con la obesidad infantil: un estudio aleatorizado. J Pediatr Gastroenterol Nutr 2004; 38(1): 48-55
25. Papastergiou V, et al. Nueve modelos de puntuación para mortalidad a corto plazo en hepatitis alcohólica: validación cruzada en una cohorte comprobada con biopsia. Aliment Pharmacol Ther 2014; 39: 721-732.
26. Kugelmas M, Hill DB, Vivian B, Marsano L, McClain CJ. Cytokines and NASH: A pilot study of the effects of lifestyle modification and vitamin E. Hepatology 2003; 38(2): 413-9.
27. Younossi ZM, Reyes MJ, Mishra MA, Mehta R, Henry L. Revisión sistemática con metanálisis: esteatohepatitis no alcohólica-un caso para tratamiento personalizado basado en dianas patógenas. Aliment Pharmacol Ther2014; 39: 3-14.
28. Ji HF, et al. Efecto de la suplementación con vitamina E sobre los niveles de aminotransferasas en pacientes con EHGNA, EHNA y HCC: Resultados de un metanálisis. Nutrición 2014; 1-6.
29. Markus S, Robert JG, Pamela MR, Christophe T, Tobias K. Effects of vitamin E on stroke subtipos: meta-análisis de ensayos controlados aleatorios. BMJ 2010; 341.
30. Klein EA, Thompson IM, Tangen CM, et al. Vitamina e y el riesgo de cáncer de próstata: El ensayo de prevención del cáncer con selenio y vitamina e (select). JAMA 2011; 306( 14): 1549-56.
31. Miller ER, 3rd, Pastor-Barriuso R, Dalal D, Riemersma RA, Appel LJ, Guallar E. Metanálisis: la suplementación con vitamina E en dosis altas puede aumentar la mortalidad por cualquier causa. Ann Intern Med 2005; 142 (1): 37-46.