L’hypersensibilité dentinaire est l’une des plaintes les plus courantes des patients entendues dans la pratique dentaire.1 Touchant jusqu’à 57% des patients, il semble culminer entre 20 et 40 ans.2 La prévalence de l’hypersensibilité est légèrement plus élevée chez les femmes3, les canines et les prémolaires des deux arcs étant les plus fréquemment impliquées.4 La douleur est souvent chronique et marquée par des épisodes aigus.5
Selon Holland et al.6, l’hypersensibilité dentinaire est définie comme une « douleur courte et aiguë résultant de la dentine exposée en réponse à des stimuli, qui sont généralement thermiques, évaporatifs, tactiles et osmotiques ou chimiques qui ne peuvent généralement être attribués à aucune autre forme, défaut dentaire ou pathologie. »Habituellement, la douleur est localisée et de courte durée. Cela diffère de la douleur pulpaire, qui est prolongée, terne, douloureuse, mal localisée et dure plus longtemps que le stimulus appliqué.
La détresse causée par une hypersensibilité peut aller de mineure à sévère. Les patients présentant une hypersensibilité sévère peuvent avoir des difficultés à manger et à boire, en particulier lorsqu’ils consomment des substances chaudes ou froides. La douleur ressentie par les personnes sensibles est cependant très subjective et son intensité est de nature épisodique. Malheureusement, les patients sont rarement capables d’isoler la dent concernée.7 Afin d’isoler les causes de la sensibilité, les cliniciens comptent généralement sur l’exposition de la dent suspectée à un souffle d’air ou à un liquide chaud ou froid pour susciter une réponse. L’utilisation d’un barrage en caoutchouc pour isoler la dent peut être utile dans ce processus.
THÉORIE HYDRODYNAMIQUE
La théorie hydrodynamique est la cause la plus communément admise d’hypersensibilité dentinaire. Kramer8 et Brännström9 ont confirmé et développé cette théorie qui établit une relation entre la pression appliquée, les explosions d’air et les stimuli chimiques aux déplacements du liquide dentinaire qui se produisent en réponse à ces stimuli.7 Dans la recherche originale, Brännström a broyé à travers l’émail dans la dentine médiane des prémolaires chez des enfants dont les dents allaient être extraites à des fins orthodontiques. Les tubules de dentine en coupe transversale des enfants ont été exposés à la salive pendant une semaine, ce qui a entraîné une sensibilité accrue. Initialement, une couche de frottis recouvrait ces dents, mais, à la fin de la semaine, elle avait disparu, rendant ainsi la dentine de plus en plus hyperconductrice.9 La perméabilité de la dentine varie et peut rapidement diminuer.10
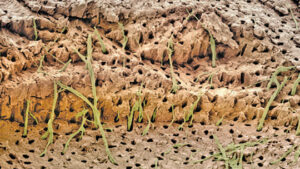
Les preuves à l’appui de la théorie hydrodynamique sont basées sur des études in vivo chez des sujets humains et animaux. La distribution des nerfs dans les tubules dentinaires varie, environ 40% se produisant sur les cornes pulpaires et un pourcentage moindre situé dans la dentine cervicale. Il semble que des tubules dentinaires ouverts soient nécessaires pour que la dentine exposée devienne sensible (figure 1, page 18); en fait, la sensibilité d’un patient augmentera proportionnellement au nombre de grands tubules ouverts présents. Les tubules ouverts présentent une conductance hydraulique élevée; inversement, le débit de fluide diminue si les tubules sont bloqués. Cela fournit un moyen pour diverses options de traitement. Magloire et al11 affirment que les stimuli externes entraînent un mouvement du liquide dentinaire, et que les odontoblastes et / ou la réaction du complexe nerveux peuvent être un système mécanosensoriel distinctif — fournissant un nouveau rôle aux odontoblastes en tant que cellules capteurs. Le transfert d’informations entre les odontoblastes et les axones peut être le résultat de médiateurs dans l’espace entre les odontoblastes et les axones, comme en témoignent les récepteurs à transduction nucoceptive et les fibres afférentes du trijumeau, et l’expression d’effecteurs réputés par les odontoblastes (Figure 2).11
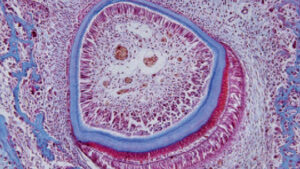
qui déposent la dentine (fine couche bleue), qui constitue la majeure partie de la dent. L’émail (couche bleue plus épaisse) est formé d’améloblastes, une couche de cellules allongées autour de l’extérieur de l’émail.
CAUSES POSSIBLES
Une maladie parodontale, une récession gingivale, des dents fissurées, une érosion, une abrasion, une abfraction et une fracture dentaire peuvent provoquer une hypersensibilité. Toutes ces conditions entraînent une dentine exposée, ce qui crée un environnement dans lequel les stimuli provoquent un mouvement du liquide tubulaire dentinaire qui active les fibres nerveuses, provoquant de la douleur. La dentine exposée peut résulter de l’ablation du cément cervical lors du détartrage et du rabotage des racines, de la finition et du polissage des restaurations ou d’un brossage extrême des dents — en particulier après l’ingestion d’aliments ou de boissons acides. La régurgitation par les patients boulimiques entraîne une exposition à l’acide et un brossage ultérieur peut entraîner une perte de la structure dentaire.1 La douleur peut être localisée ou de nature générale et peut affecter une variété de surfaces dentaires, ensemble ou individuellement.12
Comme indiqué, les patients atteints de maladie parodontale sont sujets à une hypersensibilité dentinaire.13 Études montrent que l’incidence de l’hypersensibilité augmente une semaine après la chirurgie parodontale et disparaît de huit semaines.14,15 Patients plus jeunes démontrent une sensibilité plus élevée que les adultes plus âgés, chez qui la sensibilité prend plus de temps à se résorber. Le détartrage et le rabotage des racines peuvent également provoquer une sensibilité pendant plusieurs jours après le traitement.
La récession gingivale entraîne une exposition des surfaces racinaires et une sensibilité possible. L’os buccal fournit la majeure partie de l’approvisionnement en sang de la gencive buccale, et toute perte d’os buccal entraînera une diminution de la gencive.14 L’os mince ou fenestré, l’anatomie de la dent, la position de la dent ou le mouvement orthodontique peuvent entraîner une récession. Un brossage excessif des dents avec du dentifrice peut également provoquer une récession.15 Les signes et symptômes des dents fissurées peuvent varier en fonction de la gravité. Les patients éprouvent généralement une douleur aiguë avec mastication, mais, lors de l’élimination du stimulus, la douleur disparaît. Si la douleur s’étend à la pulpe ou au ligament parodontal, elle persistera.16
L’érosion est définie comme une perte d’émail par dissolution chimique par des acides qui ne sont pas d’origine bactérienne. Il existe trois types d’érosion : extrinsèque (par exemple, alimentation, mode de vie ou environnement), intrinsèque (par exemple, acide gastrique) et idiopathique.17 L’acide syndiqué se diffuse dans les zones interprismatiques de l’émail et dissout le minéral dans la zone souterraine.18 Au stade initial, la surface de la dent est terne en raison de la déminéralisation, mais la dent n’est pas hypersensible car la dentine à tubules ouverts n’est pas exposée. Le composite peut être utilisé pour sceller l’émail afin de restaurer le contour normal et d’éviter l’exposition à la dentine.19 La restauration de la dent améliorera l’hygiène buccale et réduira l’atteinte pulpaire possible, l’abrasion de la brosse à dents / dentifrice et l’érosion acide.20
L’abrasion est la perte de la structure de la dent par les forces mécaniques d’un élément étranger, et elle peut provoquer une sensibilité.21 L’attrition est un contact dent-à-dent, qui résulte d’une fonction occlusale ou d’une parafonction — comme le bruxisme — et peut entraîner une perte de structure dentaire sur les surfaces occlusales et les bords incisifs.22
Le rôle de l’abfraction dans l’étiologie de l’hypersensibilité dentinaire est controversé. L’abfraction peut se produire lorsque la charge dentaire cyclique et non axiale disproportionnée entraîne une flexion de la cuspide et une concentration des contraintes dans la région cervicale sensible des dents. Ces lésions cervicales, provoquées par des contraintes occlusales, entraînent un affaiblissement de la structure de la dent cervicale et peuvent entraîner l’éclatement de l’émail, du cément ou de la dentine de l’aspect cervical.23 Lee et Eakle24 ont d’abord décrit des lésions pouvant résulter de contraintes de traction. Ils ont établi qu’une lésion par abfraction est souvent située au point d’appui ou près de celui-ci dans la zone où la contrainte de traction est la plus forte; elle est généralement en forme de coin et présente une taille proportionnelle au degré et à l’incidence de la force de traction appliquée.
D’autres, cependant, soutiennent qu’il existe peu de preuves soutenant l’abfraction comme cause principale de ce qu’on appelle maintenant des lésions cervicales non variées. Les processus non différents qui entraînent la perte de tissu dur au niveau de la région cervicale semblent multifactoriels et peuvent inclure l’abrasion, les défis acides et éventuellement l’abfraction.23 Bien que les données disponibles suggèrent que ces lésions peuvent se développer à partir de forces, y compris des forces occlusales, agissant seules ou en combinaison, 23 des études supplémentaires sont justifiées pour déterminer le rôle exact de l’abfraction dans les lésions non diverses et toute sensibilité connexe.
En plus de ces sources, le blanchiment des dents provoque souvent une hypersensibilité dentinaire. L’utilisation de peroxyde d’hydrogène ou de peroxyde de carbamide peut s’infiltrer à travers l’émail et la dentine dans la pulpe. La glutathion peroxydase et la catalase dans la pulpe n’ont pas assez de temps pour inactiver le peroxyde d’hydrogène, ce qui peut provoquer une sensibilité. Il convient également de noter que tous les gels de blanchiment sont hypertoniques et aspirent osmotiquement l’eau de la pulpe à travers la dentine et l’émail vers l’agent de blanchiment. Cela peut potentiellement stimuler les nerfs intradentaires.25
OPTIONS DE TRAITEMENT
Les cliniciens peuvent recommander une variété de traitements à usage domestique ou au bureau (voir le tableau 1 pour l’organigramme des options de traitement).26 Le mécanisme d’action est généralement la désensibilisation nerveuse, la précipitation des protéines, le colmatage des tubules dentinaires, le scellement de la dentine ou l’ablation de la dentine au laser. Les thérapies les plus couramment utilisées comprennent les agents anti-inflammatoires, les précipitants protéiques, les agents d’occlusion des tubules et les produits d’étanchéité des tubules. L’approche la plus conservatrice devrait être mise en œuvre au départ, avec des traitements plus agressifs suggérés si le soulagement n’est pas atteint.27
TABLEAU 1. Stratégies pour le traitement de l’hypersensibilité Dentinaire26 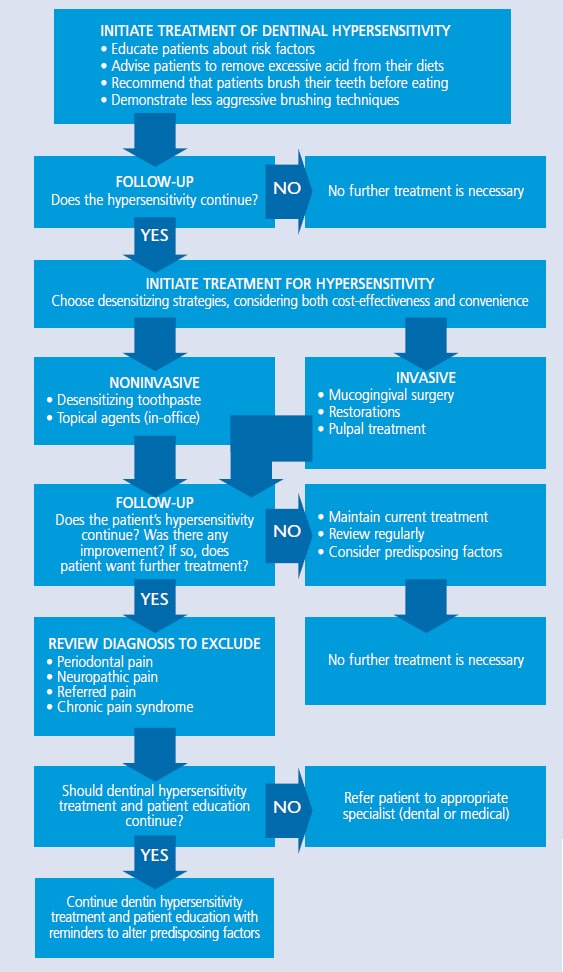 Comme première ligne de défense contre la sensibilité, les cliniciens peuvent recommander un dentifrice contenant des sels de potassium (par exemple, du nitrate de potassium, du chlorure de potassium ou du citrate de potassium), des sels de strontium (par exemple, du chlorure de strontium ou de l’acétate de strontium) ou du fluorure. Les ions potassium diffusent le long des tubules dentinaires, ce qui bloque l’action nerveuse et atténue la douleur associée à l’hypersensibilité. Les dentifrices au sel de potassium sont efficaces, mais peuvent nécessiter deux semaines d’utilisation constante pour que les patients en ressentent les effets.28 Par comparaison, la méthode d’action trouvée dans les dentifrices au sel de strontium ou le fluorure est l’occlusion des tubules. Le fluorure sous diverses formes est une stratégie efficace pour soulager la sensibilité à domicile. Le fluorure de sodium, le fluorure stanneux et le monofluorophsophate de sodium bloquent tous les tubules dentinaires, réduisant la sensibilité. Les dentifrices au fluorure sur ordonnance et l’application sur plateau peuvent également être utiles.29les technologies du phosphate de calcium sont une autre option pour traiter l’hypersensibilité. Le phosphate de calcium amorphe rend les ions calcium et phosphate disponibles dans la salive pour accélérer la reminéralisation et peut aider à minimiser la sensibilité induite par le blanchiment. Il est disponible en gel et en produits blanchissants.29 En outre, des produits contenant du phosphate de calcium amorphe phosphopeptidique de caséine (CPP-ACP) peuvent être utilisés pour occlusionner partiellement les tubules dentinaires. Bien que le prétraitement avec un agent désensibilisant interfère parfois avec la liaison réparatrice, une étude de Borges et al30 a révélé que la pâte avec CPP-ACP n’affectait pas négativement la force de liaison et, dans certains cas, l’améliorait. Le phosphosilicate de calcium et de sodium peut également aider à l’infiltration et à la reminéralisation des tubules. La silice présente dans le matériau sert de position de nucléation pour la précipitation du calcium et du phosphate.31 Le phosphate tricalcique (TCP) est l’ajout le plus récent à la famille des technologies de phosphate de calcium. Fournissant une libération lente de calcium à la surface de la dent, TCP est conçu pour stimuler les effets reminéralisants du fluorure, ce qui peut également diminuer la sensibilité. Il est disponible en vernis dentifrice et fluorure sur ordonnance.32
Comme première ligne de défense contre la sensibilité, les cliniciens peuvent recommander un dentifrice contenant des sels de potassium (par exemple, du nitrate de potassium, du chlorure de potassium ou du citrate de potassium), des sels de strontium (par exemple, du chlorure de strontium ou de l’acétate de strontium) ou du fluorure. Les ions potassium diffusent le long des tubules dentinaires, ce qui bloque l’action nerveuse et atténue la douleur associée à l’hypersensibilité. Les dentifrices au sel de potassium sont efficaces, mais peuvent nécessiter deux semaines d’utilisation constante pour que les patients en ressentent les effets.28 Par comparaison, la méthode d’action trouvée dans les dentifrices au sel de strontium ou le fluorure est l’occlusion des tubules. Le fluorure sous diverses formes est une stratégie efficace pour soulager la sensibilité à domicile. Le fluorure de sodium, le fluorure stanneux et le monofluorophsophate de sodium bloquent tous les tubules dentinaires, réduisant la sensibilité. Les dentifrices au fluorure sur ordonnance et l’application sur plateau peuvent également être utiles.29les technologies du phosphate de calcium sont une autre option pour traiter l’hypersensibilité. Le phosphate de calcium amorphe rend les ions calcium et phosphate disponibles dans la salive pour accélérer la reminéralisation et peut aider à minimiser la sensibilité induite par le blanchiment. Il est disponible en gel et en produits blanchissants.29 En outre, des produits contenant du phosphate de calcium amorphe phosphopeptidique de caséine (CPP-ACP) peuvent être utilisés pour occlusionner partiellement les tubules dentinaires. Bien que le prétraitement avec un agent désensibilisant interfère parfois avec la liaison réparatrice, une étude de Borges et al30 a révélé que la pâte avec CPP-ACP n’affectait pas négativement la force de liaison et, dans certains cas, l’améliorait. Le phosphosilicate de calcium et de sodium peut également aider à l’infiltration et à la reminéralisation des tubules. La silice présente dans le matériau sert de position de nucléation pour la précipitation du calcium et du phosphate.31 Le phosphate tricalcique (TCP) est l’ajout le plus récent à la famille des technologies de phosphate de calcium. Fournissant une libération lente de calcium à la surface de la dent, TCP est conçu pour stimuler les effets reminéralisants du fluorure, ce qui peut également diminuer la sensibilité. Il est disponible en vernis dentifrice et fluorure sur ordonnance.32
APPLICATION EN CABINET
Des thérapies simples en cabinet peuvent être utiles pour traiter la sensibilité. Les cliniciens peuvent appliquer une pâte prophylactique désensibilisante formulée avec 8% d’arginine et de carbonate de calcium pour obstruer les tubules avec des bouchons d’arginine, de calcium, de phosphate et de carbonate. Il a été démontré qu’il supporte une pression pulpaire normale et des problèmes acides, minimisant avec succès l’écoulement du fluide du tubule dentinaire et, par conséquent, la sensibilité,33 sans nuire à la force de liaison.34
Le vernis au fluorure permet la libération lente et continue du fluorure. Les vernis constituent un véhicule naturel à base de résine pour le fluorure. Le fluorure de calcium se dépose à la surface de la dent, entraînant la formation de fluorapatite. L’ajout d’oxalate de potassium provoque la formation d’oxalate de calcium résistant aux acides après réaction avec le calcium de la dentine.35 Le vernis à contact prolongé est un vernis au fluorure photodurci qui peut être utilisé pour diminuer l’hypersensibilité dentinaire. Il se compose d’un ionomère de verre modifié par résine qui incorpore du glycérophosphate avec libération de fluorure. Il favorise également la formation d’étiquettes de résine, permettant une occlusion instantanée et à long terme des tubules. Un autre produit de vernis combine 5% de glutaraldéhyde et 35% d’hydroxyéthylméthacrylate. Il agit comme un fixateur biologique et crée une coagulation des protéines plasmatiques dans les tubules, bloquant les ouvertures. Capable de réduire la sensibilité pendant au moins trois mois, ,sup > 36 il peut infiltrer la dentine humide et gravée à l’acide. Ces vernis sont compatibles avec les adhésifs, les ciments et les matériaux de restauration et d’accumulation de noyaux.37
Le vernis à la chlorhexidine forme une barrière mécanique après séchage, ce qui réduit la sensibilité, tout en procurant une action antiplaque et antibactérienne.Il a également été démontré que les oxalates 38
diminuent la perméabilité dentinaire et bloquent les tubules.39 L’oxalate réagit avec les ions calcium de la dentine pour former des cristaux d’oxalate de calcium dans les tubules et à la surface. L’effet est cependant réduit au fil du temps, car les cristaux sont éliminés par brossage et acides alimentaires. La gravure améliore l’infiltration des cristaux d’oxalate de calcium dans les tubules.39
Les cliniciens peuvent également utiliser un désensibilisant photopolymérisable qui réduit la sensibilité par la réaction du monomère avec le calcium dans la dent et la formation d’étiquettes de résine, entraînant une occlusion du tubule. Une lampe à polymériser polymérise ensuite la couche de résine. Il peut être utilisé pour sceller immédiatement la dentine des dents préparées.
OPTIONS DE TRAITEMENT INVASIF
Lorsque les traitements moins invasifs ne sont pas efficaces, le collage, la greffe et le traitement au laser peuvent soulager l’hypersensibilité dentinaire. Les agents de liaison peuvent être utilisés pour désensibiliser et coller simultanément.40 Selon le produit utilisé, un inconvénient potentiel de cette approche est la nécessité d’utiliser de l’acide phosphorique avant de placer l’agent de liaison, ce qui peut nécessiter l’utilisation d’une anesthésie.
Une alternative consiste à utiliser un adhésif auto-gravé. Un autre agent de liaison disponible bloque les tubules dentinaires et contient du triclosan pour minimiser la formation de plaque.41 Un autre mode de désensibilisation consiste à recouvrir les surfaces radiculaires exposées par greffage. Cela devrait toutefois être envisagé avant les techniques de collage, car les restaurations liées pourraient empêcher une greffe réussie.42 L’utilisation de Nd:Les lasers YAG fournissent une absorption d’énergie thermique sur la dentine, ce qui peut entraîner une occlusion ou un rétrécissement des tubules dentinaires.39,43
RÉSUMÉ
L’hypersensibilité dentinaire est causée par une dentine exposée dans laquelle des stimuli déclenchent un mouvement du liquide du tubule dentinaire qui active les fibres nerveuses pour causer de la douleur. La relation entre la précipitation de surface et intratubulaire et la modération de la sensibilité n’est pas simple. Ce n’est pas la quantité de précipité, mais plutôt la qualité, la densité, la porosité, la profondeur de pénétration et la force de fixation à la dentine qui affectent les résultats.40 En fin de compte, l’efficacité du traitement est déterminée par la durée de la diminution ou de l’élimination.
Les décisions de traitement doivent être basées sur la gravité et l’étiologie de l’hypersensibilité dentinaire. Certains traitements en cabinet apportent un soulagement immédiat qui peut être suivi d’une variété de remèdes à la maison. Une combinaison de techniques peut être justifiée pour fournir un soulagement à long terme.
POINTS À RETENIR
-
- La théorie hydrodynamique est la cause la plus communément admise de l’hypersensibilité dentinaire.
- Les tubules dentinaires ouverts présentent une conductance hydraulique élevée, contribuant ainsi à la sensibilité; inversement, le débit de fluide diminue si les tubules sont bloqués. Cela fournit un moyen pour diverses approches de traitement.
- La prévalence de cette affection est légèrement plus élevée chez les femmes3, les canines et les prémolaires des deux arcs étant les plus fréquemment impliquées.4
- Typiquement, la douleur d’hypersensibilité est localisée et de courte durée; cela diffère de la douleur pulpaire, qui est prolongée, sourde, douloureuse, mal localisée et dure plus longtemps que le stimulus appliqué.
- L’utilisation d’un barrage en caoutchouc peut être utile pour tenter d’isoler la ou les dents sujettes à une hypersensibilité.
- Les cliniciens peuvent recommander une variété de thérapies pour une utilisation à domicile ou au bureau. Les traitements les plus courants comprennent les agents anti-inflammatoires, les précipitants protéiques, les agents occlusifs des tubules et les mastics des tubules.
- Les décisions de traitement doivent être basées sur la gravité de la sensibilité et l’étiologie, et une combinaison de techniques peut être justifiée pour apporter un soulagement efficace.
-
-
- Addy M. Hypersensibilité dentinaire: Nouvelles perspectives sur un vieux problème. Int Dent J.2002; 52:367-375.
- Addy M. Étiologie et implications cliniques de l’hypersensibilité dentinaire. Dent Clin Nord Am. 1990;34:503–514.
- Flyn J, Galloway R, Orchardson R. L’incidence des dents hypersensibles dans l’ouest de l’Écosse. J Dent. 1985;13:230–236.
- Addy M, Mostafa P, Newcombe RG. Hypersensibilité dentinaire: La distribution de la récession, de la sensibilité et de la plaque. J Dent. 1987;15:242–248.
- Dababneh RH, Khouri AT, Addy M. Dentine hypersensibilité – une énigme? Une revue de la terminologie, des mécanismes, de l’étiologie et de la gestion. Br Dent J.1999; 187:606-611.
- Holland GR, Narhi MN, Addy M, Gangarosa L, Orchardson R. Lignes directrices pour la conception et la conduite d’essais cliniques sur l’hypersensibilité dentinaire. J Clin Parodontol. 1997;24:803–813.
- Li Y. Innovations pour lutter contre l’hypersensibilité dentinaire: état actuel de la technique. Compend Contin Educ Dent. 2012; 33 (Suppl): 10-16.
- Kramer IRH. La relation entre la sensibilité dentinaire et les mouvements dans le contenu des tubules dentinaires. Br Dent J. 1955; 98:391-392.
- Brännström M. L’excitation de la douleur dans la dentine et la pulpe humaines par des stimuli chimiques. Arch Biol Oral. 1962;7:59–62.
- Pashley DH. Complexe dentine-prédentine et sa perméabilité: aperçu physiologique. J Dent Res. 1985; 64 (Suppl): 613-620.
- Magloire H, Maurin JC, Couble ML, et al. Revue d’actualité. Douleurs dentaires et odontoblastes: faits et hypothèses. Douleur de J Orofac. 2010;24:335–349.
- Camilotti V, Zilly J, Nassar CA, Nassar PO. Traitements désensibilisants pour l’hypersensibilité à la dentine: un essai clinique randomisé en bouche fendue. Braz Oral Res. 2012; 26:263-268.
- Chabanski MB, Gillam DG, Bulman JS, Newman HN. Prévalence de la sensibilité de la dentine cervicale dans une population de patients référés à un service de parodontologie spécialisé. J Clin Parodontol. 1996;23:989–992.
- Uchida A, Wakano Y, Fukuyama O, Miki T, Iwayama Y, Okada H. Évaluation clinique contrôlée d’un dentifrice au chlorure de strontium à 10% dans le traitement de l’hypersensibilité dentinaire à la suite d’une chirurgie parodontale. J Parodontol. 1980;51:578–581.
- Absi EG, Addy M, Adams D. Dentine hypersensibilité – l’effet du brossage des dents et des composés alimentaires sur la dentine in vitro: une étude SEM. J Réhabilitation orale. 1992;19:101–110.
- Kahler W. L’énigme de la dent fissurée: terminologie, classification, diagnostic et gestion. Je suis Dent. 2008;21:275–282.
- Bartlett DW. Le rôle de l’érosion dans l’usure des dents: étiologie, prévention et gestion. Int Dent J. 2005; 55 (Suppl): 277-284.
- Zéro DT, Lussi A. Érosion – facteurs chimiques et biologiques d’importance pour le praticien dentaire. Int Dent J. 2005; 55:285-290.
- Lambrechts P, Van Meerbeek B, Perdigão J, Gladys S, Braem M, Vanherle G. Thérapie réparatrice pour la lésion érosive. Eur J Sci Orale. 1996;104:229–240.
- Grippo JO. Lésions cervicales non diverses: la décision d’ignorer ou de restaurer. J Esthet Dent. 1992;4:55–64.
- Abrahamsen TC. La dentition usée – modèles pathognomoniques d’abrasion et d’érosion. Int Dent J. 2005; 55 (Suppl):268–276.
- McIntyre F. Restoring esthetics and anterior guidance in used anterior teethings. Une approche multidisciplinaire conservatrice. Je Suis Dent Assoc. 2000;131:1279–1283.
- Michael JA, Townsend GC, Greenwood LF, Kaidonis JA. Abfraction: séparer le fait de la fiction. Aust Dent J. 2009; 54:2-8.
- Lee WC, Eakle WS. Rôle possible de la contrainte de traction dans l’étiologie des lésions érosives cervicales des dents. J Prothèse Dent. 1984;52:374–380.
- Swift EJ Jr. Sensibilité et blanchiment des dents. Compend Contin Dent Educ Dent.2005; 26 (Suppl): 4-10.
- Conseil consultatif canadien sur l’hypersensibilité dentinaire. Recommandations consensuelles pour le diagnostic et la prise en charge de l’hypersensibilité dentinaire. J Peut Dent Assoc. 2003;69:221–226.
- Al-Saoud LM, Al-Nahedh HN. Effet d’occlusion du laser Nd: YAG et de différents agents désensibilisants de la dentine sur les tubules dentinaires humains in vitro: une enquête en microscopie électronique à balayage. Opération Dent. 2012;37:340–355.
- Poulsen S, Errboe M, Hovgaard O, Worthington HW. Dentifrice au nitrate de potassium pour l’hypersensibilité à la dentine. Cochrane Database Syst Rév. 2001; 2: CD001476.
- Vergerson R, Gillam DG. Prise en charge de l’hypersensibilité dentinaire. J Dent Assoc. 2006;137:990–998.
- Borges BC, Souza-Junior EJ, da Costa Gde F, et al. Effet du prétraitement de la dentine avec une pâte de phosphate de calcium phosphopeptidéamorphique de caséine (CPP-ACP) sur la force de liaison de la dentine dans les cavités tridimensionnelles. Acta Odontol Scand. 2013;71:271–277.
- Forsback AP, Areva S, Salonen JI. Minéralisation de la dentine induite par un traitement avec du verre bioactif S53P4 in vitro. Acta Odontol Scand. 2004;62:14–20.
- Karlinsey RL, Mackey AC. Préparation à l’état solide et application dentaire d’un phosphate de calcium organiquement modifié. J Mater Sci. 2009;44:346–349.
- Panagakos F, Schiff T, Guignon A. Hypersensibilité dentinaire: traitement efficace avec une pâte désensibilisante en cabinet contenant 8% d’arginine et de carbonate de calcium. Je suis Dent. 2009; 22 (Suppl): 3A–7A.
- García-Godoy A, García-Godoy F. Effet d’une pâte désensibilisante en cabinet à 8,0% d’arginine et de carbonate de calcium sur la résistance au cisaillement des composites à l’émail dentaire humain. Je suis Dent. 2010;23:324–326.
- Camilotti V, Zilly J, Busato Aop M, Nassar CA, Nassar PO. Traitements désensibilisants pour l’hypersensibilité à la dentine: un essai clinique randomisé en bouche fendue. Braz Oral Res. 2012; 26:263-268.
- Sethna GD, Prabhulji MLV, Karthikeyan BV. Comparaison de deux formes différentes de vernis dans le traitement de l’hypersensibilité dentinaire: une étude clinique randomisée à l’aveugle. Santé Bucco-dentaire Précédent Dent. 2011;9:143–150.
- Dijkman GE, Jongebloed WL, de Vries J, Ogaard B, Arends J. Closing of dentinal tubules by glutaraldehyde treatment, a scanning electron microscopy study. Scand J Dent Res. 1994; 102:144-150.
- Sköld-Larsson K, Sollenius O, Petersson LG, Twetman S. Effet des applications topiques d’une nouvelle formule de vernis chlorhexidine-thymol sur les streptocoques mutans et le développement de caries dans les fissures occlusales des molaires permanentes. J Clin Dent. 2009;20:223–226.
- Lan WH, Lee BS, Liu HC, Lin CP. Étude morphologique de l’utilisation du laser Nd: YAG dans le traitement de l’hypersensibilité dentinaire. J Endod. 2004;30:131–134.
- e M, Morel AD, Wilson RF, Ashley FP. Le rôle d’un agent de liaison de la dentine dans la réduction de la sensibilité de la dentine cervicale. J Clin Parodontol. 1998;25:286–290.
- Yu X, Liang B, Jin X, Fu B, Hannig M. Étude comparative in vivo sur l’efficacité désensibilisante des désensibilisants dentinaires et des adhésifs auto-gravants à une bouteille. Opération Dent. 2010;35:279–286.
- Douglas de Oliveira DW, Marques DP, Aguiar-Cantuária IC, Flecha OD, Gonçalves PF. Effet de la couverture des défauts chirurgicaux sur l’hypersensibilité à la dentine cervicale et la qualité de vie. J Parodontol. 2013;84:768–775.
- Orhan K, Aksoy U, Can-Karabulut DC, Kalender A. Thérapie au laser de bas niveau de l’hypersensibilité dentinaire: un essai clinique à court terme. Lasers Med Sci. 2011;26:591–598.
-