Électrolytes ioniques
L’eau et d’autres molécules polaires sont attirées par les ions, comme le montre la figure \(\PageIndex{2}\). L’attraction électrostatique entre un ion et une molécule avec un dipôle est appelée attraction ion-dipôle. Ces attractions jouent un rôle important dans la dissolution des composés ioniques dans l’eau.
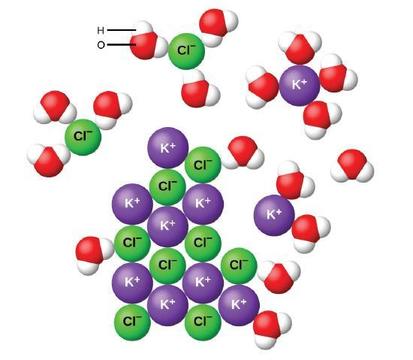
Lorsque les composés ioniques se dissolvent dans l’eau, les ions du solide se séparent et se dispersent uniformément dans toute la solution car les molécules d’eau entourent et solvatent les ions, réduisant les fortes forces électrostatiques entre eux. Ce processus représente un changement physique appelé dissociation. Dans la plupart des conditions, les composés ioniques se dissocient presque complètement lorsqu’ils sont dissous, et ils sont donc classés comme des électrolytes forts.
Considérons ce qui se passe au niveau microscopique lorsque nous ajoutons du KCl solide à l’eau. Les forces ion-dipolaires attirent l’extrémité positive (hydrogène) des molécules d’eau polaire vers les ions chlorure négatifs à la surface du solide, et elles attirent les extrémités négatives (oxygène) vers les ions potassium positifs. Les molécules d’eau pénètrent entre les ions individuels K + et Cl− et les entourent, réduisant les fortes forces interioniques qui lient les ions ensemble et les laissant se déplacer en solution sous forme d’ions solvatés, comme le montre la figure. La réduction de l’attraction électrostatique permet le mouvement indépendant de chaque ion hydraté dans une solution diluée, ce qui entraîne une augmentation du désordre du système lorsque les ions passent de leurs positions fixes et ordonnées dans le cristal à des états mobiles et beaucoup plus désordonnés en solution. Ce trouble accru est responsable de la dissolution de nombreux composés ioniques, y compris le KCl, qui se dissolvent avec l’absorption de la chaleur.
Dans d’autres cas, les attractions électrostatiques entre les ions dans un cristal sont si grandes, ou les forces d’attraction ion-dipôle entre les ions et les molécules d’eau sont si faibles, que l’augmentation du désordre ne peut compenser l’énergie nécessaire pour séparer les ions, et le cristal est insoluble. C’est le cas de composés tels que le carbonate de calcium (calcaire), le phosphate de calcium (le composant inorganique de l’os) et l’oxyde de fer (rouille).