Les réactions en solution qui ne sont pas catalysées sont lentes car le développement et la séparation des charges se produisent à l’état de transition. Lorsque des liaisons sont faites ou rompues, il se forme souvent des intermédiaires chargés dont l’énergie est supérieure à celle des réactifs. Comme l’intermédiaire est plus énergétique que les réactifs, l’état de transition serait encore plus énergétique et ressemblerait donc plus étroitement à l’intermédiaire chargé. Tout ce qui peut stabiliser les charges sur l’intermédiaire et donc les charges en développement dans les états de transition réduira l’énergie de l’état de transition et catalysera la réaction. Dans cette section, nous étudierons le mécanisme sous-jacent à la catalyse par de petites molécules de réactions chimiques. Vraisemblablement, les catalyseurs macromoléculaires biologiques (comme les enzymes protéiques) utiliseront des mécanismes similaires dans leurs effets catalytiques (qui seront discutés dans la section suivante).
Les catalyseurs, y compris les enzymes, peuvent utiliser au moins 5 façons différentes de stabiliser les états de transition.
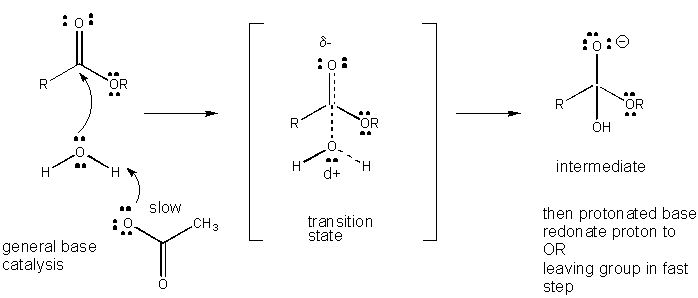
Le développement de la charge dans le TS peut être diminué par le don d’un proton d’acides généraux (comme l’acide acétique ou un cycle indole protoné) à un atome tel qu’un carbonyle O qui développe une charge négative partielle dans le TS lorsqu’il est attaché par un nucléophile. Le don de protons diminue le négatif en développement dans le TS. Alternativement, un nucléophile tel que l’eau qui développe une charge positive partielle dans le TS au fur et à mesure qu’il commence à former une liaison à un C électrophile dans un carbonyle peut être stabilisé par la présence d’une base générale (telle que l’acétate ou le cycle indole déprotoné). L’abstraction des protons diminue la charge positive en développement
Figure: DÉVELOPPEMENT DE LA CHARGE DANS L’ÉTAT DE TRANSITION POUR L’HYDROLYSE DES ESTER
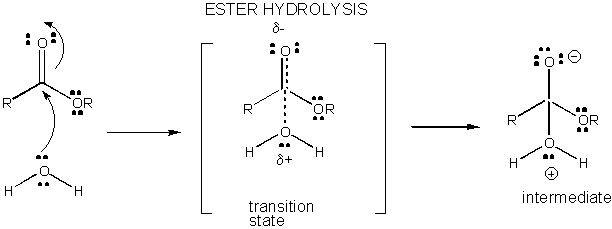
Figure: MÉCANISME DE CATALYSE ACIDE GÉNÉRALE
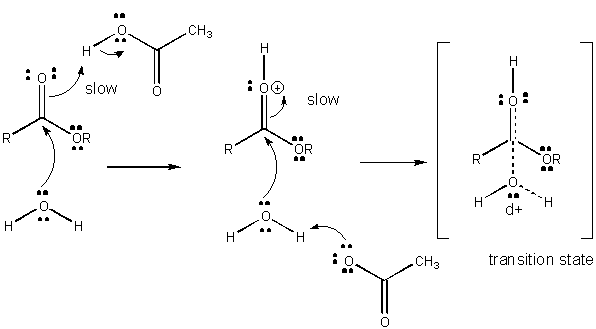
Figure: MÉCANISME DE CATALYSE DE BASE GÉNÉRALE
Contributeurs et attributions
- Prof. Henry Jakubowski (Collège Saint-Benoît / Université Saint-Jean)