Le bicarbonate de magnésium, également connu sous son nom IUPAC hydrogénocarbonate de magnésium, est un sel contenant un anion bicarbonate et un cation de magnésium représentés par la formule C2H2MgO6 ou Mg (HCO3) 2. Le bicarbonate de magnésium étant instable à l’état solide, il existe dans une solution aqueuse diluée.
Identification du Bicarbonate de Magnésium |
|
| Numéro CAS | 2090-64-4 |
| PubChem CID | 102204 |
| ID DE ChemSpider | 92335 |
| Numéro CE | 235-192-7 (Agents d’amélioration des aliments de l’UE)
218-240-1 (ECHA) |
| UNII | 19E9A0647O |
| Clé InChI | QWDJLDTYWNBUKE-UHFFFAOYSA-L |
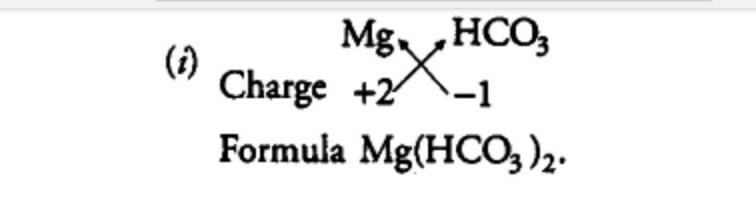
Formule de bicarbonate de magnésium
Comment est préparé le bicarbonate de magnésium
Il peut être synthétisé par traitement de l’acétate de magnésium avec du bicarbonate de sodium, impliquant la réaction suivante:
Mg (CH3COO) 2 + 2NaHCO3 → Mg (HCO3) 2 + 2CH3COONa
Une solution de Mg (HCO3) 2 communément appelée eau de bicarbonate de magnésium peut être produite par réaction d’hydroxyde de magnésium (tel que le lait de magnésie) et de dioxyde de carbone sous pression (comme l’eau de seltz) :
Mg (OH) 2 + 2CO2 → Mg (HCO3) 2
La solution résultante, une fois séchée, décompose le bicarbonate de magnésium en carbonate de magnésium, en eau et en dioxyde de carbone:
Mg + 2HCO3 → MgCO3 + CO2 + H2O

Bicarbonate de magnésium
Propriétés et caractéristiques du bicarbonate de magnésium
Propriétés Générales |
|
| Masse Molaire / Poids moléculaire | 146.337 g/ mol |
Propriétés Physiques |
|
| Couleur et aspect | Masse ou poudre friable légère, blanche, instable |
| Odeur | Sans odeur |
| Point de fusion | N/A |
| Point d’ébullition | 333,6 °C, 632.48 °C |
| Charge | 0 (Mg2+ et HCO3–) |
| État de la matière à température ambiante | Instable sous forme solide mais existe à l’état liquide |
| Solubilité | Insoluble dans l’éthanol |
| Solubilité dans l’eau | Presque insoluble dans l’eau (0,077 g pour 100 mL) |
Utilisations
- Le bicarbonate de magnésium présente de nombreux avantages pour la santé et est utilisé pour résister aux changements de pH sanguin et le maintenir dans une plage optimale.
- En tant que minéral essentiel, il aide à la régulation de la pression artérielle, à la synthèse des protéines, aux fonctions nerveuses et musculaires et au contrôle de la glycémie dans le corps humain.
- Il est utilisé comme additifs alimentaires tels que les régulateurs d’acidité, les agents alcalins, anti-fissuration et de blanchiment.
- Acide Carbonique, Sel de magnésium (2:1) – Pubchem.ncbi.nlm.nih.gov
- Bicarbonate de magnésium – Mg (HCO3) 2– Byjus.com
- Bicarbonate de magnésium – Chemspider.com
- Préparation de Solutions de Bicarbonate de magnésium pour la Désacidification – Jstor.org
- Eau de bicarbonate de magnésium – L’importance des bicarbonates et du magnésium – Dancingwithwater.com
- Régulateurs d’acidité – Chm.bris.ac.uk