Réactions d’ouverture du cycle époxyde – SN1 vs SN2, régiosélectivité et stéréosélectivité
Les réactions d’ouverture du cycle non enzymatique des époxydes donnent un bon aperçu de nombreux concepts que nous avons déjà vus dans ce chapitre. Les réactions d’ouverture de cycle peuvent se dérouler par des mécanismes SN2 ou SN1, selon la nature de l’époxyde et les conditions de la réaction. Si l’époxyde est asymétrique, la structure du produit variera en fonction du mécanisme dominant. Lorsqu’un époxyde asymétrique subit une solvolyse dans le méthanol basique, l’ouverture du cycle se produit par un mécanisme SN2, et le carbone moins substitué est le site de l’attaque nucléophile, conduisant à ce que nous appellerons le produit B:

Inversement, lorsque la solvolyse se produit dans le méthanol acide, la réaction se produit par un mécanisme à caractère SN1 substantiel, et le carbone le plus substitué est le site d’attaque. En conséquence, le produit A prédomine.

Ce sont tous deux de bons exemples de réactions régiosélectives. Dans une réaction régiosélective, deux (ou plus) isomères constitutionnels différents sont possibles en tant que produits, mais un est formé préférentiellement (ou parfois exclusivement).
Examinons d’abord le cas de base SN2. Le groupe partant est un anion alcoxyde, car il n’y a pas d’acide disponible pour protoner l’oxygène avant l’ouverture du cycle. Un alcoxyde est un groupe de départ pauvre, et il est donc peu probable que le cycle s’ouvre sans une « poussée » du nucléophile.

Le nucléophile lui-même est puissant: un ion méthoxyde déprotoné et chargé négativement. Lorsqu’une réaction de substitution nucléophile implique un groupe partant pauvre et un nucléophile puissant, il est très probable qu’elle se déroule par un mécanisme SN2.
Qu’en est-il de l’électrophile? Il y a deux carbones électrophiles dans l’époxyde, mais la meilleure cible pour le nucléophile dans une réaction SN2 est le carbone le moins gêné. Cela explique le résultat régiochimique observé. Comme dans d’autres réactions SN2, l’attaque nucléophile a lieu de l’arrière, entraînant une inversion au niveau du carbone électrophile.
La meilleure façon de décrire la réaction d’ouverture du cycle époxyde catalysée par l’acide est probablement un hybride, ou un croisement, entre un mécanisme SN2 et SN1. Tout d’abord, l’oxygène est protoné, créant un bon groupe de départ (étape 1 ci-dessous). Ensuite, la liaison carbone-oxygène commence à se rompre (étape 2) et une charge positive commence à s’accumuler sur le carbone le plus substitué (rappelez-vous la discussion de la section 8.4B sur la stabilité du carbocation).

Contrairement à une réaction SN1, le nucléophile attaque le carbone électrophile (étape 3) avant qu’un intermédiaire de carbocation complet ait une chance de se former.

L’attaque a lieu préférentiellement par l’arrière (comme dans une réaction SN2) car la liaison carbone-oxygène est encore dans une certaine mesure en place et les blocs d’oxygène attaquent par l’avant. Notez cependant en quoi le résultat régiochimique est différent de la réaction catalysée par la base: dans le processus catalysé par l’acide, le nucléophile attaque le carbone le plus substitué car c’est ce carbone qui détient un plus grand degré de charge positive.
Exercice 8.17:
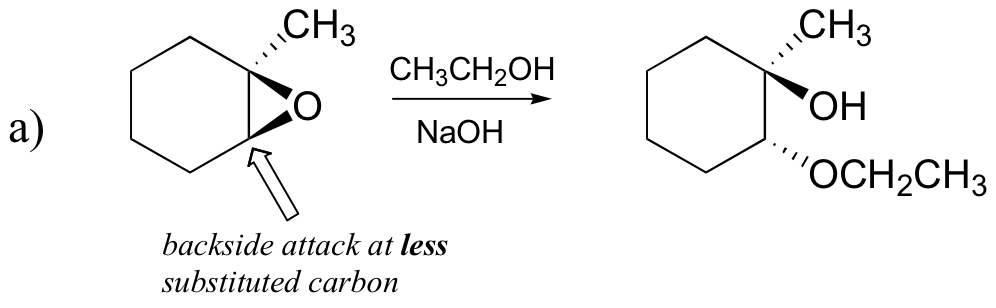
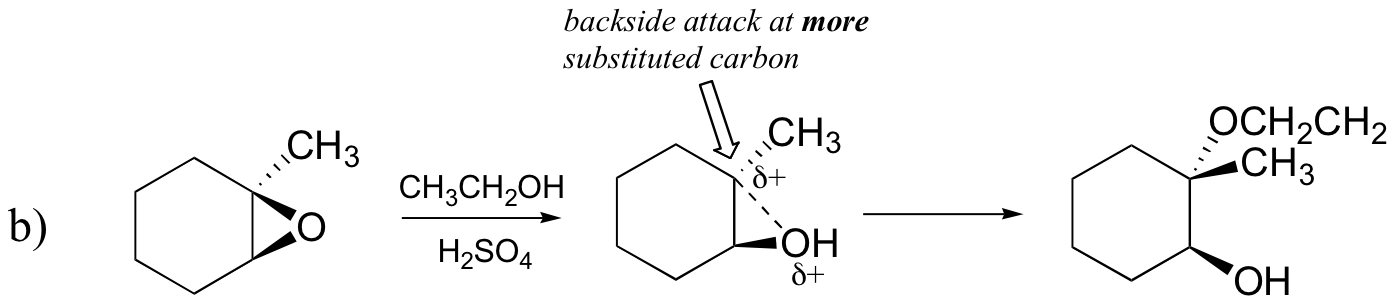
Prédire le ou les principaux produits de la réaction d’ouverture du cycle qui se produit lorsque l’époxyde montré ci-dessous est traité avec:
a) de l’éthanol et une petite quantité d’hydroxyde de sodium
b) de l’éthanol et une petite quantité d’acide sulfurique

Conseil: assurez-vous de considérer à la fois la régiochimie et la stéréochimie!
Vidéos de la Khan academy

Ouverture de l’anneau dans des conditions acides: