- Protocoles
- Production d’hybridomes
- Représentation schématique de la fusion cellulaire
- Équipement nécessaire
- Milieu et autres réactifs (Voir l’annexe A pour plus de détails)
- Avant de commencer (voir l’annexe A pour plus de détails)
- Décongélation et croissance des cellules du myélome
- Le processus de fusion
- Trois jours avant – Préparer les cellules du myélome pour la fusion
- Un jour avant – préparer le milieu
- Jour de la fusion
- Jour après la fusion
- Annexe I
Protocoles
Production d’hybridomes
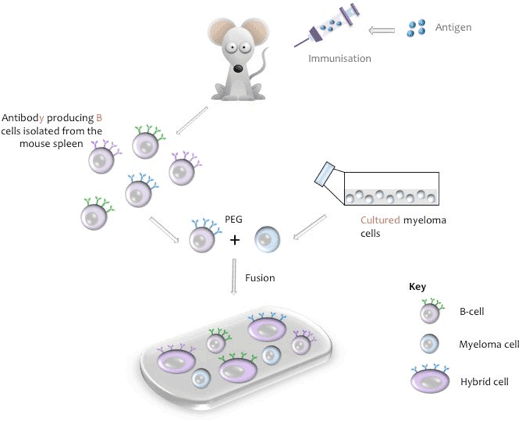
Un hybridome est une lignée cellulaire issue d’une cellule hybride capable de sécréter un anticorps monoclonal spécifique d’un épitope de votre antigène de manière permanente en culture. La cellule hybride est produite par la fusion d’anticorps spécifiques produisant des cellules B à partir d’un animal immunisé (généralement une souris, un rat ou un lapin) et dont la durée de vie est finie, avec une cellule d’une lignée cellulaire de myélome « immortelle » en culture (par exemple, souris NS-1 ou NS-0).
Production d’une cellule hybride de souris
Au cours du processus de fusion, les cellules B sont isolées de la rate de souris, mélangées à la lignée cellulaire de myélome de souris et la fusion est induite avec du polyéthylène glycol (PEG, voir Annexe I). (La lignée de myélome pertinente est utilisée lorsque des cellules B d’autres espèces animales sont utilisées). Les hybridomes résultants sont ensuite cultivés dans un milieu de culture tissulaire contenant de l’Hypoxathine, de l’aminoptérine, de la Thymidine (HAT), une étape qui tue toutes les cellules de myélome non fusionnées qui pourraient dépasser les autres cellules d’hybridomes plus faibles. Les cellules B non fusionnées ont des pouvoirs de division limités et mourront naturellement en culture. Dix jours après le processus de fusion, le surnageant de culture est collecté et testé pour la présence de l’anticorps désiré.
Représentation schématique de la fusion cellulaire
Équipement nécessaire
- Un environnement stérile, dans lequel préparer et manipuler les cellules (flux laminaire ou armoire de classe II)
- Un incubateur réglé à 37ºC, avec 5% de CO2 et une humidité de 95%
- Un microscope inversé
- Un bain d’eau à 37ºC pouvant être placé dans l’armoire
- Une centrifugeuse avec un rotor pivotant
- Instruments de dissection stériles – idéalement deux ensembles – chacun composé de deux paires de ciseaux et de pinces (une incurvée et une à extrémité émoussée).
- Flacons de culture de Corning pour tissus de 75 ml – Réf. 15430641
- Plaques Falcon 24 puits – Réf. 353047
- Pipettes stériles
- Remplisseur de pipettes
- Pipettes stériles pasteur
- Une minuterie
Milieu et autres réactifs (Voir l’annexe A pour plus de détails)
- RPMI 1640 bicarbonate tamponné, avec de la L-Glutamine (Lonza Réf. BE12-702F)
- RPMI 1640 Hepes tamponné, sans L-Glutamine
- Sérum Foetal Bovin de bonne qualité (testé par lots) (Genycell Réf. GCS0101-500)
- Pénicilline/Streptomycine (Gibco Réf. 15070-063)
- Ultroser G (Réf. Pall. 15950-017)
- HAT (Hypoxathine, Aminoptérine, Thymidine) (Gibco Réf. 21060-017)
- CHEVILLE 1500 (Roche Réf. 10783641001)
Avant de commencer (voir l’annexe A pour plus de détails)
- Faire 500ml de A
- Faire 500ml de milieu A +
- Faire 100ml de milieu B
- Faire 100ml de milieu C
- Faire 500ml de milieu D
Décongélation et croissance des cellules du myélome
Décongeler la lignée cellulaire du myélome et se développer dans le milieu A. Utilisez la méthode suivante pour décongeler et cultiver la lignée cellulaire du myélome.
- Retirer le flacon congelé de cellules de myélome du stockage LN2.
- Placer les cellules dans un bain d’eau à 37ºC.
- Gardez le couvercle du flacon de congélation au-dessus de la surface de l’eau pour réduire les risques de contamination.
- Lorsque les cellules sont presque décongelées (il ne reste qu’un petit morceau de glace), déplacez-vous vers le capot de culture tissulaire.
- Essuyez l’extérieur du flacon avec de l’éthanol à 70% et retirez le dessus.
- Retirez délicatement la suspension cellulaire à l’aide d’une pipette Pasteur stérile.
- Transférer le contenu dans un tube à centrifuger contenant 10 ml de milieu A (voir annexe A)
- Faire tourner la suspension cellulaire doucement à 300g pendant 5 min.
- Retirer le surnageant et remettre les cellules en suspension dans 10 ml de milieu frais A et placer dans une petite fiole (25cm2).
- Prélever 1 ml de la suspension dans le flacon d’origine et l’ajouter à un second contenant 9 ml de milieu A. Cela garantit que si la concentration dans le premier flacon est trop élevée, une deuxième concentration (inférieure) de cellules est disponible.
- Mettez les flacons dans l’incubateur à CO2. N’oubliez pas de laisser les couvercles du flacon légèrement ouverts pour permettre l’échange gazeux.
Le processus de fusion
Trois jours avant – Préparer les cellules du myélome pour la fusion
Les cellules du myélome doivent être en phase de croissance exponentielle lorsque vous les utilisez et cela nécessite de l’expérience. Cependant, si vous mettez en place deux flacons de 75 cm2 de vos cellules de myélome, l’un à une dilution de 1:40 et l’autre à 1: 60 (voir ci-dessous), 3 jours avant la fusion, l’un des flacons devrait être idéal le jour de la fusion. (La mise en place initiale de flacons supplémentaires à des dilutions supérieures et inférieures à celles données ici devrait vous fournir l’expérience nécessaire pour juger du taux de croissance des cellules du myélome pour les fusions ultérieures).
Un jour avant – préparer le milieu
Les éléments suivants doivent être préparés et préchauffés à 37ºC (vous pouvez les mettre dans votre incubateur pendant la nuit).
- Deux x 200ml de milieu A+ dans deux flacons de 75cm2
- 100ml de milieu B
- 100ml de milieu C
- 1x4ml PEG 1500 transféré sur une feuille enveloppée (Le PEG est sensible à la lumière) stérile universel
- Un mini bain d’eau, fabriqué à partir d’un bécher de 200 ml contenant environ 100 ml d’eau distillée et traversé avec du ruban suffisamment large pour qu’il y ait une ouverture pour maintenir un tube Falcon de 50 ml debout
Jour de la fusion
- Tuer la souris (suivant les directives institutionnelles), extraire la rate et la mettre dans un récipient stérile contenant 5 ml de milieu C.
- Toutes les étapes suivantes doivent être effectuées dans une hotte à flux laminaire.
- Mettez la rate et le médium dans une boîte de pétri.
- Déplacez la rate avec une pince stérile pour la laver. Retirez les adhérences et transférez la rate dans une deuxième boîte de pétri
- Coupez la rate en deux. Tenez la moitié avec une pince émoussée et à l’aide d’une autre paire de pinces incurvées, enlevez doucement les cellules de la capsule de la rate, en prenant soin d’enlever autant de cellules que possible. Répétez l’utilisation de la deuxième moitié de rate
- Retirez les débris de la capsule de rate et, à l’aide d’une pipette Pasteur stérile, mélangez bien les cellules mais très doucement.
- Transférer la suspension cellulaire dans un tube de 15 ml et utiliser 5 ml supplémentaires de milieu C pour rincer la boîte de pétri et l’ajouter aux cellules de la rate dans le tube.
- Comptez les cellules du myélome et de la rate.
- Vous avez besoin d’un rapport de 1 cellule de myélome pour 10 cellules de rate
- Ajoutez les cellules de myélome dans un tube conique de 50 ml.
- Centrifuger les cellules de la rate (tube de 15 ml) et les cellules du myélome dans (tube de 50 ml) pendant 300 g pendant 10 minutes.
- Versez très soigneusement le surnageant des deux tubes et remettez doucement en suspension les pastilles chacune dans 10 ml de milieu B. L’absence de FBS jusqu’à la fin du processus de fusion est extrêmement importante car les cellules ne fusionneront pas s’il y a du FBS présent)
- Combinez la cellule de rate remise en suspension et les pastilles de myélome dans un tube à centrifuger de 50 ml.
- Centrifuger pendant 5 minutes à 300g.
- Versez très soigneusement autant de surnageant que possible.
- Remettre la pastille en suspension en tapotant doucement le tube sur le banc. Ne pas effleurer la pastille ou la pipeter car cela distribuera les cellules autour du tube en réduisant le nombre de cellules disponibles pour la fusion.
- Placez le tube dans le bain-marie fait maison.
- Ajouter 1,2 ml de PEG goutte à goutte pendant une minute, en remuant doucement toutes les quelques gouttes.
- Ajouter 1 ml de milieu B, goutte à goutte pendant une minute, en remuant doucement toutes les quelques gouttes.
- Ajouter encore 2 ml de milieu B, goutte à goutte pendant deux minutes, en remuant doucement toutes les quelques gouttes.
- Ajouter 4 ml supplémentaires de milieu B, goutte à goutte pendant quatre minutes, en remuant doucement toutes les quelques gouttes.
- A la fin du temps, ajouter 8ml de milieu C.
- Centrifuger le tube de cellules pendant 5 minutes 300g.
- Décanter très soigneusement le surnageant et remettre en suspension le culot de cellules pendant 1 minute avec 10ml de milieu A+. Pour ce faire, ajoutez quelques ml du milieu pour commencer à briser la pastille. Aspirez très doucement ces amas de cellules et déplacez-les de haut en bas dans la pipette. Expulsez ces cellules et répétez le processus. Soyez très doux, ne forcez pas la pastille à se séparer, vous pouvez avoir de petites touffes de cellules lorsque vous avez terminé. Les cellules sont extrêmement fragiles à ce stade.
- Mettez les 10 ml de mélange fusion remis en suspension dans 190 ml de milieu chaud A +
- Le volume final est de 200 ml
- Mettez 1 ml de cette suspension dans chaque puits de 8 plaques de 2 ml (2 ml) de puits. (192 puits au total)
- Laisser les plaques dans l’incubateur pendant la nuit (environ 24 heures).
Jour après la fusion
- Ajouter 8ml de HAT dans 200ml de milieu A+.
- Mettre 1ml de ce milieu sélectif dans chaque puits des 8 plaques.
- Laissez les plaques dans l’incubateur. Les colonies apparaîtront entre 7 et 10 jours

Annexe I
Milieu de culture A:
Milieu RPMI 1640 avec L-Glutamine (bicarbonate tamponné) (Lonza Réf. BE12-702F)
+ 10% de FBS (Réf. Genycell. GCS0101-500)
+ Pénicilline (100U/ml) / Streptomycine (100mg/l) (Gibco Réf. 15070-063)
Milieu de culture A+:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
Culture Medium B (no FBS):
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium C:
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium D:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
+ HAT (Hypoxathine, Aminopterin, Thymidine) supplement which is usually 50X (dilute 10ml in 500mls of medium) (Gibco Ref. 21060-017)