- Plasticité des CMV dans la physiologie et la maladie
- Au cours des deux dernières décennies, il est devenu de plus en plus évident que l’adventice est un tissu hautement complexe et immunologiquement actif abritant des cellules aussi diverses que les cellules stromales, les nerfs, les vaisseaux lymphatiques, le vasa vasora et les leucocytes résidents / cellules progénitrices qui ont toutes la capacité d’influer sur l’évolution de la maladie (36, 37). Nous avons observé que l’adventice des souris ApoE-/- subit des événements de restructuration majeurs à tous les stades de l’athérosclérose: Les cellules immunitaires innées et adaptatives s’accumulent à côté des plaques athérosclérotiques voisines (Figure 2). De plus, nos études sur des souris expérimentales ont été corroborées dans des artères malades humaines: Nous et d’autres avons observé des structures de type ATLO dans l’adventice de patients présentant des anévrismes aortiques athérosclérotiques (38, 39) et plus récemment, Akhavanpoor et al. ATLOs bien développé observé dans l’adventice d’un pourcentage considérable de patients atteints de cardiopathie ischémique (40). Dans l’athérosclérose murine, la néogenèse des vaisseaux lymphatiques, de la veinule endothéliale élevée (VHE) et des vaisseaux sanguins sont des caractéristiques importantes de ce processus de restructuration (16, 41). FIGURE 2 Figure 2. Les cellules musculaires lisses vasculaires (CSVM) participent à l’immunité adventice lors de la formation de la plaque. Les CMV pris en sandwich entre les plaques athérosclérotiques et l’adventice adoptent un phénotype de type organisateur de tissu lymphoïde après activation via des signaux dérivés de la plaque (➊) et se transdifférencient ensuite en cellules de type LTo (➋). Au moyen de leur phénotype prolifératif et exprimant les cytokines, ils affectent la restructuration et la sculpture de l’adventice, y compris l’angiogenèse, la formation du VHE et la néogenèse des vaisseaux lymphatiques (➌). Le changement de phénotype entraîne également l’expression et la sécrétion de chimiokines lymphorganogènes, c’est-à-dire CXCL13 et CCL21, favorisant ainsi la formation d’ATLO représentée schématiquement dans la partie inférieure du graphique (➍). Vieillissement ou Chronicité ou les deux ?
- Les structures adventices nouvellement formées Participent à la fonction atlo en Favorisant la Recirculation des lymphocytes
- La formation d’Atlo est Hautement territorialisée, Ce qui Indique que les Signaux sont Transmis des Plaques à l’Adventice par l’intermédiaire de CSV de type Organisateur de tissus lymphoïdes
- Les CMV Contribuent directement à l’Immunité adventice dans l’athérosclérose
- Conclusion
- Contributions des auteurs
- Financement
- Déclaration de conflit d’intérêts
Plasticité des CMV dans la physiologie et la maladie
Les cellules musculaires lisses vasculaires (CMV) sont les principaux constituants des artères de taille moyenne et grande. Bien que les mécanismes de l’athérogenèse restent en grande partie à définir, des études ont démontré que la progression de la maladie implique une diaphonie entre les cellules immunitaires avec des ECS et des VSMC. Certaines de ces interactions favorisent la croissance de la plaque tandis que d’autres atténuent la taille, la composition cellulaire et la stabilité des plaques athérosclérotiques (1, 2) (Figure 1, tableau 1). Les VSM montrent une plasticité remarquable en réponse aux lésions vasculaires, à l’inflammation et à l’accumulation de lipoprotéines au cours de la progression de la maladie via la reprogrammation de l’expression des gènes et un passage à un phénotype prolifératif, pro-migrateur et activé, c’est-à-dire le changement de phénotype (5). Dans la figure 1, nous présentons des commutateurs moléculaires critiques qui ont été proposés comme régulateurs importants de la progression de la maladie (3, 6, 8, 11). Au cours de l’initiation de l’athérosclérose, les monocytes dérivés du sang, qui ont été recrutés dans l’intima, accumulent des lipides leur donnant un aspect mousseux. Ces cellules de mousse contribuent à la formation de stries graisseuses qui constitue le stade le plus précoce et éventuellement réversible des plaques athérosclérotiques. Les stries graisseuses se développent progressivement en athéromes / plaques conduisant finalement à des plaques expansées contenant des CSVM, des lymphocytes T et des cellules myéloïdes (Figure 1) (33). Curieusement, la composition d’une plaque d’athérosclérose plutôt que sa taille détermine sa stabilité, car l’épaisseur du capuchon fibreux et la taille du noyau nécrotique sont des caractéristiques potentielles d’une plaque stable par rapport à une plaque instable, respectivement (4, 9). Les CMV dans la couche intima sont traditionnellement considérés comme bénéfiques pendant l’athérogenèse, car ils produisent des composants de la matrice extracellulaire, favorisant ainsi la formation de capuchons fibreux plus forts, ce qui permet de protéger contre la rupture de la plaque (4, 9). Il est de plus en plus évident que les VSM subissent une pléthore de transformations phénotypiques structurelles et fonctionnelles et peuvent même perdre complètement leurs caractéristiques natives pour acquérir des caractéristiques d’autres types de cellules, y compris les macrophages. Les données indiquent que les CMV peuvent acquérir des phénotypes dichotomiques de type tête de Janus, c’est-à-dire des propriétés pro-vs. anti-athérogènes, en fonction de l’environnement tissulaire et de l’action des facteurs de risque (3). Les CMV libèrent des cytokines pour stimuler les ECS adjacents afin qu’ils expriment des molécules d’adhésion et libèrent des cytokines et/ou améliorent la chimiotaxie des monocytes/macrophages dans la plaque (3, 34, 35) (tableau 1). Ces données indiquent que l’accumulation de CSMV dans la coiffe fibreuse ou l’intima est bénéfique, tandis que leur perte ou leur transition vers un phénotype inflammatoire sont préjudiciables, et que l’équilibre entre la prolifération / migration des CSMV contre la mort / sénescence détermine la stabilité de l’athéroprogression par rapport à la stabilité de la plaque (3). Divers aspects supplémentaires de la biologie de la CMV dans la santé et la maladie ont récemment été couverts par une série d’excellentes critiques (https://academic.oup.com/cardiovascres/issue/114/4) et ne seront pas couverts ici. Ci-dessous, nous concentrons donc notre attention sur le rôle de l’adventice et l’impact potentiel des VSMC dans la formation d’ATLO.

Figure 1. Les phénotypes des CMV au cours de la progression de l’athérosclérose révèlent une plasticité extraordinaire. Les ECS et les VSMC dans les plaques athérosclérotiques montrent des phénotypes activés (➊) (3, 4). Certains des VSMC proviennent des médias après le recrutement dans l’intima; d’autres CSVM peuvent provenir de la moelle osseuse ou provenir de cellules myéloïdes de la circulation (➋) (3). Une fraction des VSMC prolifèrent (➌) (3, 5). Les VSMC sécrètent des composants de la matrice extracellulaire; le facteur de transcription pluripotent, c’est-à-dire Klf4, peut jouer un rôle majeur dans un processus appelé changement de phénotype (➍) (6, 7). Dans les tentatives de protéger la plaque athéroscléreuse de la rupture létale, Oct4 peut contrôler un processus appelé remigration pour former un capuchon fibreux (➎) (4, 8-10). La sénescence et l’apoptose déclenchent la génération de cytokines inflammatoires supplémentaires pour former un noyau nécrotique initiant un cercle vicieux avec des conséquences cliniques mortelles aux derniers stades de la maladie (➏) (3, 4, 11).
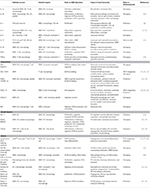
Tableau 1. Médiateurs inflammatoires clés impliqués dans l’immunité à l’athérosclérose médiée par le CMV.
Au cours des deux dernières décennies, il est devenu de plus en plus évident que l’adventice est un tissu hautement complexe et immunologiquement actif abritant des cellules aussi diverses que les cellules stromales, les nerfs, les vaisseaux lymphatiques, le vasa vasora et les leucocytes résidents / cellules progénitrices qui ont toutes la capacité d’influer sur l’évolution de la maladie (36, 37). Nous avons observé que l’adventice des souris ApoE-/- subit des événements de restructuration majeurs à tous les stades de l’athérosclérose: Les cellules immunitaires innées et adaptatives s’accumulent à côté des plaques athérosclérotiques voisines (Figure 2). De plus, nos études sur des souris expérimentales ont été corroborées dans des artères malades humaines: Nous et d’autres avons observé des structures de type ATLO dans l’adventice de patients présentant des anévrismes aortiques athérosclérotiques (38, 39) et plus récemment, Akhavanpoor et al. ATLOs bien développé observé dans l’adventice d’un pourcentage considérable de patients atteints de cardiopathie ischémique (40). Dans l’athérosclérose murine, la néogenèse des vaisseaux lymphatiques, de la veinule endothéliale élevée (VHE) et des vaisseaux sanguins sont des caractéristiques importantes de ce processus de restructuration (16, 41).
FIGURE 2
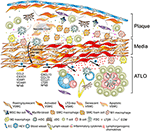
Figure 2. Les cellules musculaires lisses vasculaires (CSVM) participent à l’immunité adventice lors de la formation de la plaque. Les CMV pris en sandwich entre les plaques athérosclérotiques et l’adventice adoptent un phénotype de type organisateur de tissu lymphoïde après activation via des signaux dérivés de la plaque (➊) et se transdifférencient ensuite en cellules de type LTo (➋). Au moyen de leur phénotype prolifératif et exprimant les cytokines, ils affectent la restructuration et la sculpture de l’adventice, y compris l’angiogenèse, la formation du VHE et la néogenèse des vaisseaux lymphatiques (➌). Le changement de phénotype entraîne également l’expression et la sécrétion de chimiokines lymphorganogènes, c’est-à-dire CXCL13 et CCL21, favorisant ainsi la formation d’ATLO représentée schématiquement dans la partie inférieure du graphique (➍).
Vieillissement ou Chronicité ou les deux ?

Figure 2. Les cellules musculaires lisses vasculaires (CSVM) participent à l’immunité adventice lors de la formation de la plaque. Les CMV pris en sandwich entre les plaques athérosclérotiques et l’adventice adoptent un phénotype de type organisateur de tissu lymphoïde après activation via des signaux dérivés de la plaque (➊) et se transdifférencient ensuite en cellules de type LTo (➋). Au moyen de leur phénotype prolifératif et exprimant les cytokines, ils affectent la restructuration et la sculpture de l’adventice, y compris l’angiogenèse, la formation du VHE et la néogenèse des vaisseaux lymphatiques (➌). Le changement de phénotype entraîne également l’expression et la sécrétion de chimiokines lymphorganogènes, c’est-à-dire CXCL13 et CCL21, favorisant ainsi la formation d’ATLO représentée schématiquement dans la partie inférieure du graphique (➍).
Fait important, le vieillissement s’est avéré être un déterminant majeur de la restructuration et de la sculpture de l’adventice. Les ATLOs entièrement développés se forment pendant les stades avancés de l’athérosclérose, mais leurs stades précoces, c’est-à-dire les agrégats de cellules T / B, émergent parallèlement à la formation de plaques athérosclérotiques (16, 27, 41, 42). En effet, ces ATLOs précoces se forment à l’âge de ~ 30 semaines et atteignent des stades plus avancés vers 52 semaines pour culminer à 78 semaines (16, 41). Des stades de développement similaires des ALT dépendants de l’âge ont été observés dans d’autres maladies chroniques non résolubles (1, 42). Ces données indiquent que le développement de l’ATLO dépend de l’âge et que le vieillissement est positivement associé à la sculpture adventitielle (figure 2). Cependant, la relation entre le vieillissement et la chronicité est difficile à étudier dans l’athérosclérose murine car le développement de la plaque athéroscléreuse commence dans l’arc aortique, puis parcourt l’aorte pour atteindre l’aorte abdominale à des stades ultérieurs de la maladie, prenant ainsi de longues périodes de temps. Des travaux supplémentaires sont nécessaires pour clarifier la question importante de savoir si la sénescence des cellules immunitaires et / ou du CMV contribue à la formation d’ATLO et quels types de cellules, c’est-à-dire, les VSMC, les ECS et / ou les cellules immunitaires sont impliqués. Des études sur d’autres formes de formation de TLO, telles que celles qui se produisent dans les poumons et le tractus gastro-intestinal, indiqueraient que c’est la chronicité d’une réaction inflammatoire persistante des tissus plutôt que les événements de vieillissement de bonne foi du système immunitaire qui contribuent de manière cruciale à la formation d’ATLOs (43, 44).
Les structures adventices nouvellement formées Participent à la fonction atlo en Favorisant la Recirculation des lymphocytes
Les stades ATLO avancés comprennent des agrégats de lymphocytes T / B, des centres germinaux dans les follicules de lymphocytes B activés, des vaisseaux lymphatiques, des VHE dans les zones des lymphocytes T et des réseaux de conduits extracellulaires (16). Ces changements majeurs ressemblent à des structures rappelant celles des organes lymphoïdes secondaires où ils favorisent des aspects fondamentaux des réponses immunitaires envers l’antigène, notamment la recirculation de lymphocytes naïfs pour trouver leurs antigènes cognitifs / autoantigènes, et l’organisation de la maturation d’affinité des cellules B vers les autoantigènes potentiels. En utilisant des études de transfert de lymphocytes adoptifs, nous avons observé qu’ATLOs améliore considérablement le recrutement de lymphocytes dans la paroi artérielle en favorisant à la fois l’immigration et l’atténuation concomitante de l’émigration de lymphocytes inexpérimentés en antigène (27). Après leur recrutement, les cellules T s’activent, commencent à proliférer et certaines des cellules auxiliaires T CD4 sont converties en cellules régulatrices T induites. Ces données révèlent que le système immunitaire de l’adventice réagit fortement à la réaction inflammatoire sous-jacente des tissus de la paroi artérielle. De plus, les cellules B qui forment des centres germinaux dans les follicules à cellules B activées semblent subir une réaction de centre germinal en présence de cellules dendritiques folliculaires où certaines sont converties en cellules B mémoire tandis que d’autres quittent les centres germinaux pour devenir des plasmocytes (45). Prises ensemble, ces données indiquent que les ATLOs plutôt que les organes lymphoïdes secondaires (comme on le pensait auparavant) organisent l’immunité contre l’athérosclérose.
La formation d’Atlo est Hautement territorialisée, Ce qui Indique que les Signaux sont Transmis des Plaques à l’Adventice par l’intermédiaire de CSV de type Organisateur de tissus lymphoïdes
Un autre aspect de la restructuration de l’adventice au cours de l’athérogenèse est que la formation d’ATLO est hautement territorialisée et se limite en grande partie aux segments adventice adjacents aux plaques athérosclérotiques de l’aorte abdominale chez la souris (16, 45). Les ATLOs ne se trouvent qu’occasionnellement dans l’adventice de l’artère innominée ou de l’arc aortique où l’athérosclérose est la plus importante. Les cellules immunitaires des segments thoraciques de l’aorte sont principalement composées d’agrégats de lymphocytes T par rapport aux ATLOs de l’aorte abdominale (16, 41). Le mécanisme exact de territorialité de la formation d’ATLOs dans l’aorte abdominale est encore inconnu. Les TLOs semblent être une caractéristique de nombreuses maladies inflammatoires chroniques insolubles et sont des caractéristiques importantes des maladies auto-immunes (42). La cellularité et les structures des TLO dans l’athérosclérose sont similaires aux TLO dans de nombreuses autres maladies chroniques, y compris la formation de TLO associée au cancer (46, 47). Le domaine de la biologie de la TLO s’est considérablement élargi ces dernières années, ce qui soulève la possibilité importante que de nouvelles cibles thérapeutiques puissent être identifiées grâce à la compréhension de la fonction de la TLO dans chacune des maladies associées à la TLO. Cependant, les différents types de TLOs révèlent certaines caractéristiques spécifiques à la maladie, qui peuvent éventuellement déterminer si les réponses immunitaires associées sont nocives ou protectrices. De telles caractéristiques spécifiques à la maladie peuvent survenir par l’un de plusieurs mécanismes, y compris la spécificité des organes et la nature des lésions tissulaires (1, 42). Le développement des organes lymphoïdes est un processus complexe qui implique des cellules inductrices du tissu lymphoïde hématopoïétique (LTi), des cellules organisatrices du tissu lymphoïde stromal non hématopoïétique (LTo) et la signalisation LTßR. Nos études in vitro sur les CSV de l’aorte de souris ont indiqué qu’après une stimulation appropriée, elles peuvent servir de cellules de type LTo (20), identifiées à l’origine au cours du développement embryonnaire lors de la formation de tissus lymphoïdes secondaires, y compris les ganglions lymphatiques et la rate (48, 49) (voir ci-dessous). Il est important de noter que les ATLOs semblent impliquer des VSMC en tant que participants importants alors que d’autres TLO impliquent d’autres cellules mésenchymateuses de type LTo (50). Cependant, le dénominateur commun de toutes les formes de TLOS semble être – contrairement aux organes lymphoïdes secondaires – une réaction inflammatoire chronique des tissus qui pousse le système immunitaire à former ces structures lymphoïdes à proximité du tissu malade ou, dans certains cas, à l’intérieur de celui-ci (42, 43).
Les CMV Contribuent directement à l’Immunité adventice dans l’athérosclérose
Compte tenu de la nature hautement territorialisée des ATLOs adjacents aux plaques athérosclérotiques, nous avons estimé que les CMV pouvaient être impliqués dans la formation d’ATLO et, de la même manière, jouer un rôle fonctionnel dans la progression de l’athérosclérose. Les CSV expriment fortement le LTßR de manière constitutive (16), tandis que son ligand LTa1ß2 est exprimé sur diverses cellules immunitaires appelées cellules LTi (51). On suppose que les VSMC sont activés par la voie de signalisation LTßR-LT par les cellules LTi impliquées dans la néogenèse secondaire des tissus lymphoïdes. L’origine de la cellule LTi n’a pas encore été clairement déterminée, bien que les macrophages activés et d’autres cellules immunitaires de la plaque intima soient candidats à cette activité dans la néogenèse LTO. En réponse à des médiateurs cellulaires et solubles, les VSM semblent subir un type distinct de phénotype passant à un phénotype de type LTo par sécrétion paracrine des chimiokines lymphorganogènes, CXCL13 et CCL21, attirant ainsi les cellules immunitaires, par exemple les macrophages / cellules dendritiques, les lymphocytes T et les lymphocytes B vers le milieu adventiste local conduisant à la formation d’ATLO dans l’adventiste (27, 41, 45) (Tableau 1). Un déficit global ou spécifique de LTßR chez des souris ApoE/-hyperlipidémiques âgées a démontré une augmentation de la formation de plaques athérosclérotiques indiquant que le LTßR de VSMC a la capacité d’atténuer le développement de l’athérosclérose dans certaines conditions expérimentales (27). D’autres études, cependant, ont montré que les jeunes souris ApoE−/−LTbR−/−globales maintenues sous un régime riche en graisses (HFD) ont révélé une charge de plaque aortique inférieure à celle de leurs homologues ApoE-/−nourris au régime normal (52). Ces données apparemment contradictoires indiquent que les rôles de LTßR chez les jeunes souris et dans des conditions d’hyperlipidémie excessive peuvent être différents dans les deux modèles. Alternativement, le régime riche en graisses qui conduit à des niveaux dramatiques et éventuellement enivrants de lipides plasmatiques peut être responsable de ces différences. Comme nous n’utilisons pas régulièrement un régime riche en graisses chez les souris ApoE− /−, ces divergences restent des problèmes non résolus bien qu’il ait été démontré que le système immunitaire peut être submergé par des niveaux extrêmes de lipides plasmatiques. Ces données appellent des études supplémentaires pour examiner la base moléculaire de la dichotomie apparente du LTßR dans la progression de l’athérosclérose chez les souris jeunes par rapport aux souris âgées et / ou l’athérosclérose précoce par rapport aux souris avancées. De plus, les macrophages dérivés de la moelle osseuse peuvent fonctionner comme des cellules LTi indépendantes du LTßR et déclencher l’expression de CCL19, CCL20 et CXCL16 par les CSMV (53) (Tableau 1). Ainsi, les VSMC peuvent participer à la formation de TLOS dans l’athérosclérose par régulation à la hausse des chimiokines lymphorganogènes pour favoriser les agrégats de cellules immunitaires dans l’adventice. Comme mentionné ci-dessus, les ATLOs sont fréquents chez les humains accablés par une maladie coronarienne ischémique (40) et dans les anévrismes aortiques athérosclérotiques humains (38, 39). Pris ensemble, l’apparition d’ATLOs chez des souris expérimentales et dans l’athérosclérose humaine soulève des questions importantes concernant la nature de l’athérosclérose en tant que maladie auto-immune: il est concevable que lors de l’athérogenèse des cellules T auto-immunes et des cellules B auto-immunes dirigées contre des auto-antigènes encore à identifier soient générées. L’isolement de tels lymphocytes auto-immunes incluant le séquençage de leurs récepteurs des lymphocytes T et/ou des récepteurs des lymphocytes B permettrait de tester des hypothèses majeures dans l’athérosclérose. En effet, la recherche sur l’athérosclérose subirait un changement majeur et les tests de clones de lymphocytes auto-immunes individuels dans des systèmes fonctionnels in vitro et in vivo deviendraient possibles.
Conclusion
L’athérosclérose est une maladie inflammatoire des artères. Les VSMC communiquent à la fois avec les ECS et les cellules immunitaires des plaques athérosclérotiques et des cellules résidentes de l’adventice. Cette capacité permet aux VSMCS d’affecter l’immunité contre l’athérosclérose de manière majeure, y compris la formation d’ATLOs. D’autres travaux sont nécessaires pour délimiter le rôle des CMV à différents stades de l’athérosclérose, déterminer leur rôle dans les artères jeunes par rapport au vieillissement et élucider davantage leurs rôles dichotomiques dans la progression de la maladie. Une meilleure compréhension de ces processus peut ouvrir la voie à l’élaboration de stratégies thérapeutiques pour une intervention future dans les stades avancés cliniquement importants de la maladie.
Contributions des auteurs
Tous les auteurs ont contribué à la conception, à la rédaction et à l’édition du manuscrit soumis et l’ont approuvé pour publication.
Financement
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
4. Clarke MC, Figg N, Maguire JJ, Davenport AP, Goddard M, Littlewood TD et coll. L’apoptose des cellules musculaires lisses vasculaires induit des caractéristiques de vulnérabilité de la plaque dans l’athérosclérose. Nat Med. (2006) 12:1075–80. doi: 10.1038/nm1459
Résumé PubMed | Texte intégral CrossRef / Google Scholar
5. Il s’agit de l’un des plus grands noms de la musique. Régulation moléculaire de la différenciation des cellules musculaires lisses vasculaires dans le développement et la maladie. Physiol Rév. (2004) 84:767-801. doi: 10.1152 / physrev.00041.2003
Résumé PubMed / Texte intégral CrossRef / Google Scholar
6. Shankman LS, Gomez D, Cherepanova OA, Salmon M, Alencar GF, Haskins RM, et al. La modulation phénotypique KLF4-dépendante des cellules musculaires lisses joue un rôle clé dans la pathogenèse de la plaque athéroscléreuse. Nat Med. (2015) 21:628–37. doi: 10.1038/nm.3866
Résumé PubMed / Texte intégral CrossRef / Google Scholar
7. Gomez D, Owens GK. Commutation phénotypique des cellules musculaires lisses dans l’athérosclérose. Cardiovasc Res. (2012) 95:156-64. doi: 10.1093/cvr/cvs115
Résumé PubMed / Texte intégral Croisé / Google Scholar
8. Cherepanova OA, Gomez D, Shankman LS, Swiatlowska P, Williams J, Sarmento DE, et al. L’activation du facteur de pluripotence OCT4 dans les cellules musculaires lisses est athéroprotectrice. Nat Med. (2016) 22:657–65. doi: 10.1038/nm.4109
Résumé PubMed / Texte intégral CrossRef / Google Scholar
10. Yla-Herttuala S, Bentzon JF, Daemen M, Falk E, Garcia-Garcia HM, Herrmann J, et al. Stabilisation des plaques athérosclérotiques. Prise de position du Groupe de travail de la Société européenne de cardiologie (ESC) sur l’athérosclérose et la biologie vasculaire. Thrombus Haemost. (2011) 106:1–19. doi: 10.1160 / TH10-12-0784
Résumé PubMed / Texte intégral CrossRef / Google Scholar
11. Grootaert MOJ, Moulis M, Roth L, Martinet W, Vindis C, Bennett MR, et al. Mort des cellules musculaires lisses vasculaires, autophagie et sénescence dans l’athérosclérose. Cardiovasc Res. (2018) 114:622-34. doi: 10.1093/cvr/cvy007
Résumé PubMed / Texte intégral Croisé / Google Scholar
14. Akhavanpoor M, Akhavanpoor H, Gleissner CA, Wangler S, Doesch AO, Katus HA, et al. Les deux Faces de l’Interleukine-17A dans l’athérosclérose. Cibles Médicamenteuses Curr. (2017) 18:863–73. doi: 10.2174/1389450117666161229142155
Résumé PubMed / Texte intégral CrossRef / Google Scholar
15. Jia G, Cheng G, Gangahar DM, Agrawal DK. Le facteur de croissance analogue à l’insuline-1 et le TNF-alpha régulent l’autophagie par les voies de la kinase N-terminale C-jun et de l’Akt dans les cellules lisses vasculaires athéroscléreuses humaines. Biol de cellules d’Immunol. (2006) 84:448–54. doi: 10.1111/j.1440-1711.2006.01454.x
Résumé PubMed / Texte intégral Croisé / Google Scholar
16. Grabner R, Lotzer K, Dopping S, Hildner M, Radke D, Beer M, et al. La signalisation des récepteurs bêta des lymphotoxines favorise l’organogenèse lymphoïde tertiaire dans l’adventice de l’aorte des souris ApoE−/−âgées. J Exp Med. (2009) 206:233–48. doi: 10.1084/jem.20080752
CrossRef Texte intégral / Google Scholar
17. Damas JK, Smith C, Oie E, Fevang B, Halvorsen B, Waehre T, et al. Expression améliorée des chimiokines homéostatiques CCL19 et CCL21 dans l’athérosclérose clinique et expérimentale: rôle pathogène possible dans la déstabilisation de la plaque. Thrombus Artérioscler Vasc Biol. (2007) 27:614–20. doi: 10.1161/01.VTT.0000255581.38523.7c
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doring Y, Noels H, van der Vorst EPC, Neideck C, Egea V, Drechsler M, et al. Vascular CXCR4 limits atherosclerosis by maintaining arterial integrity: evidence from mouse and human studies. Circulation. (2017) 136:388–403. doi: 10.1161/CIRCULATIONAHA.117.027646
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Akhtar S, Gremse F, Kiessling F, Weber C, Schober A. CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells in Apoe-deficient mice. Arterioscler Thromb Vasc Biol. (2013) 33:679–86. doi: 10.1161/ATVBAHA.112.301162
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lotzer K, Dopping S, Connert S, Grabner R, Spanbroek R, Lemser B, et al. Mouse aorta smooth muscle cells differentiate into lymphoid tissue organizer-like cells on combined tumor necrosis factor receptor-1/lymphotoxin beta-receptor NF-kappaB signaling. Arterioscler Thromb Vasc Biol. (2010) 30:395–402. doi: 10.1161 / ATVBAHA.109.191395
Résumé PubMed / Texte intégral Croisé / Google Scholar
21. Smedbakken LM, Halvorsen B, Daissormont I, Ranheim T, Michelsen AE, Skjelland M, et al. Augmentation des niveaux de la chimiokine homéostatique CXCL13 dans l’athérosclérose humaine – rôle potentiel dans la stabilisation de la plaque. Athérosclérose. (2012) 224:266–73. doi: 10.1016 / j. athérosclérose.2012.06.071
CrossRef Texte intégral / Google Scholar
22. Higashi Y, Sukhanov S, Shai SY, Danchuk S, Tang R, Snarski P, et al. Une carence en récepteurs du facteur de croissance 1 analogue à l’insuline dans les macrophages accélère l’athérosclérose et induit un phénotype de plaque instable chez les souris déficientes en apolipoprotéine E. Circulation. (2016) 133:2263–78. doi: 10.1161 / CIRCULATIONAHA.116.021805
Résumé PubMed / Texte intégral Croisé / Google Scholar
23. Alexander MR, Owens GK. Contrôle épigénétique de la différenciation des cellules musculaires lisses et de la commutation phénotypique dans le développement vasculaire et la maladie. Annu Rev Physiol. (2012) 74:13–40. doi: 10.1146 / annurev-physiol-012110-142315
Résumé PubMed / Texte intégral Croisé / Google Scholar
24. Il C, Medley SC, Hu T, Hinsdale ME, Lupu F, Virmani R, et al. La signalisation PDGFRbeta régule l’inflammation locale et se synergise avec l’hypercholestérolémie pour favoriser l’athérosclérose. Nat Commun. (2015) 6:7770. doi: 10.1038 / ncomms8770
Résumé publié / Texte intégral croisé / Google Scholar
26. Da Ros F, Carnevale R, Cifelli G, Bizzotto D, Casaburo M, Perrotta M, et al. Le ciblage de l’Interleukine-1beta Protège des Anévrismes Aortiques Induits par la Signalisation Bêta du Facteur de Croissance Transformant Perturbé. Immunité. (2017) 47:959-73 e9. doi: 10.1016/j.immuni.2017.10.016
CrossRef Texte intégral / Google Scholar
27. Hu D, Mohanta SK, Yin C, Peng L, Ma Z, Srikakulapu P, et al. Les organes lymphoïdes tertiaires des artères contrôlent l’immunité de l’aorte et protègent contre l’athérosclérose via les récepteurs bêta des lymphotoxines des cellules musculaires lisses vasculaires. Immunité. (2015) 42:1100–15. doi: 10.1016/j.immuni.2015.05.015
Résumé PubMed / Texte intégral CrossRef / Google Scholar
29. Paramel Varghese G, Folkersen L, Strawbridge RJ, Halvorsen B, Yndestad A, Ranheim T, et al. NLRP3 expression et activation de l’inflammasome dans l’athérosclérose humaine. J’ai le Cœur Associé. (2016) 5: e003031. doi: 10.1161/JAHA.115.003031
CrossRef Texte intégral / Google Scholar
30. de Jong RJ, Paulin N, Lemnitzer P, Viola JR, Winter C, Ferraro B, et al. Aptitude protectrice de l’annexine A1 dans la formation de néointima artériel chez des souris sujettes à l’athérosclérose – bref rapport. Thrombus Artérioscler Vasc Biol. (2017) 37:312–5. doi: 10.1161 / ATVBAHA.116.308744
CrossRef Texte intégral / Google Scholar
32. van Gils JM, Derby MC, Fernandes LR, Ramkhelawon B, Ray TD, Rayner KJ, et al. Le repère de guidage neuroimmune netrin-1 favorise l’athérosclérose en inhibant l’émigration des macrophages des plaques. Nat Immunol. (2012) 13:136–43. doi: 10.1038/ni.2205
CrossRef Texte intégral / Google Scholar
35. Tchkonia T, Zhu Y, van Deursen J, Campisi J, Kirkland JL. Sénescence cellulaire et phénotype sécrétoire sénescent : possibilités thérapeutiques. J Clin Invest. (2013) 123:966–72. doi: 10.1172/JCI64098
Résumé PubMed / Texte intégral Croisé / Google Scholar
37. Majesky MW, Horita H, Ostriker A, Lu S, Regan JN, Bagchi A, et al. Les cellules musculaires lisses différenciées génèrent une sous-population de cellules progénitrices vasculaires résidentes dans l’adventice régulée par Klf4. Circ Res. (2017) 120:296-311. doi: 10.1161/ CIRCRESAHA.116.309322
Résumé PubMed / Texte intégral CrossRef / Google Scholar
40. Akhavanpoor M, Gleissner CA, Akhavanpoor H, Lasitschka F, Doesch AO, Katus HA, et al. Classification des organes lymphoïdes tertiaires adventitiels dans l’athérosclérose humaine. Pathol Cardiovasque. (2018) 32:8–14. doi: 10.1016/ j. carpath.2017.08.002
Résumé PubMed / Texte intégral CrossRef / Google Scholar
41. Moos MP, John N, Grabner R, Nossmann S, Gunther B, Vollandt R, et al. L’adventice de la lamina est le principal site d’accumulation de cellules immunitaires chez les souris déficientes en apolipoprotéine E standard nourries en chow. Thrombus Artérioscler Vasc Biol. (2005) 25:2386–91. doi: 10.1161/01.VTT.0000187470.31662.fe
Résumé PubMed / Texte intégral CrossRef / Google Scholar
42. Mohanta SK, Yin C, Peng L, Srikakulapu P, Bontha V, Hu D, et al. Les organes lymphoïdes tertiaires des artères contribuent aux réponses immunitaires innées et adaptatives dans l’athérosclérose avancée de la souris. Circ Res. (2014) 114:1772-87. doi: 10.1161/ CIRCRESAHA.114.301137
Résumé PubMed / Texte intégral CrossRef / Google Scholar
43. Buettner M, Lochner M. Développement et fonction des organes lymphoïdes secondaires et tertiaires dans l’intestin grêle et le côlon. Immunol avant. (2016) 7:342. doi: 10.3389 / fimmu.2016.00342
Résumé PubMed / Texte intégral CrossRef / Google Scholar
45. Srikakulapu P, Hu D, Yin C, Mohanta SK, Bontha SV, Peng L, et al. Les organes lymphoïdes tertiaires des artères contrôlent les réponses des cellules B de l’athérosclérose territorialisée à plusieurs couches chez des souris ApoE–/– âgées. Thrombus Artérioscler Vasc Biol. (2016) 36:1174–85. doi: 10.1161 / ATVBAHA.115.306983
CrossRef Texte intégral / Google Scholar
48. van de Pavert SA, Mebius RE. De nouvelles perspectives sur le développement des tissus lymphoïdes. Nat Rev Immunol. (2010) 10:664–74. doi: 10.1038/nri2832
CrossRef Texte intégral / Google Scholar
50. Barone F, Gardner DH, Nayar S, Steinthal N, Buckley CD, Luther SA. fibroblastes stromaux dans les structures lymphoïdes tertiaires: une nouvelle cible dans l’inflammation chronique. Immunol avant. (2016) 7:477. doi: 10.3389 / fimmu.2016.00477
Résumé PubMed / Texte intégral CrossRef / Google Scholar
51. Scandella E, Bolinger B, Lattmann E, Miller S, Favre S, Littman DR, et al. Restauration de l’intégrité des organes lymphoïdes par l’interaction des cellules inductrices de tissus lymphoïdes avec le stroma de la zone des lymphocytes T. Nat Immunol. (2008) 9:667–75. doi: 10.1038/ni.1605
Résumé PubMed / Texte intégral CrossRef / Google Scholar
52. Il s’agit de l’un des principaux fabricants et fournisseurs de produits de la marque. Deficiency in lymphotoxin beta receptor protects from atherosclerosis in apoE-deficient mice. Circ Res. (2015) 116:e57–68. doi: 10.1161/CIRCRESAHA.116.305723
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Guedj K, Khallou-Laschet J, Clement M, Morvan M, Gaston AT, Fornasa G, et al. M1 macrophages act as LTbetaR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis. Cardiovascular research. (2014) 101:434–43. doi: 10.1093/cvr/cvt263
PubMed Abstract | CrossRef Full Text | Google Scholar