Introduction
Les lésions kystiques dans l’espace péricardique sont une entité rare et comprennent 7% des masses médiastinales et 33% des kystes médiastinaux. L’incidence déclarée de kyste péricardique est de 1 population sur 1 00 000 et la plupart des cas sont détectés incidemment. On les trouve généralement dans la troisième ou la quatrième décennie de la vie et les mâles et les femelles sont également touchés. La plupart des cas sont congénitaux et asymptomatiques, mais des complications potentiellement mortelles peuvent survenir au cours de la maladie. On les retrouve dans la littérature sous différents noms : le kyste pleuropéricardique (Jeaubert de Beaujeu, 1945; Roche, 1954), kyste pleural, kyste péricardique, kyste cœlomique péricardique (Lambert, 1940), kyste d’eau de source (Greenfield, Steinberg et Touroff, 1943), kyste mésothélial (Churchill et Mallory, 1937) et kyste à paroi mince.
Histoire
(Tableau 1) Les rapports préliminaires de kystes péricardiques remontent au milieu du XIXe siècle lorsque les pathologistes ont rencontré les premiers cas lors d’un examen post mortem. Les progrès de l’imagerie radiographique ont rendu possible le diagnostic antémortem et Le Roux a signalé trois cas sur 300 000 personnes lors d’une campagne de radiographie de masse à Édimbourg en 1958. Les progrès de la chirurgie thoracique ont inauguré une nouvelle ère dans la prise en charge de ces lésions et Otto Pickhardt de l’hôpital Lenox Hill a effectué la première résection de kyste péricardique à New York en 1931 chez une femme de 53 ans. La première incidence signalée de diverticule péricardique a été présentée par T. Hart de la Park Street School of Medicine à Dublin, en 1837. Plus tard, il a été constaté que les kystes péricardiques et les diverticules représentent différentes étapes d’une lésion avec une embryogenèse commune. Jusqu’alors, plusieurs cas de kystes péricardiques avaient été rapportés comme diverticules péricardiques et vice versa. Greenfield et coll., a inventé le terme « kystes d’eau de source » en raison de leur paroi mince et transparente et de leur teneur en liquide cristallin. L’approche chirurgicale du kyste péricardique a subi plusieurs modifications depuis lors et actuellement la chirurgie thoracoscopique assistée par vidéo est considérée comme la technique la plus prometteuse dans le diagnostic et la prise en charge des kystes péricardiques.
| Année | Événements |
|---|---|
| 1837 | Première description d’un diverticule péricardique par T. Hart de l’école de médecine de Park Street à Dublin lors de l’autopsie. |
| 1903 | La première série de cas d’autopsie pathoanatomique comprenant 4 diverticules et 1 kyste a été publiée par Rohn, de l’Université Charles de Prague. Première reconnaissance de la relation transformationnelle entre diverticule péricardique et kyste. |
| 1931 | Description de l’aspect radiologique et du diagnostic différentiel des kystes péricardiques par Wallace Yater (Université de Georgetown). |
| 1931 | Première ablation chirurgicale du kyste péricardique par Otto Pickhardt, à l’hôpital Lenox Hill de New York10 |
| 1937 | Premier pneumogramme du kyste péricardique réalisé par E. H. Cushing. |
| 1940 | Adrian Lambert a d’abord suggéré une origine embryologique similaire du kyste péricardique et des diverticules à partir de lacunes mésenchymateuses déconnectées, qui s’unissent plus tard pour former le celome péricardique. |
| 1943 | Première résection d’un diverticule péricardique par Richard Sweet au Massachusetts General Hospital de Boston. |
| 1943 | Greenfield et ses collègues ont introduit le terme « kyste d’eau de source ». |
| 1958 | Le Roux a signalé trois cas sur 300 000 personnes lors d’une campagne de radiographie de masse à Édimbourg. |
Tableau 1: Une brève chronologie des progrès du diagnostic et de la prise en charge du kyste péricardique et du diverticule.
Origine
Les kystes péricardiques sont généralement d’origine congénitale, mais d’autres causes ont également été décrites dans la littérature (tableau 2). Ils résultent généralement de l’échec de la fusion de l’une des lacunes mésenchymateuses qui forment le sac péricardique. Adrian Lambert a suggéré que le kyste ainsi que le diverticule dérivent des lacunes mésenchymateuses déconnectées qui s’unissent plus tard pour former le célome péricardique. Lillie et coll., suggère que le kyste péricardique et les diverticules proviennent tous deux de l’évidement ventral du cœlome péricardique. La persistance de l’évidement forme le diverticule, la constriction de la partie proximale de l’évidement persistant représente soit un diverticule avec un col étroit, soit un kyste en communication avec la cavité péricardique et la fermeture complète de l’évidement proximal forme le kyste péricardique. Le diagnostic prénatal du kyste péricardique est possible avec un examen échographique au-delà de la 14e semaine et des cas de régression spontanée ont également été décrits dans la littérature. Des kystes inflammatoires et des pseudocystes apparaissent en raison d’un effusion péricardique loculée6. Le kyste hydatique isolé du péricarde est extrêmement rare et on le trouve généralement en association avec un kyste myocardique ou un kyste ailleurs dans le corps.
1.Congénitale
2.Inflammatoire: Péricardite rhumatismale, Infection bactérienne en particulier la tuberculose, l’Échinococcose
3.Traumatique
4.Chirurgie post-cardiaque
Tableau 2: Étiologie du cyst péricardique 6.
Présentation clinique
Les patients atteints de kystes péricardiques sont généralement asymptomatiques (jusqu’à 60-75% des cas) et le diagnostic est généralement une découverte accidentelle dans la radiographie thoracique. Les symptômes apparaissent généralement lorsque le kyste se comprime sur une structure voisine. Les symptômes courants comprennent une toux chronique, des douleurs thoraciques, une dyspnée et une sensation de pression rétrosternale. Abdul-Mannan Masood et ses collègues ont décrit un cas de gros kyste péricardique (11 cm x 11 cm) se plaignant d’une gêne à l’épaule droite irradiant vers l’épaule gauche, culminant dans la zone sous-cutanée avec essoufflement. Des crises récurrentes de palpitations dues à des dysrythmies cardiaques et à des infections fréquentes des voies respiratoires inférieures ont également été décrites dans la littérature. La présentation inhabituelle du kyste péricardique comprend une syncope récurrente, une pneumonie, une insuffisance cardiaque congestive et une mort cardiaque subite.
Diagnostic
Pour le diagnostic du kyste péricardique et le différencier des autres maladies se présentant comme une ombre kystique isolée adjacente au cœur dans la radiographie pulmonaire (Figure 1) une imagerie supplémentaire est nécessaire. Les résultats de différentes modalités d’imagerie sont présentés dans le tableau 3. La tomographie informatisée (tomodensitométrie) (Figures 2A et Figure 2B) est considérée comme la meilleure modalité de diagnostic et de suivi car elle fournit une excellente délimitation de l’anatomie péricardique et peut aider à la localisation et à la caractérisation précises de diverses lésions péricardiques, y compris l’épanchement, l’épaississement péricardique, les masses péricardiques et les anomalies congénitales. Des inexactitudes surviennent lorsque le kyste se trouve dans un endroit inhabituel ou que la teneur en protéines du liquide kystique est élevée. Il ne peut pas distinguer les tissus malins des kystes remplis de liquide non malins avec un grand degré de confiance. L’imagerie par résonance magnétique est une autre modalité d’imagerie utile et le fluide dans le kyste péricardique produit un signal hyperintense sur les images IRM pondérées en T2 et des signaux hypointense sur les images pondérées en T1. Une teneur élevée en protéines peut également fausser les images IRM car elles diminuent les signaux IRM pondérés par T2 et augmentent les signaux pondérés par T1. En conséquence, différencier ces lésions des hématomes ou des néoplasmes peut être assez difficile. L’IRM pondérée par diffusion peut être utile dans certains cas. L’échocardiographie et l’échographie sont également utiles pour l’évaluation de l’état fonctionnel du cœur et le suivi. L’échocardiographie n’est pas préférée comme modalité diagnostique primaire en raison de la fenêtre étroite de visualisation et des kystes sur des sites inhabituels peuvent être manqués dans cette technique. Les caractéristiques du kyste péricardique dans différentes modalités d’imagerie ainsi que leurs avantages et leurs inconvénients sont décrits dans le tableau 3 et le diagnostic différentiel est décrit dans le tableau 4.
| CTscan | Caractéristiques: Masses homogènes ovales à parois minces simples, nettement définies, sans cloison ni composant solide. Pas d’amélioration avec contraste intraveineux Avantage: Absence d’artefact de mouvement – image claire et nette Temps d’acquisition court Inconvénient: Signalement erroné si la teneur en protéines du liquide est augmentée. Par exemple, Infection, hémorragie Rayonnement Manque d’évaluation fonctionnelle Contraste iodé Besoin de retenue respiratoire Remarques: Meilleure modalité de diagnostic |
| IRM cardiaque | Caractéristiques: Signal d’intensité intermédiaire à faible sur les séquences pondérées en T1 et d’intensité élevée sur les séquences pondérées en T2. Pas d’amélioration avec contraste intraveineux Avantage: Excellente architecture des tissus mous Inconvénient: Temps Coût élevé Signalisation altérée si la teneur en protéines des kystes est élevée Calcification moins bien visualisée Patient stable seulement Remarques: Meilleure modalité de diagnostic si la tomodensitométrie n’est pas concluante |
| Échocardiographie et échographie | Caractéristiques: Une masse écholucente homogène avec une atténuation mineure des ultrasons à travers une structure remplie de fluide de faible densité. Il existe également un espace sans écho indiquant sa séparation des chambres cardiaques. Avantage: Sûr Faible coût Peut être réalisé sur des patients instables Inconvénient: Fenêtres limitées, champ de vision étroit Difficultés techniques en cas d’obésité, de maladie pulmonaire obstructive ou de chirurgie immédiatement post-cardiothoracique Localisation du kyste à un endroit peu fréquent difficile Dépendant de l’opérateur Remarques: Meilleure modalité de diagnostic pour le suivi et l’aspiration percutanée guidée par l’image |
Tableau 3: Modalités d’imagerie dans le kyste péricardique.
| Lésion | Caractéristique différenciante |
|---|---|
| Kystes bronchiques | Tapissés d’épithélium bronchique |
| Épanchement péricardique localisé | Fluide entre le péricarde viscéral et le péricarde pariétal |
| Tératome | Généralement associé à certains composants solides avec des composants kystiques |
| Kyste neuroentérique | Situé dans la poitrine postérieure droite et associé à des anomalies vertébrales |
| Lymphangiome | Kystes multiloculaires ou multiples |
| Kystes congénitaux d’origine primitive (kyste bronchogénique, kyste gastro-entérique et kyste de duplication œsophagienne) | Habituellement situés dans le médiastin postérieur et tapissés par l’épithélium respectif |
Tableau 4: Diagnostic différentiel de l’ombre kystique isolée adjacente au cœur.
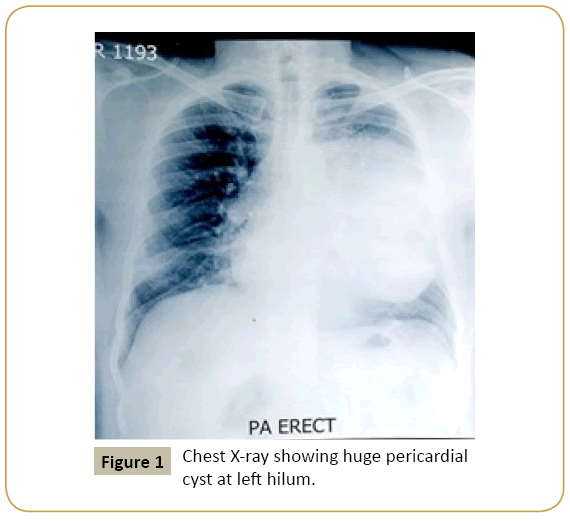
Figure 1: Radiographie thoracique montrant un énorme kyste péricardique au niveau du hile gauche.
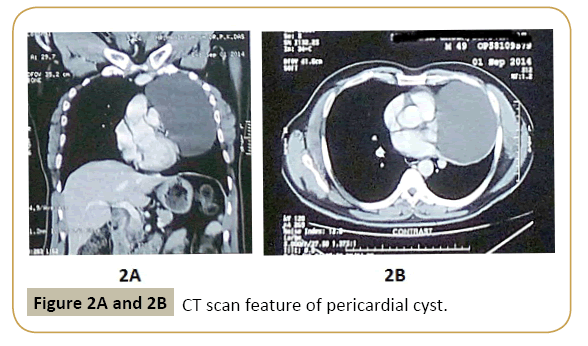
Figure 2A et 2B: Caractéristique de tomodensitométrie du kyste péricardique.
Complication
Les kystes péricardiques sont généralement de nature bénigne, mais des complications peuvent éventuellement survenir sous forme de compression, d’inflammation, d’hémorragie ou de rupture. Les symptômes apparaissent généralement en présence de complications. Julius Chacha Mwita et coll., a rapporté un cas d’une femme de 22 ans avec un gros kyste péricardique (15 cm x 10 cm) se comprimant sur l’oreillette droite et le ventricule, entraînant une insuffisance cardiaque droite. Le patient présentait une pression veineuse jugulaire élevée, un œdème bilatéral de la pédale de piqûre, des veines superficielles engorgées dans le membre inférieur, une ascite, une hépatomégale, une varicocèle gauche et un souffle d’éjection systolique de grade 2/6 sur le précordium. L’électrocardiographie a détecté une déviation de l’axe droit et un bloc de branche droit incomplet. En échocardiographie, la veine cave inférieure et les veines hépatiques ont été dilatées sans variation respiratoire de la taille de la veine cave inférieure. Pankaj Kaul et ses collègues ont décrit un cas de kyste péricardique bénin massif chez une femme de 66 ans présentant une tachycardie, une dyspnée engorgée dans la veine du cou, une décoloration violette du visage, un gonflement du visage et du cou et une respiration sifflante sur toute la poitrine droite. La tomodensitométrie, l’IRM cardiaque et l’échocardiographie ont révélé une compression du kyste sur le hile droit, l’oreillette droite, le ventricule droit, la veine cave supérieure, le lobe moyen et le segment basal antérieur du lobe inférieur du poumon. L’ablation chirurgicale du kyste a été abordée par une sternotomie médiane. Une hémorragie dans le kyste péricardique peut survenir spontanément ou à la suite d’un traumatisme externe. Une hémorragie peut provoquer une expansion rapide et soudaine du kyste et peut aboutir à une douleur intense, une tamponnade cardiaque et une insuffisance cardiaque congestive (tableau 5).
1. Complication due à la compression de la structure environnante * Compression cardiaque
2. Inflammation: Péricardite, kyste péricardique infecté
3. Tamponnade cardiaque * Rupture intrapéricardique
4. Mort subite
5. Autres * Fibrillation auriculaire
Tableau 5: Complication du kyste péricardique.
Prise en charge
La prise en charge des kystes péricardiques est similaire à celle de la masse médiastinale et doit suivre une approche algorithmique (Figure 3). Les stratégies sont une gestion conservatrice avec suivi, aspiration percutanée et chirurgie. Les données concernant la sécurité d’une prise en charge prudente font défaut et un suivi fréquent par imagerie impose de l’anxiété et un fardeau financier supplémentaire aux patients. Le groupe de travail sur le diagnostic et la prise en charge des maladies péricardiques de la société européenne de cardiologie a recommandé l’aspiration percutanée et la sclérose à l’éthanol comme traitement initial des kystes congénitaux et inflammatoires. La thoracotomie assistée par vidéo ou la résection chirurgicale sont recommandées comme traitement de deuxième intention. Kinoshita et coll., a rapporté un cas d’un patient de 41 ans traité avec une sclérose à l’éthanol et aucune récidive n’a été constatée dans un suivi de 6 mois. Cependant, les données concernant l’innocuité, l’efficacité et le suivi à long terme de cette technique sont insuffisantes pour soutenir cette technique en tant que traitement de première intention pour tous les cas. Les auteurs recommandent une approche algorithmique à ces patients basée sur la présence ou l’absence de symptômes, la taille de la masse, la compression sur les structures environnantes et l’inquiétude du patient. La chirurgie est recommandée chez les patients symptomatiques, les gros kystes, les caractéristiques radiologiques de compression ou de compression imminente des structures vitales, l’incertitude du potentiel malin et la prévention des urgences potentiellement mortelles telles que la tamponnade cardiaque, l’obstruction de la bronche principale droite et la mort subite. La chirurgie thoracoscopique assistée par vidéo est associée à moins de traumatismes et à une récupération postopératoire précoce. Les auteurs préfèrent l’échocardiographie à la tomodensitométrie pour le suivi de l’absence de rayonnement ionisant et recommandent de réserver la tomodensitométrie aux cas suspectés de complications. Aucun traitement ne peut être nécessaire chez les patients asymptomatiques. L’algorithme de gestion est décrit à la figure 3.
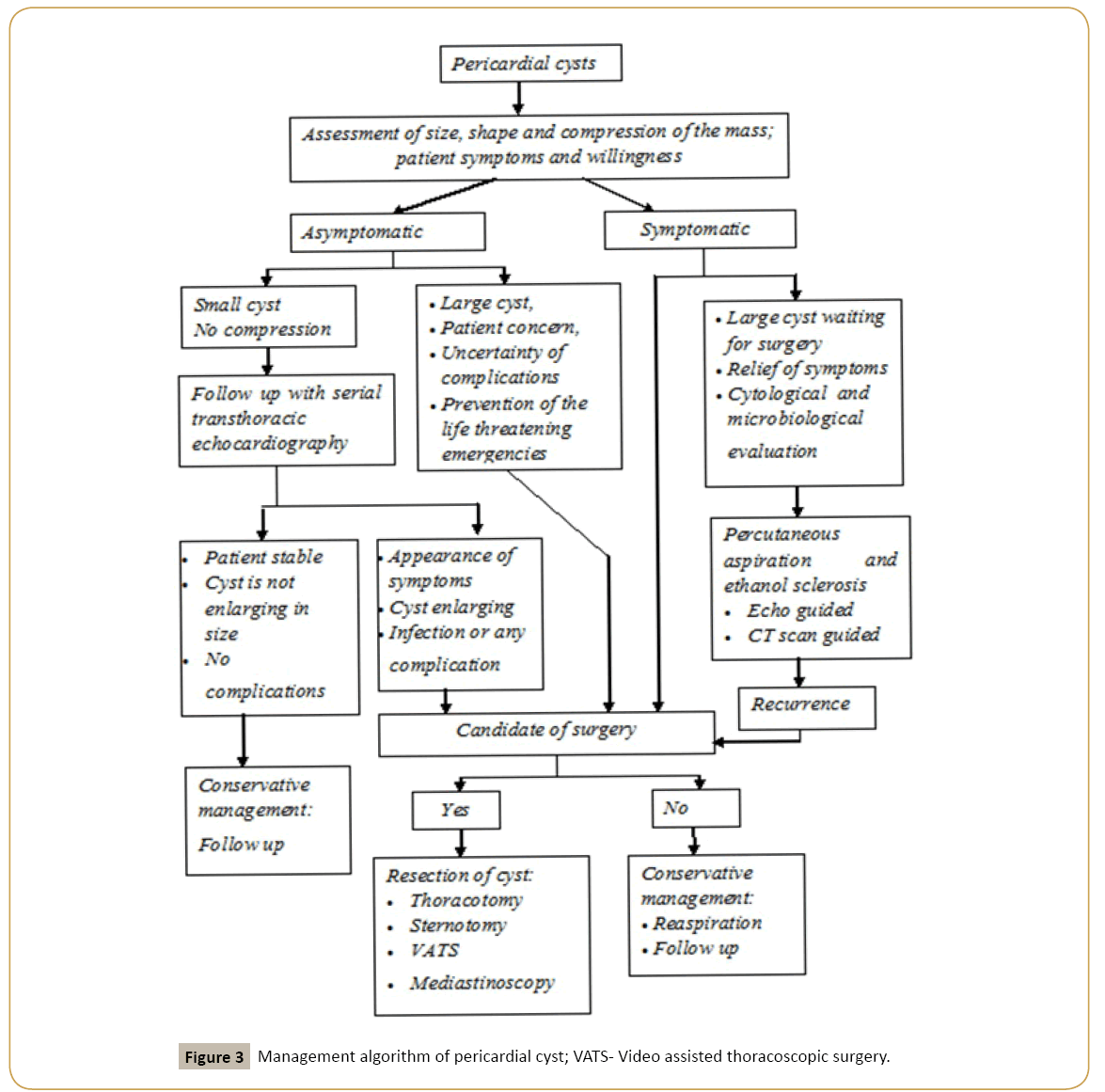
Figure 3: Algorithme de prise en charge du kyste péricardique; VATS – Chirurgie thoracoscopique assistée par vidéo.
Conclusion
Le kyste péricardique et le diverticule ont une origine développementale similaire et peuvent apparaître comme une découverte accidentelle dans la radiographie thoracique chez un patient asymptomatique. Les auteurs recommandent la tomodensitométrie comme modalité diagnostique de choix dans tous les cas et l’IRM cardiaque pondérée par diffusion pour les cas de confusion diagnostique. L’échocardiographie fournit une fenêtre étroite et des lésions à des endroits inhabituels peuvent être manquées avec cette technique. Les auteurs recommandent l’échocardiographie pour le suivi et l’aspiration guidée par l’image du kyste. Le protocole de gestion est similaire à celui de la masse médiastinale. Les gros kystes doivent être aspirés pour réduire le volume et donc l’effet compressif, puis réséqués chirurgicalement. Une approche algorithmique doit être suivie pour la prise en charge en fonction de la taille, de la forme et de la compressibilité de la masse, des symptômes du patient, de l’aptitude chirurgicale et des préférences du patient.
- Cohen AJ, Thompson L, Edwards FH, Bellamy RF (1991) Kystes primaires et tumeurs du médiastin. Ann ThoracSurg 51:378-384.
- Davis RD, Oldham HN, Sabiston DC (1987) Kystes primaires et néoplasmes du médiastin: changements récents dans la présentation clinique, les méthodes de diagnostic, la prise en charge et les résultats. Ann ThoracSurg 44:229-237.
- Unverferth DV, Wooley CF (1979) Le diagnostic différentiel des lésions paracardiaques: kystes péricardiques. CathetCardiovascDiagn 5:31-40.
- Patel J, Park C, Michaels J, Rosen S, Kort S (2004) Kyste péricardique: rapports de cas et revue de la littérature. Échocardiographie 21:269-272.
- Elamin WF, Hannan K (2008) Kyste péricardique: une cause inhabituelle de pneumonie. Affaires J 1:26.
- Maisch B, Seferović PM, Ristić AD, Erbel R, RienmÃller R, et al. (2004) Lignes directrices sur le diagnostic et la prise en charge des maladies péricardiques résumé; Le groupe de travail sur le diagnostic et la prise en charge des maladies péricardiques de la société européenne de cardiologie. Cœur Eur J 25:587-610.
- DE ROOVER P, MAISIN J, LACQUET A (1963) Kystes congénitaux pleuropéricardiques. Thorax 18:146-150.
- Schweigert M, Dubecz A, Beron M, Ofner D, Stein HJ (2012) Le conte des kystes d’eau de source: un aperçu historique de la chirurgie des diverticules péricardiques congénitaux et des kystes. Tex Heart Inst J 39:330-334.
- LE ROUX BT (1959) Kystes péricardiques coélomiques. Thorax 14:27-35.
- Pickhardt OC (1933) Kyste pleuro-diaphragmatique. Dans: Transactions de la New York Surgical Society – Réunion déclarée tenue le 1er avril 1933. Ann Surg 99:814-816.
- Hart T (1837) Un compte rendu de hernie pericardii. Dublin J Med Sci 11:365-367.
- Greenfield L, Steinberg L, Touroff AS (1943) Kyste d’eau de source du médiastin. J ThoracSurg 12:495-502.
- Rohn A (1903) Ueberdivertikel – und cystenbildung am perikard. Prag Med Wochschr 28:461-464.
- Yater WM (1931) Kyste du pericardium.Am Cœur J 6:710-712.
- Diverticule du péricarde de Cushing EH (1937). Arch Intern Med 59:56-64.
- Lambert AV (1940) Étiologie des kystes thoraciques à paroi mince. J ThoracSurg 10:1-7.
- MAZER ML (1946) Diverticule péricardique vrai; rapport d’un cas, avec retrait opératoire sûr. Am J Radium de Roentgénol Ther 55:27-29.
- LILLIE WI, McDonald JR, CLAGETT OT (1950) Kystes péricardiques et diverticules péricardiques; un concept d’étiologie et de rapport de cas. J ThoracSurg 20:494-504.
- Lewis KM, Sherer DM, Gonçalves LF, Fromberg RA, Eglinton GS (1996) Diagnostic échographique prénatal à mi-trimestre d’un kyste péricardique. PrénatDiagn 16:549-553.
- Bernasconi A, Yoo SJ, Golding F, Langer JC, Jaeggi ET (2007) Etiology and outcome of prenatally detected paracardial cystic lations: a case series and review of the literature. Échographie ObstétGynécol 29:388-394.
- Dasbaksi K, Haldar S, Mukherjee K, Mukherjee P (2015) Une combinaison rare de kyste hydatique hépatique et péricardique et une revue de la littérature. Int J Surg Case Rep 10:52-55.
- Kosecik M, Karaoglanoglu M, Yamak B (2006) Kyste péricardique hydatique présentant une tamponnade cardiaque. Can J Cardiol 22:145-147.
- Borges AC, Gellert K, Dietel M, Baumann G, Witt C (1997) Insuffisance cardiaque aiguë du côté droit due à une hémorragie dans un kyste péricardique. Ann ThoracSurg 63:845-847.
- Sokouti M, Halimi M, Golzari SE (2012) Kyste péricardique présenté comme une toux chronique: un rapport de cas rare. Tanaffos 11:60-62.
- Mejía Lozano P, Pérez Ortiz E, PuchaesManchón C (2010) Tamponnade cardiaque due à un kyste pleuropéricardique avec cancer du poumon invasif. Arc Bronconeumol 46:658-659.
- Satur CM, Hsin MK, Dussek JE (1996) Kystes péricardiques géants. Ann ThoracSurg 61:208-210.
- Masood AM, Ali OM, Sequeira R (2013) Une cachette dans la doublure: kyste péricardique douloureux. Représentant du cas BMJ 2013.
- Ilhan E, Altin F, Ugur O, Özkara S, Kayacioglu I, et al. (2012) Une présentation inhabituelle du kyste péricardique: syncope récurrente chez un jeune patient. Cardiol J 19:188-191.
- Forouzandeh F, Krim SR, Bhatt R, Abboud LN, Ramchandani M, et al. (2012) Kyste péricardique géant se présentant comme une pneumonie. Tex Heart Inst J 39:296-297.
- Lau CL, Davis RD (2004) Chapitre 56: Le Médiastin, dans le Manuel de chirurgie de Sabiston, (17thedn.) Philadelphie, Elsevier 1738-1739 et 1758.
- Wang ZJ, Reddy GP, Gotway MB, Yeh BM, Hetts SW, et al. (2003) Imagerie par tomodensitométrie et IRM de la maladie péricardique. Radiographies 23 Spec No: S167-180.
- Raja A, Walker JR, Sud M, Du J, Zeglinski M, et al. (2011) Diagnostic des kystes péricardiques à l’aide de l’imagerie par résonance magnétique pondérée par diffusion: Une série de cas. J Med Case Rep 5:479.
- Jeung MY, Gasser B, Gangi A, Bogorin A, Charneau D, et al. (2002) Imagerie des masses kystiques du médiastin. Radiographies 22 Spec No: S79-93.
- Peebles CR, Shambrook JS, Harden SP (2011) Maladie péricardiqueanatomy anatomie et fonction. Br J Radiol 84 Spec No 3: S324-337.
- Verhaert D, Gabriel RS, Johnston D, Lytle BW, Desai MY, et al. (2010) Le rôle de l’imagerie multimodale dans la prise en charge de la maladie péricardique. Imagerie Circcardiovasque 3:333-343.
- Rohn A (1903) Ueberdivertikel – und cystenbildung am perikard. Prag Med Wochschr 28:461-464.
- de Bustamante TD, Azpeitia J, Miralles M, Jiménez M, Santos-Briz A, et al. (2000) Détection échographique prénatale du tératome péricardique. J Clin Ultrasound 28:194-198.
- Mwita JC, Chipeta P, Mutagaywa R, Rugwizangoga B, Ussiri E (2012) Kyste péricardique avec compression ventriculaire droite. Pan Afr Med J 12:60.
- Kaul P, Javangula K, Farook SA (2008) Kyste péricardique bénin massif présentant des syndromes simultanés de la veine cave supérieure et du lobe moyen. J CardiothoracSurg 3:32.
- Marigliano A, Cirio EM, Versace R (2010) Kyste péricardique avec hémorragie intracystichémorragique. Un rapport de cas et une revue de la littérature. G ItalCardiol (Rome) 11:493-497.
- Temizkan V, Onan B, Inan K, Ucak A, Yilmaz AT (2010) Hémorragie dans un kyste péricardique et compression ventriculaire droite associée après un traumatisme thoracique contondant. Ann ThoracSurg 89: 1292-1295.
- Najib MQ, Chaliki HP, Raizada A, Ganji JL, Panse PM, et al. (2011) Kyste péricardique symptomatique: une série de cas. Eur J Echocardiogr 12:E43.
- Martins IM, Fernandes JM, Gelape CL, Braulio R, Silva Vde C, et al. (2011) Un gros kyste péricardique présentant une compression des chambres cardiaques du côté droit. Rev Bras Cir Cardiovasc 26:504-507.
- Lesniak-Sobelga AM, Olszowska M, Tracz W (2008) Kyste péricardique géant comprimant le ventricule droit. Ann ThoracSurg 85:1811.
- McMillan A, Souza CA, Veinot JP, Turek M, Hendry P, et al. (2009) Un gros kyste péricardique compliqué par une péricardite chez un jeune homme avec une masse médiastinale. Ann ThoracSurg 88: e11-13.
- Hoque M, Siripurapu S (2005) Kyste péricardique infecté par Staphylococcus aureus résistant à la méthicilline. Mayo ClinProc 80:1116.
- El Hammoumi MM, Sinaa M, El Oueriachi F, Arsalane A, Kabiri EH (2014). Rév Mal Respir 31:442-446.
- Shiraishi I, Yamagishi M, Kawakita A, Yamamoto Y, Hamaoka K (2000) Tamponnade cardiaque aiguë causée par une hémorragie massive d’un kyste péricardique. Tirage 101: E196-197.
- Kumar Paswan A, Prakash S, Dubey RK (2013) Tamponnade cardiaque par kyste péricardique hydatique: un rapport de cas rare. Douleur anesthésique Med 4: e9137.
- Fredman CS, Parsons SR, Aquino TI, Hamilton WP (1994) Mort subite après un test d’effort chez un patient présentant un gros kyste péricardique. Am Heart J 127:946-950.
- Generali T, Garatti A, Gagliardotto P, Frigiola A (2011) Kyste péricardique mésothélial droit déterminant les arythmies auriculaires intraitables. InteractCardiovascThoracSurg 12:837-839.
- Kar SK, Ganguly T, Dasgupta CS, Goswami A (2014) Considérations cardiovasculaires et respiratoires dans la masse Médiastinale pendant la chirurgie Thoracique. J ClinExpCardiolog 5:354.
- Kinoshita Y, Shimada T, Murakami Y, Sano K, Tanabe K, et al. (1996) La sclérose à l’éthanol peut être un traitement sûr et utile pour le kyste péricardique. ClinCardiol 19:833-835.