Figure 4: Structure de l’œil.Cette image est extraite de Chirstie (réf. 4) et est soumis à des restrictions de droits d’auteur selon la source donnée (c’est-à-dire qu’il ne s’agit pas du propre travail des auteurs).
La structure de l’œil : La zone de l’œil (voir figure 4) qui détecte la lumière et la couleur est la Rétine. Les deux types de cellules de détection présentes, les bâtonnets et les cônes, traitent les informations à travers la Lentille et les envoient dans le nerf optique au cerveau. Les cellules bâtonnets (dont il y en a environ 100 millions) détectent le degré de légèreté entrant dans l’œil et leur sensibilité dépend de la quantité de rhodopsine présente qui est elle-même générée dans les cellules. Cependant, la rhodopsine est détruite par blanchiment lors de l’exposition à la lumière et, par conséquent, les cellules de bâtonnets ne fonctionnent que dans une faible lumière, car à un éclairage élevé, le niveau réduit de ce pigment photosensible conduit à une sensibilité très faible. Les cellules coniques (dont il y en a environ 3 millions) sont également sensibles aux niveaux de lumière mais conservent leur fonction jusqu’à un éclairage élevé via l’utilisation du pigment Iodopsine.La détection de la couleur est fonction des trois types de cellules coniques présentes dans la rétine : entre elles, elles couvrent le spectre visible. C’est parce que chaque type est sensible à une gamme différente de longueurs d’onde avec des maximumscorrespondant au rouge (long), au vert (moyen) ou au bleu (court).
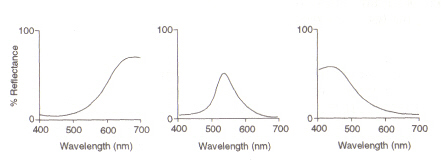
Figure 5: Maximums de cellules coniques rouges, vertes et bleues (à partir de gauche), respectivement. Cette image est extraite de Chirstie (réf. 4) et est limité par le droit d’auteur selon la source donnée (c’est-à-dire qu’il ne s’agit pas de l’œuvre des auteurs).
Le mécanisme de la rhodopsine dans les cellules de la tige: La protéine Rhodopsine contient le complexe de base protonérétinal-Schiff qui se trouve naturellement dans la poche inter-membranaire formée par les sept récepteurs a-hélicoïdaux trans-membranaires. Il existe de nombreux disques plats de rhodopsine dans le segment externe de la cellule arod qui, lors de la détection de la lumière, subissent un changement photo-isomère de la rhodopsine (11-cis) à la rétinienne tout-trans. Après la cascade de photoisomérisation qui se produit via 5 intermédiaires courts (organigramme 1), la rétinienne trans diffuse et est reconvertie en 11-cisrétinal avant de rentrer dans le cycle. Ce processus se produit par réduction du rétinol all-trans suivi d’une oxydation / isomérisation dans l’obscurité. La photoexcitédrhodopsine (4ème des 5 intermédiaires) déclenche un processus en cascade enzymatique se produisant dans l’hydrolyse des BPF. Cela ferme à son tour les canaux spécifiques aux cations dans la membrane cellulaire de la tige qui sont naturellement ouverts à l’afflux de Na + dans l’obscurité et, sous l’effet de l’hyperpolarisation, le corps synatique interne envoie un signal nerveux aux autres neurones de la Rétine. Enfin, la diminution des niveaux de calcium induite par la lumière aide à la récupération des neurones excités dans un état passif « sombre » et le cycle recommence dès la détection de la lumière. Les photorécepteurs des cellules coniques sont également sept récepteurs a-hélicoïdaux avec le 11-cis-rétinien comme chromophore. La plage de détection varie du vert au rouge, car les trois résidus non polaires contenant de l’hydroxyle près du rétinal sont remplacés séquentiellement par des résidus polaires.

Gauche – Figure 6: Position de la rétine 11-cis dans la rhodopsine. Cette image est extraite de Stryer (réf. 6) et est limité par le droit d’auteur selon la source donnée (c’est-à-dire qu’il ne s’agit pas de l’œuvre des auteurs).
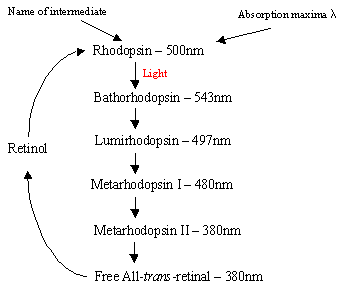
Diagramme de Droite1: Les 5 intermédiaires du cycle de la rhodopsine.
D’où vient la rhodopsine?
Les humains ne peuvent pas fabriquer de la hodopsine, mais ils utilisent une source externe, le b-carotène, que l’on trouve dans les aliments pour la synthétiser:
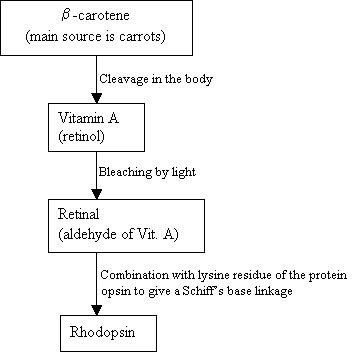 |
Organigramme 2: La synthèse de la rhodopsine Nouvelle image = Figure 7: Les structures du b-carotène (en haut), de la vitamine (au milieu) et de la rétine 11-cis (en bas). |
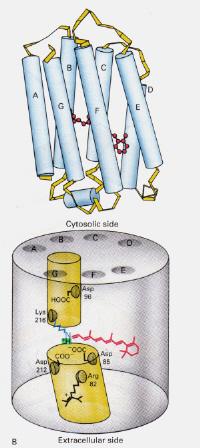
En quoi le mécanisme de la bactériorhodopsine trouvée dans les halobactéries diffère-t-il de celui de la rhodopsine trouvée dansles cellules de l’œil humain?: Cette fois, le complexe de base rétinien-Schiff protoné bloque naturellement un canal à travers la membrane formée par ailleurs de deux chambres adjacentes. Le complexe trans protoné donne un proton à Asp-85, ce qui permet ensuite la sortie de ce même proton du côté extracellulaire. La photoisomérisation en structure 13-cis permet à la base de Schiff de capter un proton du résidu Asp-96 du côté cytosolique. Lors de la réorientation de la forme cis vers la forme trans, le cycle d’isomérisation et de pompage des protons se poursuit.