Les marqueurs tumoraux sont des mesures sériques précieuses dans la discrimination d’une masse annexielle. Cependant, compte tenu de la longue liste parmi laquelle choisir, il peut être déroutant de savoir exactement lequel pourrait le mieux répondre à vos besoins de diagnostic. Les obstétriciens / gynécologues et les médecins de soins primaires me demandent souvent des conseils à ce sujet. Dans cette colonne, j’explorerai certaines des prises de décision que j’utilise pour déterminer quels marqueurs pourraient être les plus utiles pour les patients individuels.
Les marqueurs tumoraux sont généralement ordonnés pour estimer la probabilité de malignité et la nécessité d’une référence à un surspécialiste en oncologie.
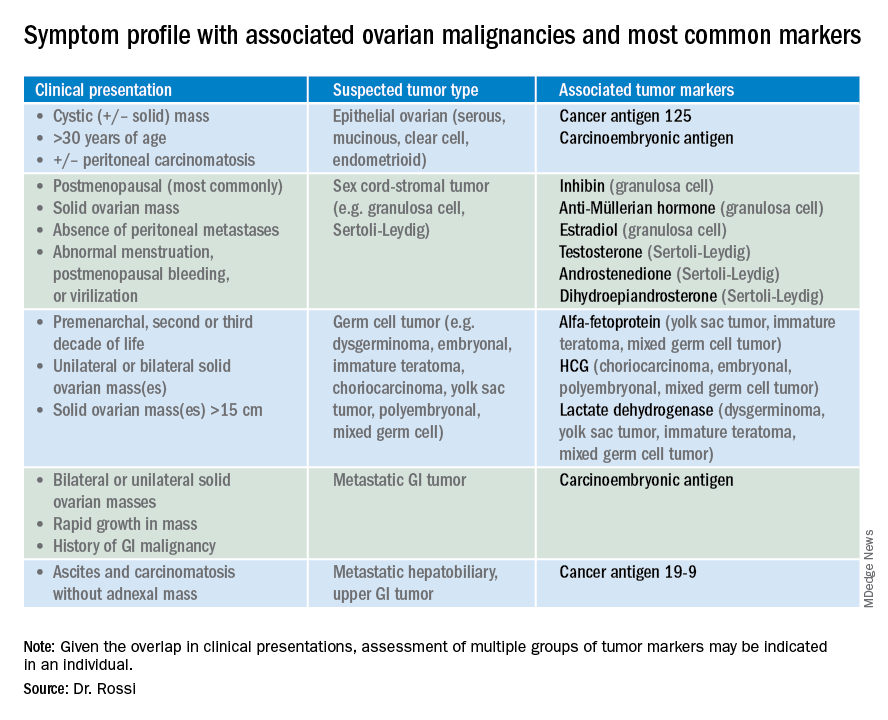
Alors, quels marqueurs tumoraux devez-vous commander lorsque vous avez diagnostiqué une masse annexielle? Étant donné que les profils de marqueurs tumoraux peuvent différer considérablement en fonction du type cellulaire du néoplasme, la première question à se poser est peut-être quelle est la catégorie de néoplasme la plus probable sur la base d’autres données cliniques? Les néoplasmes ovariens entrent dans les sous-groupes suivants: épithéliaux (y compris le type cellulaire le plus courant, le cancer de l’ovaire séreux, mais aussi les tumeurs mucineuses et à faible potentiel malin les moins courantes), les tumeurs stromales du cordon sexuel, les tumeurs des cellules germinales et les tumeurs métastatiques. Le tableau 1 résume les marqueurs tumoraux à considérer en fonction du contexte clinique.
Vous devez suspecter une tumeur épithéliale s’il existe une masse annexielle avec des composants kystiques importants chez les patients âgés ménopausés ou la présence d’une carcinomatose péritonéale à l’imagerie. Les marqueurs tumoraux les plus couramment élevés dans ce contexte clinique sont l’antigène cancéreux 125 (CA 125), l’antigène carcinoembryonique (ACE) et éventuellement le CA 19-9. L’antigène CA 125 est une glycoprotéine dérivée de l’épithélium du péritoine, de la plèvre, du péricarde et des tissus müllériens. Les multiples sites d’origine de cette glycoprotéine témoignent de la faible spécificité associée à son élévation, car elle est bien connue pour être élevée dans les affections bénignes telles que l’endométriose, les fibromes, la grossesse, l’ovulation, la cirrhose et la péricardite ainsi que dans les tumeurs malignes non synécologiques, en particulier celles métastatiques à la cavité péritonéale. Plusieurs dosages différents sont disponibles pour mesurer le CA 125, et chacun est associé à une plage de référence légèrement différente. Par conséquent, si vous mesurez des valeurs en série, il est préférable de les faire évaluer par le même laboratoire. De même, comme il peut être physiologiquement élevé pendant le cycle menstruel, les femmes préménopausées devraient subir des évaluations en série au même moment de leur cycle menstruel ou idéalement au cours des 2 premières semaines de leur cycle.
La sensibilité du CA 125 dans la détection du cancer de l’ovaire n’est que de 78%, ce qui est limité par le fait que tous les types de cellules cancéreuses épithéliales de l’ovaire (y compris certaines cellules claires, carcinosarcomes et mucineuses) n’expriment pas d’élévations dans ce marqueur tumoral, et parce que le CA 125 est élevé dans moins de la moitié des cancers de l’ovaire de stade I.1 Par conséquent, étant donné le manque de sensibilité et de spécificité de ce marqueur tumoral, vous devez intégrer d’autres données cliniques, telles que les résultats d’imagerie, l’âge du patient et les conditions médicales bénignes associées, lors de l’évaluation de la probabilité de cancer. L’American College of Obstetricians and Gynecologists (ACOG) recommande que, dans le cadre d’une masse annexale, l’orientation vers l’oncologie gynécologique soit recommandée lorsque la valeur CA 125 est supérieure à 200 U / mL chez les femmes préménopausées, ou supérieure à 35U / mL chez les femmes ménopausées.2
Le CEA est une protéine qui peut être exprimée dans le côlon mais pas dans d’autres tissus normaux après la naissance et, par conséquent, son élévation est généralement associée à des tumeurs gastro-intestinales métastatiques de l’ovaire et du péritoine, ou à des tumeurs ovariennes mucineuses, y compris des tumeurs borderlines. Les tumeurs gastro-intestinales métastatiques sont généralement suspectées lorsqu’il existe des masses solides ovariennes bilatérales. Les kystes ovariens du côté droit peuvent également être associés à une pathologie appendiculaire et la vérification d’un niveau de CEA peut être envisagée dans ces cas. Je dessinerai généralement à la fois des marqueurs tumoraux CA 125 et CEA dans le cadre de masses ovariennes kystiques + / –solides. Cela permet la reconnaissance des cancers de l’ovaire CA 125-négatifs / CEA-positifs, tels que les tumeurs mucineuses, ce qui facilite la surveillance ultérieure ou augmente ma suspicion pour une tumeur gastro-intestinale occulte (en particulier s’il y a une élévation disproportionnellement plus élevée de CEA que de CA 125).3 Si les profils de marqueurs tumoraux suggèrent une tumeur GI occulte, j’envisagerai souvent une coloscopie préopératoire et une évaluation endoscopique GI supérieure.
CA 19-9 est un marqueur tumoral beaucoup moins spécifique qui peut être élevé dans une variété de tumeurs d’organes solides, y compris les tumeurs pancréatiques, hépatobiliaires, gastriques et ovariennes. Je réserve généralement l’ajout de ce marqueur pour les présentations cliniques atypiques du cancer de l’ovaire, telles que la carcinomatose en l’absence de masses pelviennes.

Dr. Emma C. D
Cordon sexuel ovarien – néoplasmes stromaux le plus souvent présents sous forme de tumeurs solides dans l’ovaire. Le stroma ovarien comprend les fibroblastes fades et les cellules de la granulosa, de Sertoli et de Leydig produisant des hormones. Par conséquent, les tumeurs stromales du cordon sexuel sont généralement associées à des élévations de l’inhibine sérique, de l’hormone anti-müllérienne et potentiellement de l’androstènedione et de la déhydroépiandrostérone.4 Ces tumeurs ont rarement une maladie avancée au diagnostic. Les tumeurs à cellules granuleuses doivent être suspectées chez les femmes présentant une masse ovarienne solide et des saignements utérins anormaux (y compris des saignements post-ménopausiques), et les marqueurs tumoraux appropriés (inhibine et hormone anti-Müllérienne) peuvent guider ce diagnostic en préopératoire.4 Tumeurs stromales sécrétant des androgènes telles que les tumeurs de Sertoli-Leydig présentent souvent une virilisation ou des irrégularités menstruelles. Fait intéressant, ces patients peuvent présenter des symptômes cliniques dramatiques avec des lésions adnexales solides non visibles ou très petites correspondantes observées à l’imagerie. Dans le cas des fibromes, ces tumeurs solides ont des marqueurs tumoraux hormonaux normaux mais peuvent se présenter avec une ascite et des épanchements pleuraux dans le cadre du syndrome de Meigs, ce qui peut confondre le clinicien qui peut suspecter un cancer épithélial de stade avancé d’autant plus que cette affection peut être associée à une élévation du CA 125.
Les tumeurs à cellules germinales constituent l’autre groupe principal de tumeurs ovariennes primaires et expriment généralement fortement des marqueurs tumoraux. Ces tumeurs sont généralement solides et très vascularisées à l’imagerie, peuvent être bilatérales et peuvent être très volumineuses au moment du diagnostic.5 Ils sont le plus souvent unilatéraux et surviennent chez les femmes plus jeunes (y compris généralement dans les deuxième et troisième décennies de la vie). Le tableau 1 montre les différents marqueurs tumoraux associés à différentes tumeurs de cellules germinales. C’est ma pratique de commander un panel de tous ces marqueurs de cellules germinales chez les jeunes femmes avec des masses annexielles solides chez lesquelles des tumeurs de cellules germinales sont suspectées, mais je ne dessinerai pas systématiquement ce panel expansif pour les femmes âgées atteintes de lésions kystiques.
Les panneaux de marqueurs tumoraux (tels que OVA 1, Overa, Algorithme de risque de malignité ou ROMA) sont devenus populaires ces dernières années. Ces panneaux comprennent plusieurs marqueurs sériques (tels que CA 125, la microglobuline bêta-2, la protéine sécrétoire de l’épididyme humain 4, la transferrine, etc.) évalué de concert avec l’objectif d’une évaluation plus nuancée de la probabilité de malignité.6,7 Ces essais sont généralement stratifiés selon l’âge ou le statut ménopausique, compte tenu des différences physiologiques dans les plages de référence normales qui se produisent entre ces groupes. Bien que ces études améliorent la sensibilité et la spécificité de l’identification de la malignité, par rapport aux tests à dosage unique, elles ne sont pas définitivement diagnostiques à cette fin. Par conséquent, je recommande généralement ces tests si un médecin référent a besoin d’une stratification des risques supplémentaire pour déterminer s’il faut ou non consulter un oncologue pour une intervention chirurgicale.
Tous les marqueurs tumoraux n’ont pas la même valeur chez tous les patients présentant une masse annexielle. Je recommande d’examiner attentivement d’autres facteurs cliniques tels que l’âge, l’état de la ménopause, les caractéristiques échographiques et les résultats associés tels que les symptômes gastro-intestinaux ou les manifestations d’altérations hormonales lors de l’examen des marqueurs à évaluer.
Dr. Rossi est professeur adjoint à la division d’oncologie gynécologique de l’Université de Caroline du Nord à Chapel Hill. Elle a dit qu’elle n’avait aucune information financière pertinente. Envoyez-lui un courriel à.