La coloration multicolore avec des colorants fluorescents est activement utilisée pour observer la distribution de matériaux biologiques (tels que les protéines, les lipides, les acides nucléiques et les ions) dans le domaine de la recherche sur les tissus et les cellules. La technologie de détection pour l’observation de la fluorescence a progressé à un niveau auquel une seule molécule de colorant fluorescent peut être détectée dans les meilleures circonstances. Cette section passe en revue plusieurs des aspects importants de la microscopie d’imagerie à vie par fluorescence (FLIM), une nouvelle technologie de microscopie à fluorescence. En plus de la coloration multicolore, l’imagerie de durée de vie de fluorescence peut également être utilisée pour visualiser les facteurs qui affectent les propriétés de durée de vie de fluorescence de la molécule de colorant, c’est-à-dire l’état de l’environnement autour de la molécule.
Spectroscopie de longueur d’onde
La microscopie à fluorescence conventionnelle utilise les propriétés de couleur des colorants fluorescents, c’est-à-dire que l’identification est basée sur des différences de caractéristiques spectrales de fluorescence entre les colorants. Avec cette technique, cinq ou six colorants dans la gamme de longueurs d’onde allant de l’ultraviolet au proche infrarouge peuvent être utilisés simultanément en microscopie sans confusion entre les couleurs.
Spectroscopie à vie
Chaque colorant fluorescent a sa propre durée de vie à l’état excité. En détectant des différences de durée de vie, il est possible de distinguer même des colorants ayant la même couleur fluorescente ainsi que d’identifier l’autofluorescence. De plus, des images signal sur bruit élevées peuvent être obtenues en utilisant une sonde à très longue durée de vie comparée à celle des colorants fluorescents normalement utilisés. Par exemple, la coproporphyrine de platine a une durée de vie de l’ordre de la milliseconde tandis que la durée de vie des colorants fluorescents ordinaires est de l’ordre de la nanoseconde. De tels colorants fluorescents à durée de vie relativement longue seront bientôt utilisés comme sondes pour la détection de l’ADN sur les puces.
L’imagerie à vie par fluorescence permet également d’obtenir des informations sur les molécules tout en observant une cellule vivante. Les facteurs affectant la durée de vie de la fluorescence comprennent l’intensité des ions, les propriétés hydrophobes, la concentration en oxygène, la liaison moléculaire et l’interaction moléculaire par transfert d’énergie lorsque deux protéines s’approchent l’une de l’autre. La durée de vie est cependant indépendante de la concentration du colorant, du photoblanchiment, de la diffusion de la lumière et de l’intensité de la lumière d’excitation. Par conséquent, l’imagerie à durée de vie par fluorescence nous permet d’effectuer une mesure précise de la concentration d’ions et une analyse de Transfert d’énergie par résonance de fluorescence (FRET).
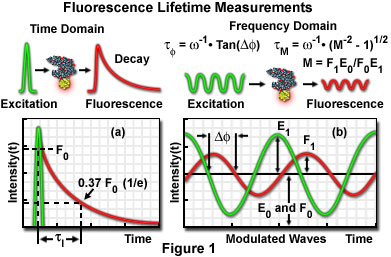
Il existe deux méthodes d’imagerie à durée de vie par fluorescence: la méthode dans le domaine temporel et la méthode dans le domaine fréquentiel.
- FLIM dans le domaine temporel – Dans certains cas de retard après excitation par un laser pulsé, l’image de fluorescence peut être obtenue par l’opération de grille de l’intensificateur d’image. La durée de vie est mesurée en nanosecondes par un laser avec une durée d’impulsion de quelques centaines de picosecondes et un obturateur de niveau nanoseconde car la durée de vie d’un état d’excitation est généralement de 1 à 20 nanosecondes. Un intensificateur d’image de grille à grande vitesse est disponible dans le commerce chez Hamamatsu Photonics K.K. (Hamamatsu, Japon). La durée de vie de fluorescence à chaque pixel peut également être obtenue en mesurant tout en faisant varier le temps de retard jusqu’à l’ouverture d’une porte. Les images de durée de vie de fluorescence sont présentées en pseudocolor en fonction de leur durée de vie.
- La durée de vie de la fluorescence de FLIM dans le domaine fréquentiel est calculée en mesurant le déphasage de la fluorescence et la réduction de son amplitude à l’aide d’un détecteur avec un modulateur de gain lorsque le laser utilisé comme source lumineuse d’excitation est modulé (1 à 200 mégahertz). La mesure peut être effectuée soit par balayage laser (photomultiplicateur), soit à l’aide d’un dispositif à couplage de charge (CCD).
Applications
L’environnement entourant la sonde est détecté sur la base du fait que la durée de vie de fluorescence est sensible à la concentration en ions hydrogène (pH), aux concentrations en ions oxygène et calcium. La liaison ou l’interaction entre les molécules peut également être mesurée en combinaison avec FRET.
Imagerie de concentration en ions calcium
Lorsque l’ion calcium se lie à une sonde fluorescente telle que Fura-2, Fluo-3 ou Vert de calcium, la durée de vie de la fluorescence et l’intensité de la fluorescence changent. La procédure classique de mesure de la concentration ionique se concentre sur le changement d’intensité. En fonction de la variation de la concentration en ions calcium, le rapport des colorants entre l’ion calcium lié et l’ion calcium non lié change, ce qui entraîne par la suite une modification de la durée de vie de fluorescence du point de mesure dans l’échantillon. En plus de la sonde à ions calcium, cette technique est également applicable à la mesure du pH et d’autres ions tels que l’ion sodium et l’ion magnésium.
Transfert d’énergie par résonance de fluorescence (FRET)
Des recherches sont actuellement menées sur le FRET par des variantes de protéines fluorescentes vertes (GFP avec une couleur de fluorescence différente). FRET permet de mesurer les interactions (association ou dissociation) entre deux protéines marquées par une paire de colorants de fluorescence. Un colorant fluorescent donneur a des longueurs d’onde d’excitation / émission plus courtes qui fournissent de l’énergie à un colorant fluorescent accepteur. La durée de vie de l’état d’excitation du colorant donneur est variable selon que l’accepteur (le colorant recevant l’énergie) existe ou non. La mesure basée sur la durée de vie permet une meilleure quantification car il n’est pas nécessaire de considérer le chevauchement de la fluorescence lors de la détection.
Imagerie clinique
Comme certains échantillons de tissus et de cytodiagnostic présentent une forte autofluorescence, l’utilisation de sondes à longue durée de vie (jusqu’à des millisecondes) a été tentée. Les sondes à longue durée de vie sont également utiles en hybridation in situ par fluorescence (FISH) car le nombre de couleurs pouvant être utilisées simultanément est limité avec cette technique. La concentration d’ions hydrogène dans le sang, ainsi que les pressions d’oxygène et de dioxyde de carbone, ont déjà été mesurées sur la base de la durée de vie de fluorescence, bien que de telles mesures ne soient toujours pas possibles en microscopie.
Ressources Internet
- Centre de Spectroscopie de fluorescence – Hébergé par le professeur Joseph R. Lakowicz à l’Université du Maryland, ce site Web est une excellente ressource pour obtenir des informations sur l’imagerie à vie par fluorescence et d’autres aspects de la spectroscopie et de la microscopie de fluorescence.
- Kentech Instruments – Kentech fabrique des générateurs d’impulsions à semi-conducteurs haute tension et des systèmes d’imagerie optique à circuit fermé pour l’imagerie à vie par fluorescence.
- Hamamatsu Photonics – En plus de son excellente gamme de systèmes d’appareils photo numériques, Hamamatsu fabrique également des photomultiplicateurs, des photodiodes à avalanche et des intensificateurs d’image à grande vitesse.
- PRS BioSciences – Spécialisée dans la microscopie à fluorescence biologique, PRS BioSciences fabrique un système à temps fixe du marché secondaire qui peut être adapté à de nombreux microscopes de recherche.