La reconnaissance du muscle lisse habituel est généralement simple; elle se caractérise par des faisceaux entrelacés de cellules dentelées uniformes avec de longs noyaux ovales aux extrémités émoussées et des processus cytoplasmiques bipolaires effilés. En raison des dispositions fasciculaires, les noyaux apparaissent petits et ronds lorsqu’ils sont coupés en section transversale, mais longs et ovales lorsqu’ils sont coupés longitudinalement (voir l’image suivante).
 Fascicules normaux du muscle lisse.
Fascicules normaux du muscle lisse. Les léiomyomes ont parfois des nucléoles petits mais visibles et une légère irrégularité de la frontière nucléaire. Parfois, un léiomyome a des composants hamartomateux tels que la graisse, le cartilage et l’os; ces tumeurs sont nommées en fonction des caractéristiques des composants (par exemple, lipoléiomyome, léiomyome chondroïdien) et n’ont aucune incidence sur le potentiel malin.
Rarement, les cellules musculaires lisses apparaissent basaloïdes et moins fasciculaires et ressemblent à un stroma endométrial, ce qui augmente la possibilité d’un nodule stromal ou, plus cliniquement, d’un sarcome stromal endométrial. Dans de tels cas, les indices histologiques selon lesquels le néoplasme est un muscle lisse comprennent une croissance fasciculaire et des vaisseaux de gros calibre. La différenciation par immunohistochimie peut être utile, mais malheureusement, elle n’est pas toujours éclairante (voir Immunohistochimie). L’évaluation des bordures infiltrantes caractéristiques du sarcome stromal endométrial est utile.
Bien que bénignes, les leiomyomata peuvent atteindre des tailles extrêmement grandes (20-30 cm). Bien que dans les tissus mous, une telle tumeur soit par définition considérée comme une tumeur maligne, cela n’est pas vrai pour les tumeurs survenant dans l’utérus. En raison des influences hormonales, les léiomyomes peuvent être très hypertrophiques et mitotiquement actifs.
Il est fréquent que des infarctus surviennent. Ceux-ci sont généralement facilement reconnaissables par la formation de cicatrices le long de la périphérie de l’infarctus (classée comme nécrose hyaline) (voir l’image ci-dessous). De plus, dans un infarctus, le muscle lisse et les vaisseaux sont nécrotiques.
 Nécrose hyalinisée caractérisée par une formation de cicatrice.
Nécrose hyalinisée caractérisée par une formation de cicatrice. Après un infarctus, le léiomyome subit parfois un changement hydrologique. La matrice desserrée devient œdémateuse, donnant un aspect myxoïde à la lésion. Un indice du changement hydrologique est la présence de gros vaisseaux flottant dans l’espace vide, avec les cellules musculaires lisses poussées à la périphérie. L’atypie réactive et l’augmentation des mitoses sont fréquemment observées à proximité d’une zone d’infarctus; par conséquent, l’atypie cytologique doit être évaluée loin des régions de nécrose ou d’infarctus.
Les léiomyosarcomes sont rares et sont généralement faciles à diagnostiquer. L’évaluation des 3 caractéristiques suivantes reste le moyen le plus fiable d’évaluer la malignité: activité mitotique, nécrose des cellules tumorales et atypie cytologique. Compte tenu de l’importance de ces caractéristiques, chacune est discutée ci-dessous.
Activité mitotique
En soi, l’indice mitotique n’est pas un prédicteur indépendant de la malignité. Les léiomyomes mitotiquement actifs sont bien étudiés et rapportés. Celles-ci sont définies comme des tumeurs des muscles lisses avec jusqu’à 20 mitoses / 10 champs de haute puissance (HPF), mais elles sont dépourvues d’atypie et de nécrose des cellules tumorales. Bien que cette caractéristique seule ne dénote pas de malignité, lorsque d’autres caractéristiques inquiétantes sont présentes, l’activité mitotique devient extrêmement importante pour évaluer le potentiel malin.
Pour mesurer l’indice mitotique, trouvez la zone la plus mitotiquement active de la tumeur (mais évitez les zones adjacentes à la nécrose hyalinisée) et comptez 10 HPF (40 ×).
Les corps apoptotiques, les cellules musculaires lisses en dégénérescence et les lymphocytes infiltrants peuvent parfois simuler des figures mitotiques; par conséquent, les dénombrements mitotiques ne doivent inclure que les mitoses définitives. Si plus d’une seule figure mitotique atypique est trouvée, une évaluation vigilante est justifiée; la tumeur ne doit pas être catégoriquement classée comme bénigne. Plusieurs diagnostics peuvent être envisagés, y compris un néoplasme atypique du muscle lisse, un néoplasme du muscle lisse de bas grade et un léiomyosarcome.
Atypie cytologique
Le myomètre non néoplasique adjacent peut être utilisé comme témoin interne pour l’histologie des muscles lisses de base du patient. En règle générale, les léiomyomes n’ont que des cellules légèrement plus grandes et des irrégularités de la membrane nucléaire focale. L’atypie cytologique est évaluée par la détermination de la taille du noyau, l’examen des contours de la membrane et l’évaluation de la proéminence et du nombre de nucléoles (voir l’image ci-dessous).
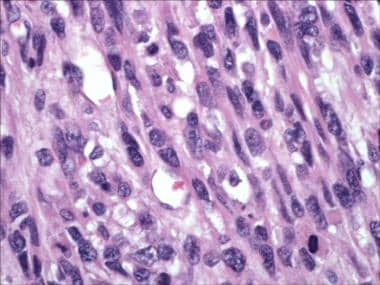 Léiomyosarcome présentant une atypie cytologique marquée.
Léiomyosarcome présentant une atypie cytologique marquée. Il est bien connu qu’en l’absence d’autres caractéristiques, l’atypie cytologique sévère focale est généralement bénigne (peut-être semblable à un changement ancien dans d’autres tumeurs, telles que les schwannomes). Ces tumeurs étaient autrefois appelées léiomyomes symplastiques et sont maintenant classées comme léiomyome avec atypie (voir l’image suivante). L’atypie sévère diffuse n’est pas une caractéristique typique des tumeurs bénignes et doit être évaluée avec beaucoup de soin. Dans de tels cas, l’indice mitotique aide à classer la tumeur.
 Léiomyome avec atypie (anciennement appelé léiomyome symplastique). Notez la nature focale de l’atypie sévère. Par définition, les tumeurs de ce type sont dépourvues de nécrose des cellules tumorales et de mitoses supérieures à 10 mitoses pour 10 champs de haute puissance (HPF).
Léiomyome avec atypie (anciennement appelé léiomyome symplastique). Notez la nature focale de l’atypie sévère. Par définition, les tumeurs de ce type sont dépourvues de nécrose des cellules tumorales et de mitoses supérieures à 10 mitoses pour 10 champs de haute puissance (HPF). Nécrose coagulante des cellules tumorales
Des 3 caractéristiques discutées, la nécrose coagulante des cellules tumorales semble être la caractéristique histologique la plus prédictive de la malignité. Le plus gros problème est de le reconnaître et de ne pas le classer comme un infarctus / nécrose hyalinisée. La nécrose des cellules tumorales coagulantes est caractérisée par un changement brusque des myocytes viables adjacents aux myocytes nécrotiques sans bord sclérotique intervenant (caractéristique des infarctus) (voir l’image suivante). Les cellules tumorales nécrotiques individuelles (cellules fantômes) sont généralement discernables et les vaisseaux sont généralement toujours viables.
 Léiomyome avec atypie (anciennement appelé léiomyome symplastique). Notez la nature focale de l’atypie sévère. Par définition, les tumeurs de ce type sont dépourvues de nécrose des cellules tumorales et de mitoses supérieures à 10 mitoses pour 10 champs de haute puissance (HPF).
Léiomyome avec atypie (anciennement appelé léiomyome symplastique). Notez la nature focale de l’atypie sévère. Par définition, les tumeurs de ce type sont dépourvues de nécrose des cellules tumorales et de mitoses supérieures à 10 mitoses pour 10 champs de haute puissance (HPF). S’il existe de grandes zones de nécrose hyalinisée et une zone focale suspecte de nécrose des cellules tumorales, les niveaux peuvent parfois aider à identifier un bord sclérotique et à confirmer des infarctus plus jeunes. De plus, si un myome a été embolié avant la chirurgie pour contrôler le saignement, les caractéristiques histologiques ressembleront à une nécrose des cellules tumorales, bien que les vaisseaux dans les zones de nécrose soient également nécrotiques. Si la nécrose des cellules tumorales est en cause, un échantillonnage supplémentaire de la masse myomateuse peut aider à clarifier le type de nécrose, soit par des foyers supplémentaires de nécrose des cellules tumorales, soit par d’autres caractéristiques caractéristiques du léiomyosarcome.
Le terme « tumeur du muscle lisse au potentiel malin incertain » (SOUCHE) est parfois appliqué aux cas dans lesquels il existe des caractéristiques de malignité indéterminées ou une combinaison de caractéristiques inhabituelles et qui ne sont donc pas largement rapportées dans la littérature. Ce terme devrait être réservé aux cas dans lesquels le potentiel malin est vraiment inconnu, et il devrait être utilisé avec parcimonie.
La SOUCHE est essentiellement un non-diagnostic, et elle est lourde de frustration pour les cliniciens et les patients. La plupart des études sur les SOUCHES rapportent des résultats bénins, qui reflètent probablement le fait que le terme est surutilisé. Si la tumeur présente des caractéristiques généralement bénignes, mais si de rares cas de récidive sont connus, le terme « faible potentiel récurrent » peut être préférable au MOIGNON, car ce terme transmet plus d’informations sur le potentiel malin prédit et connu.
Le léiomyome métastasiant bénin est une tumeur non nonnécrotique inactive, cytologiquement fade et mitotiquement inactive qui se propage aux poumons et aux ganglions lymphatiques. Il peut être traité par résection et hormonothérapie. Ces tumeurs ont un profil cytogénétique distinct. Parce que l’histologie du léiomyome métastasiant bénin est identique à celle du léiomyome, le diagnostic est toujours posé rétrospectivement (par exemple, chez une femme qui présente des nodules pulmonaires). Il n’y a pas de caractéristiques histologiques qui aident à prédire quelles léiomyomes utérins fades vont « métastaser. »
La léiomyomatose intravasculaire est une prolifération fade des muscles lisses dans les canaux vasculaires. Elle peut être focale (démontrant une intrusion vasculaire) ou multifocale et grossièrement visible. L’intrusion vasculaire focale est généralement auto-limitée. Parfois, une léiomyomatose vasculaire importante se reproduit dans les vaisseaux pelviens ou abdominaux; rarement, elle s’étend dans la veine cave inférieure et finit par toucher le cœur. Parce que les léiomyosarcomes peuvent impliquer des vaisseaux sanguins, le terme « léiomyomatose intravasculaire » est réservé aux tumeurs qui ne présentent pas de caractéristiques histologiques suspectes (voir l’image ci-dessous).
 Invasion vasculaire d’un léiomyosarcome.
Invasion vasculaire d’un léiomyosarcome. Les néoplasmes myxoïdes du muscle lisse utérin (MUSMN) sont rares; ces tumeurs n’ont été rapportées que dans quelques petites études. Les critères histologiques pour prédire une lésion myxoïde agressive sont difficiles, car les léiomyosarcomes myxoïdes peuvent être paucicellulaires et faussement fades. Leur histologie va du stroma myxoïde abondant, rappelant un myxome (voir la première image ci-dessous), à un schéma d’œdème pulmonaire dans lequel les cellules tumorales ont de fines alvéoles ressemblant à des septa (comme indiqué dans la deuxième image ci-dessous), à un aspect plus classique du muscle lisse similaire à la fasciite nodulaire myxoïde. Le schéma myxoïde ne semble pas corrélé avec un potentiel malin.
 Le modèle de myxome des tumeurs du muscle lisse myxoïde. Cette tumeur n’a qu’une atypie minimale.
Le modèle de myxome des tumeurs du muscle lisse myxoïde. Cette tumeur n’a qu’une atypie minimale.  léiomyome myxoïde avec œdème pulmonaire marqué.
léiomyome myxoïde avec œdème pulmonaire marqué. Certaines caractéristiques communes des lésions bénignes comprennent des bordures bien circonscrites, une cytologie fade et essentiellement aucune activité mitotique (moins de 2 pour 10 HPF) (voir l’image suivante). Les caractéristiques prédictives de la malignité comprennent la nécrose des cellules tumorales (indépendamment des autres caractéristiques), les frontières infiltrantes (reconnues par le myomètre normal adjacent évasé et séparé par le stroma myxoïde) et les mitoses supérieures à 2 pour 10 HPF. En raison de l’effet de dilution du stroma myxoïde, certains chercheurs préconisent de compter 50 HPF pour obtenir une meilleure représentation de l’indice mitotique.
 Figure mitotique dans une tumeur myxoïde du muscle lisse. En moyenne, la plupart des léiomyosarcomes ont au moins 2 mitoses pour 10 champs de haute puissance (HPF) (ou plus de 10 pour 50 HPF).
Figure mitotique dans une tumeur myxoïde du muscle lisse. En moyenne, la plupart des léiomyosarcomes ont au moins 2 mitoses pour 10 champs de haute puissance (HPF) (ou plus de 10 pour 50 HPF). Certains premiers rapports de tumeurs du muscle lisse myxoïde ont révélé que les tumeurs caractérisées par un indice mitotique de 0 pour 10 HPF, une cytologie fade et des frontières infiltrantes étaient associées à de mauvais résultats. Bien que ces résultats n’aient pas été reproduits à ce jour, ils devraient probablement être diagnostiqués avec soin; une catégorie de SOUCHE peut être la plus appropriée.
L’œdème peut ressembler à un stroma myxoïde et peut confondre l’évaluation d’une tumeur du muscle lisse. Un œdème secondaire à une dégénérescence hydroélectrique périnodulaire peut provoquer un gonflement du léiomyome (les auteurs en ont vu un qui mesurait 35 cm). La dégénérescence hydropique est généralement caractérisée par un œdème centré autour des gros vaisseaux. Il en résulte un déplacement des cellules musculaires lisses normales vers la périphérie de l’œdème. Les navires semblent flotter dans un espace dégagé. Habituellement, dans une tumeur du muscle lisse myxoïde fade, les cellules tumorales sont petites, mais dans la dégénérescence hydropique, les cellules tumorales ont la taille des cellules musculaires lisses normales.
Les tumeurs épithélioïdes du muscle lisse utérin sont caractérisées par des cellules polygonales à noyaux ronds placés au centre. Souvent, une matrice éosinophile acellulaire se forme autour des cellules, lui donnant un aspect osseux lorsqu’elle est vue sous un grossissement de balayage. Ces tumeurs ont été classées sous de nombreux noms, dont XYZ. Comme pour leurs cousins myxoïdes, le seuil de classification des tumeurs épithélioïdes du muscle lisse en tant que léiomyosarcome est plus bas que pour les tumeurs habituelles du muscle lisse (voir les 2 images ci-dessous).
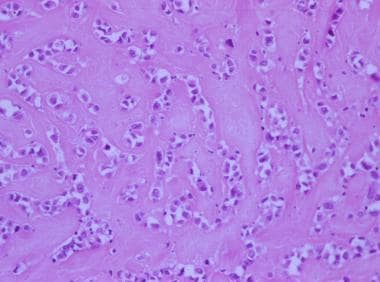 Matrice extracellulaire marquée dans un léiomyome épithélioïde.
Matrice extracellulaire marquée dans un léiomyome épithélioïde.  Tumeur cellulaire épithélioïde du muscle lisse.
Tumeur cellulaire épithélioïde du muscle lisse. Les tumeurs épithélioïdes du muscle lisse se chevauchent considérablement avec les tumeurs des cellules épithéliales périvasculaires (PEComes). Les pecomes sont des tumeurs de différenciation incertaine qui se produisent souvent dans le cadre de la sclérose tubéreuse. Les cellules musculaires lisses du PECome partagent l’immunophénotype impair de l’angiomyolipome et de la lymphangioléiomyomatose et présentent une positivité de l’actine du muscle lisse (SMA) ainsi qu’une positivité périvasculaire du HMB 45 (voir les 2 images ci-dessous). Bien que les pecomes utérins puissent également survenir dans le cadre de la sclérose tubéreuse, la plupart sont des cas sporadiques.
 Tumeur des cellules épithéliales périvasculaires (PEComa) démontrant les caractéristiques épithélioïdes et des cellules claires.
Tumeur des cellules épithéliales périvasculaires (PEComa) démontrant les caractéristiques épithélioïdes et des cellules claires.  HMB45 tache immunohistochimique d’une tumeur périvasculaire à cellules épithéliales (PECome) démontrant une immunoréactivité focale près des vaisseaux.
HMB45 tache immunohistochimique d’une tumeur périvasculaire à cellules épithéliales (PECome) démontrant une immunoréactivité focale près des vaisseaux. Dans 2 études approfondies menées par Vang et Kempson et Folpe et al, la plupart des pecomes utérins ont donné d’excellents résultats. Cependant, aucune caractéristique fiable n’a été trouvée pour prédire un potentiel agressif. Certains auteurs ont déclaré que la distinction entre le PECome et les tumeurs épithélioïdes du muscle lisse n’est pas nécessaire et que la positivité HMB45 peut être observée dans les tumeurs épithélioïdes habituelles du muscle lisse. Cependant, les gènes de la sclérose tubéreuse régulent la voie Rheb / mTOR / p70S6K, et même des cas sporadiques de PECome ont des niveaux accrus de p70S6K. C’est une zone potentielle pour une thérapie ciblée telle que la rapamycine, qui inhibe le mTOR. Ainsi, bien que la nomenclature n’ait pas d’importance, l’évaluation génétique pourrait devenir plus critique pour les pistes de traitement possibles.
Parfois, les léiomyosarcomes épithélioïdes peuvent être infiltrants et simuler une tumeur trophoblastique gestationnelle épithélioïde. L’âge préménopausique, l’extension des cellules dans le canal endocervical ou la dispersion dans l’endomètre sont des modèles inhabituels de léiomyosarcome. Bien que le diagnostic différentiel puisse être difficile, la distinction est facile avec l’immunohistochimie.