26 octobre 2020 par le personnel du NCI
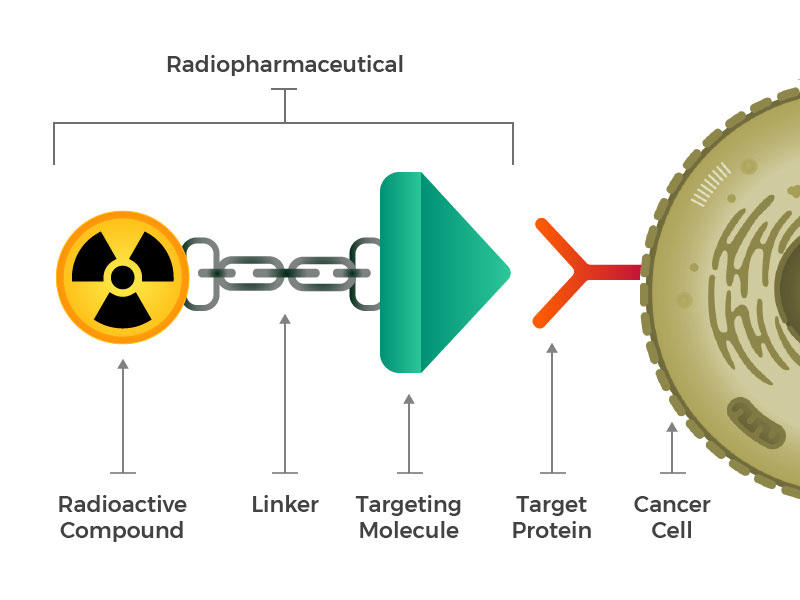
Les produits radiopharmaceutiques sont constitués d’une molécule radioactive, d’une molécule de ciblage et d’un lieur qui joint les deux.
Les deux dernières décennies ont apporté un changement radical dans la façon dont de nombreux types de cancer sont traités. Les thérapies ciblées arrêtent des protéines spécifiques dans les cellules cancéreuses qui les aident à se développer, à se diviser et à se propager. Les immunothérapies stimulent ou suppriment le système immunitaire du corps pour aider à combattre le cancer. Mais les traitements utilisés de longue date – chirurgie, chimiothérapie et radiothérapie — restent l’épine dorsale du traitement de la plupart des cancers.
La radiothérapie a été utilisée pour la première fois pour traiter le cancer il y a plus de 100 ans. Environ la moitié de tous les patients atteints de cancer le reçoivent encore à un moment donné de leur traitement. Et jusqu’à récemment, la plupart des radiothérapies étaient administrées comme il y a 100 ans, en délivrant des faisceaux de rayonnement de l’extérieur du corps pour tuer les tumeurs à l’intérieur du corps.
Bien qu’efficaces, les radiations externes peuvent également causer des dommages collatéraux. Même avec un équipement de radiothérapie moderne, « il faut des tissus normaux pour atteindre une tumeur », a déclaré Charles Kunos, MD, Ph.D., du Programme d’évaluation de la thérapie du cancer (CTEP) de NCI. Les effets secondaires de la radiothérapie qui en résultent dépendent de la zone du corps traitée, mais peuvent inclure une perte de goût, des changements cutanés, une perte de cheveux, une diarrhée et des problèmes sexuels.
Maintenant, les chercheurs développent une nouvelle classe de médicaments appelés radiopharmaceutiques, qui administrent la radiothérapie directement et spécifiquement aux cellules cancéreuses. Ces dernières années ont vu une explosion de la recherche et des essais cliniques mettant à l’essai de nouveaux produits radiopharmaceutiques.
Ces études ont suggéré que le ciblage de la radiothérapie au niveau cellulaire pourrait réduire le risque d’effets secondaires à court et à long terme du traitement tout en permettant de tuer même de minuscules dépôts de cellules cancéreuses dans tout le corps.
« Je pense qu’ils vont transformer la radio-oncologie au cours des 10 à 15 prochaines années », a déclaré le Dr Kunos.
S’appuyer sur une affinité naturelle
Délivrer un rayonnement directement aux cellules n’est pas en soi une nouvelle approche. Une de ces thérapies, appelée iode radioactif, est utilisée pour traiter certains types de cancer de la thyroïde depuis les années 1940. L’iode s’accumule naturellement dans les cellules thyroïdiennes. Une version radioactive de l’élément peut être produite en laboratoire. Lorsqu’il est ingéré (sous forme de pilule ou de liquide), il s’accumule et tue les cellules cancéreuses laissées après une chirurgie thyroïdienne.
Une affinité naturelle similaire a ensuite été exploitée pour développer des médicaments pour traiter le cancer qui s’est propagé aux os, tels que le dichlorure de radium 223 (Xofigo), approuvé en 2013 pour traiter le cancer de la prostate métastatique. Lorsque les cellules cancéreuses se développent dans l’os, elles provoquent la dégradation du tissu osseux qu’elles envahissent. Le corps tente ensuite de réparer ces dommages en remplaçant cet os — un processus appelé renouvellement osseux.
L’élément radioactif radium « ressemble à une molécule de calcium, il est donc incorporé dans les zones du corps où le renouvellement osseux est le plus élevé », comme les zones où le cancer se développe, a expliqué le Dr Kunos. Le radium est alors capable de tuer les cellules cancéreuses voisines.
Ces composés radioactifs se déplacent tous vers les cellules cancéreuses sans aucune aide. Les chercheurs se sont demandé s’il serait possible de concevoir de nouvelles molécules radioactives ciblant spécifiquement d’autres cancers.
Ils ont imaginé des produits radiopharmaceutiques d’ingénierie composés de trois éléments constitutifs principaux : une molécule radioactive, une molécule de ciblage (qui reconnaît et se verrouille spécifiquement sur les cellules cancéreuses) et un éditeur de liens qui joint les deux. De tels composés pourraient être injectés, perfusés, inhalés ou ingérés, puis se frayer un chemin dans la circulation sanguine.
L’idée de lier une molécule ciblant le cancer à une molécule qui tue les cellules cancéreuses n’est pas nouvelle non plus. Par exemple, plusieurs médicaments appelés conjugués anticorps–médicament, dans lesquels un anticorps qui se lie à des cellules cancéreuses spécifiques est lié à un médicament toxique, ont été approuvés pour traiter le cancer.
Mais les efforts pour créer de tels médicaments ont rencontré un succès limité, a expliqué le Dr Kunos, car il ne suffit pas que les toxines soient rapprochées d’une cellule cancéreuse. Les toxines doivent être prises à l’intérieur et rester à l’intérieur des cellules assez longtemps pour causer des dommages. De nombreuses cellules cancéreuses ont ou développent des mécanismes pour simplement pomper les toxines avant que cela ne puisse se produire.
Les produits radiopharmaceutiques fonctionnent également mieux lorsque les médicaments peuvent pénétrer à l’intérieur des cellules. Mais ce n’est pas nécessaire pour qu’ils soient efficaces. Une fois qu’un produit radiopharmaceutique s’est collé à une cellule cancéreuse, le composé radioactif se décompose naturellement. Cette désintégration libère de l’énergie qui endommage l’ADN des cellules voisines. Et quand l’ADN d’une cellule est irrémédiablement endommagé, cette cellule meurt. Les cellules cancéreuses sont particulièrement sensibles aux dommages à l’ADN induits par les rayonnements.
Selon le type de composé radioactif utilisé, l’énergie résultante peut pénétrer dans la cellule liée au produit radiopharmaceutique ainsi qu’environ 10 à 30 cellules entourant cette cellule. Cela augmente le nombre de cellules cancéreuses qui peuvent être tuées avec une seule molécule radiopharmaceutique.
Au milieu des années 2010, la Food and Drug Administration (FDA) avait approuvé deux produits radiopharmaceutiques ciblant des molécules sur certaines cellules B pour traiter certaines personnes atteintes de lymphome non Hodgkinien, un type de cancer du sang. Mais ces médicaments n’ont jamais été largement adoptés. Peu de médecins traitant des patients atteints de lymphome ont été formés pour administrer ces types de composés radioactifs. Et les produits radiopharmaceutiques ont fait face à la concurrence de nouveaux médicaments non radioactifs.
Le changement de jeu dans le domaine est survenu en 2018, a déclaré Jacek Capala, Ph.D., du Programme de recherche sur les radiations du NCI, lorsque la FDA a approuvé le lutétium Lu 177-dotatate (Lutathera) pour le traitement de certaines tumeurs neuroendocrines cancéreuses (TNE) affectant le tube digestif.
« Cela a montré que les tumeurs solides peuvent également être ciblées de cette façon », avec un produit radiopharmaceutique construit à partir de zéro, a-t-il déclaré. Dans ce cas, les cibles sont certains récepteurs hormonaux présents en abondance à la surface des cellules NETTES.
Le Lutétium Lu 177-dotatate était meilleur pour ralentir la croissance nette que n’importe quel médicament testé précédemment, a expliqué Aman Chauhan, MD, de l’Université du Kentucky, qui dirige plusieurs nouveaux essais cliniques du médicament. « Ce fut un énorme pas en avant pour notre domaine », a-t-il déclaré.
Adaptation de médicaments à partir de composés d’imagerie
Les chercheurs conçoivent et testent maintenant des produits radiopharmaceutiques pour une gamme de cancers aussi divers que le mélanome, le cancer du poumon, le cancer colorectal et la leucémie, a déclaré le Dr Capala. Toute tumeur qui possède une molécule ciblable à la surface de ses cellules et un bon apport sanguin — suffisant pour administrer des médicaments — pourrait potentiellement être traitée avec des produits radiopharmaceutiques, a ajouté le Dr Chauhan.
Bon nombre de ces nouveaux médicaments sont des versions remaniées de composés existants utilisés pour l’imagerie nucléaire. Les tests d’imagerie nucléaire, tels que la tomographie par émission de positons (TEP), utilisent parfois des composés faiblement radioactifs liés à des molécules qui se lient à des cibles spécifiques à la surface des cellules cancéreuses. Des caméras spécialisées peuvent alors révéler même de minuscules dépôts de cellules cancéreuses, aidant à mesurer la propagation du cancer dans le corps.
Les chercheurs ont maintenant réutilisé ces molécules de ciblage pour transporter des composés radioactifs plus puissants, ou des isotopes, à la place — ceux qui pourraient tuer les cellules cancéreuses au lieu de simplement aider à les visualiser.
Le cancer de la prostate a été un terrain d’essai précoce pour cette réutilisation. Une protéine appelée PSMA se trouve en grande quantité — et presque exclusivement — sur les cellules de la prostate. En fusionnant une molécule qui se lie au PSMA à un composé radioactif utilisé dans l’imagerie par TEP, les scientifiques ont pu visualiser de minuscules dépôts de cancer de la prostate qui sont trop petits pour être détectés par l’imagerie conventionnelle.
Plusieurs traitements radiopharmaceutiques ciblant le PSMA sont actuellement testés dans le cadre d’essais cliniques.
La plupart des cancers de la prostate sont très sensibles aux radiations, et les radiations externes sont couramment utilisées pour traiter la maladie, a expliqué Frank Lin, MD, du Centre de recherche sur le cancer du NCI, qui dirige un essai clinique d’un produit radiopharmaceutique ciblant le PSMA au Centre clinique des NIH.
La plupart des hommes qui reçoivent une radiothérapie comme traitement initial ne connaîtront pas de récidive de leur cancer. Mais s’ils le font, il se propage parfois dans tout le corps, avec de nombreux petits dépôts de cellules cancéreuses dans de nombreux organes, a-t-il expliqué.
« Lorsque la tumeur s’est propagée comme ça, vous ne pouvez plus vraiment faire de rayonnement externe, car le rayonnement externe ne peut être concentré et traiter qu’une petite partie de votre corps à la fois », a déclaré le Dr Lin.
Avoir un produit radiopharmaceutique qui cible le PSMA est un meilleur moyen de donner des radiations dans ces cas, car il peut être perfusé directement dans le flux sanguin et circuler largement, se fixant aux cellules cancéreuses de la prostate qui se sont propagées dans tout le corps, a-t-il expliqué.
Et un gros avantage d’avoir des molécules d’imagerie et de traitement qui utilisent la même cible est que l’imagerie peut ensuite donner aux médecins un aperçu de la probabilité que le traitement fonctionne, a ajouté le Dr Lin.
Par exemple, dans l’essai du Dr Lin, les hommes doivent subir une TEP avec la version d’imagerie du composé avant le traitement. Si le composé d’imagerie trouve son chemin vers les cellules cancéreuses et est détecté lors de la TEP, les chercheurs peuvent supposer que le traitement radiopharmaceutique correspondant atteindra sa cible.
« Ce développement complémentaire du diagnostic associé aux thérapies médicamenteuses rend ce domaine beaucoup plus excitant », a déclaré le Dr Chauhan. « De cette façon, nous pouvons savoir que nous administrons la thérapie directement aux cellules tumorales. »
Passage aux thérapies combinées
Bien que les produits radiopharmaceutiques se soient montrés prometteurs dans les premières études, ils sont également peu susceptibles, comme c’est le cas avec d’autres types de médicaments anticancéreux, d’éliminer une tumeur par eux-mêmes.
Par exemple, le lutétium Lu 177-dotatate a plus que doublé le nombre de personnes dont les tumeurs neuroendocrines ont diminué après le traitement, mais ce nombre était encore modeste: environ 17%, contre 7% sans le médicament, a expliqué le Dr Chauhan.
« Il y a encore beaucoup de place à l’amélioration », a-t-il déclaré.
L’utilisation de produits radiopharmaceutiques en association avec d’autres thérapies peut être un moyen de favoriser cette amélioration. Certains chercheurs testent actuellement des produits radiopharmaceutiques combinés à des sensibilisants aux rayonnements — des médicaments qui rendent les cellules cancéreuses encore plus vulnérables aux rayonnements. Par exemple, le Dr Chauhan dirige un essai clinique sur le lutétium Lu 177-dotatate associé à un sensibilisant aux rayonnements appelé triapine, qui empêche les cellules de produire les composés nécessaires à la réparation de l’ADN après des dommages induits par les rayonnements.
Dans un autre essai, le Dr Lin teste le lutétium Lu 177-dotatate avec un type de médicament appelé inhibiteur de PARP. Ces médicaments, qui sont déjà approuvés pour traiter certains types de cancers du sein, de l’ovaire et d’autres cancers, bloquent le processus de réparation de l’ADN lui-même. « Ainsi, le rayonnement causerait des dommages à l’ADN et l’inhibiteur de PARP empêcherait les cellules tumorales de guérir leur ADN après le rayonnement », a-t-il expliqué.
D’autres chercheurs associent des produits radiopharmaceutiques à des immunothérapies pour tenter de renforcer l’efficacité de ces médicaments. « Des études récentes ont montré que les produits radiopharmaceutiques peuvent rendre les tumeurs plus sensibles à l’immunothérapie », a déclaré le Dr Capala.
De nombreuses tumeurs sont des tumeurs « froides », a-t-il expliqué, en ce sens que les cellules immunitaires ne les reconnaissent pas ou ne fonctionnent pas correctement dans le microenvironnement autour des tumeurs, a-t-il expliqué.
Mais lorsque les rayonnements tuent les cellules cancéreuses, les protéines et l’ADN de ces cellules peuvent se déverser dans la circulation sanguine pour que les cellules immunitaires puissent voir, ce qui peut permettre aux cellules immunitaires de reconnaître et de tuer d’autres cellules cancéreuses dans tout le corps. La radiothérapie peut également rendre le microenvironnement tumoral plus hospitalier pour les cellules immunitaires, a ajouté le Dr Capala.
Ensemble, ces effets peuvent transformer une tumeur froide en une tumeur « chaude »: une tumeur qui possède une abondance de cellules immunitaires et qui peut réagir aux médicaments d’immunothérapie. Certaines études ont essayé d’utiliser le rayonnement externe pour créer ce type de réponse.
« Mais certaines données suggèrent que cela fonctionne mieux si chaque tumeur, chaque métastase, est exposée à des radiations. La thérapie radiopharmaceutique a donc un avantage là-bas, en ce sens qu’une fois dans le corps, elle atteint toutes les métastases « , a expliqué le Dr Capala.
Il peut même être judicieux de combiner des produits radiopharmaceutiques avec des rayonnements externes, à condition qu’une planification minutieuse du traitement puisse garantir une dose globale de rayonnement sûre, a ajouté le Dr Capala. « La radiothérapie externe est très efficace pour cibler les grosses tumeurs, et vous pouvez ensuite la combiner avec une thérapie radiopharmaceutique pour cibler les métastases », a-t-il déclaré.
Défis et mises en garde
Le domaine des produits radiopharmaceutiques en est encore à ses débuts. L’un des défis que l’approche devra surmonter avant de pouvoir être utilisée plus largement est la pénurie de médecins formés pour administrer de tels médicaments.
« Le nombre de médecins en médecine nucléaire aux États-Unis est faible », a déclaré le Dr Lin, qui a une formation en médecine nucléaire et en oncologie médicale. « Et je pense que nous ne formons peut-être que 70 ou 80 nouvelles personnes par an. »
Jusqu’à présent, cette pénurie de main-d’œuvre a empêché les produits radiopharmaceutiques de réaliser leur véritable potentiel en tant que traitement personnalisé, a expliqué le Dr Capala. Ce potentiel reflète le fait que, contrairement à d’autres types de médicaments anticancéreux, les médecins peuvent utiliser l’imagerie pour mesurer exactement la quantité d’un produit radiopharmaceutique ayant atteint une tumeur, presque en temps réel, et ajuster la dose en conséquence.
Mais ce type de planification de traitement nécessite une expertise multidisciplinaire qui n’est pas largement disponible et a laissé les personnes utilisant des produits radiopharmaceutiques plus comme une « chimiothérapie radioactive », avec une dose unique, a-t-il ajouté. « Cela signifie que de nombreux patients ne reçoivent pas un traitement optimal », a déclaré le Dr Capala.
Des études d’innocuité à long terme sont également nécessaires, a ajouté le Dr Chauhan. Les personnes traitées par radiothérapie externe peuvent ressentir certains effets secondaires, appelés effets tardifs — tels que le développement de deuxièmes cancers — des mois ou des années après le traitement. Bien que la recherche à ce jour n’ait pas montré un taux élevé d’effets tardifs du traitement radiopharmaceutique, « ce sont des agents très nouveaux, et nous devons continuer à être prudents et à les surveiller », a-t-il déclaré.
Lissage des collaborations
Parce que ces médicaments sont relativement nouveaux, même avec les essais en cours, « nous ne faisons que gratter la surface du développement de médicaments pour les produits radiopharmaceutiques », a déclaré le Dr Chauhan.
En 2019, afin de stimuler davantage les essais de nouveaux produits radiopharmaceutiques prometteurs, NCI a lancé l’Initiative de développement radiopharmaceutique (IDR) pour accélérer la mise à l’essai clinique de nouveaux médicaments prometteurs.
Une chose que NCI espère réaliser avec le RDI est de négocier davantage d’essais utilisant des combinaisons de médicaments produits par différentes sociétés pharmaceutiques qui pourraient ne pas collaborer autrement, a expliqué le Dr Kunos, qui dirige l’initiative. Des préoccupations au sujet de la propriété intellectuelle et un manque de confiance peuvent arrêter de tels projets avant qu’ils ne commencent, a expliqué le Dr Kunos.
« Ces types de collaborations ne se produiraient pas nécessairement à moins que NCI ne soit le courtier honnête au milieu », a-t-il déclaré. À l’heure actuelle, seulement environ 2% des essais en phase précoce soutenus par NCI testent des produits radiopharmaceutiques, mais avec le RDI, cela pourrait croître de manière exponentielle dans les années à venir, a-t-il ajouté.
« Nous n’allons pas éliminer les machines ou autres techniques que nous utilisons en radiothérapie », a déclaré le Dr Kunos. « Mais avec leur nature ciblée, nous pensons que les produits radiopharmaceutiques vont transformer notre façon d’utiliser les radiations. »