Calmoduline
Ceci est une introduction vidéo à la protéine de signalisation du calcium, la calmoduline, du point de vue d’un chimiste inorganique!
La calmoduline, ou CaM, est un polypeptide omniprésent dans toutes les cellules eucaryotes. Cette protéine est connue sous le nom de calmoduline car c’est une protéine modulée en calcium qui joue un rôle essentiel dans le processus de transduction du signal calcique. La transduction du signal calcique est le processus par lequel les interactions entre les ions calcium et de nombreuses protéines interviennent dans la communication entre les cellules. la fonction de la calmoduline est donc nécessaire dans toutes les cellules eucaryotes, et certaines des tâches qu’elle aide à accomplir sont la signalisation nerveuse, le mouvement des muscles squelettiques et la mémoire. En détectant les ions calcium dans l’environnement, la calmoduline s’active et agit ensuite comme un intermédiaire, initiant la liaison de protéines importantes telles que les kinases, aidant nos cellules à fonctionner de base et sophistiqué (« Calmoduline »).
La vidéo ci-dessous montre le changement structurel qui se produit au sein de la CaM lors de la liaison au calcium (codes APB 3CLN et 1CFD).
La protéine elle-même est de 148 acides aminés de longueur avec deux régions globulaires contenant chacune 2 motifs EF-hand, qui sont des sites caractéristiques des polypeptides médiés par le calcium. Lorsqu’elle est activée, la calmoduline abrite 4 ions Ca2+ qui changent radicalement la forme de la protéine. Lorsque la calmoduline se lie aux ions calcium, la protéine s’ouvre de sa forme apo à sa forme halo, exposant une hélice alpha connue sous le nom de lieur ou région d’attache centrale. Inventée pour sa flexibilité, la région d’attache centrale est l’emplacement de la protéine sur laquelle les protéines partenaires se lient et contribuent à la cascade qui est la messagerie secondaire du calcium. Sur la base de sa structure et de son besoin d’ions calcium pour fonctionner, la calmoduline doit pouvoir sélectionner des ions calcium dans le cytoplasme, et les interactions entre l’ion et les ligands dans les domaines de la main EF soutiennent cette idée de sélectivité (Bertini et. Al., 635-638).
Cette image est une représentation de la façon dont un motif de main EF ressemble à une main. Le diagramme en ruban à gauche montre l’un des quatre motifs caractéristiques de la calmoduline à la main en hélice-tour-hélice EF. (Code APB 3CLN)
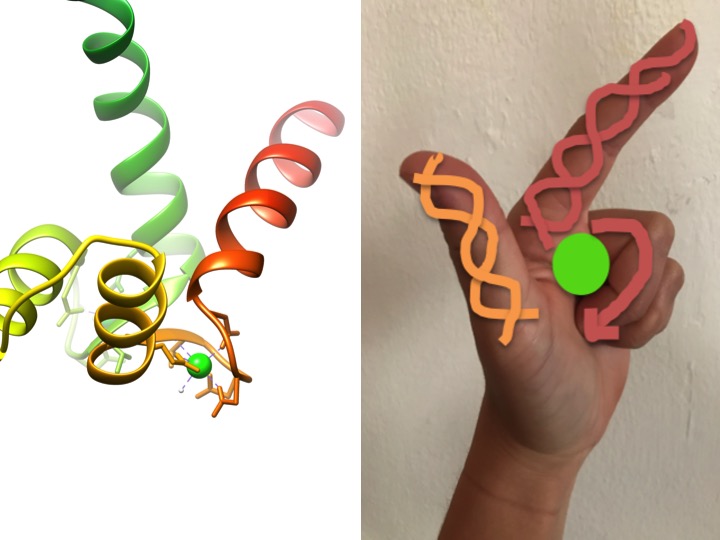
Les motifs de la main EF sont des régions structurales hautement conservées de protéines impliquées dans la liaison du calcium. Ces régions sont appelées motifs de « main » car elles ressemblent à une main en forme de L, où l’ion métallique est situé au milieu du poing, les hélices alpha sont indiquées par l’index orienté vers le haut et le pouce orienté vers l’intérieur, et les doigts enroulés représentent la région de tour ou de boucle. Ceci est démontré dans la figure ci-dessus. Dans un motif EF-hand caractéristique, les acides aminés, y compris les glutamates, les asparagines, les acides aspartiques et les acides glutamiques, se lient au Ca, ainsi qu’à l’eau (Bertini et. Al. 639). La séquence de liaison de domaine EF-hand typique est illustrée dans la figure ci-dessous.
Cette bande dessinée illustre les acides aminés coordonnés dans un domaine typique de la main EF (La composition exacte en acides aminés varie!). La ligne pointillée représente la coordination du Ca avec l’oxygène d’un carbonyle dorsal, tandis que les lignes continues indiquent la coordination avec les chaînes latérales ou l’eau.
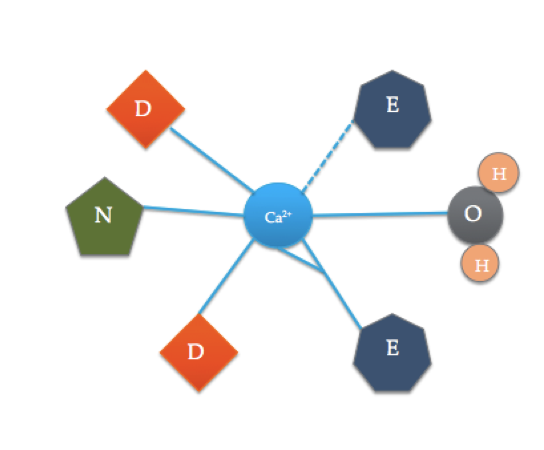
Le site de liaison à la calmoduline est quelque peu différent du domaine de la main EF le plus typique montré ci-dessus. Les 6 ligands de la calmoduline comprennent les chaînes latérales de trois acides asparatiques (D), 1 acide glutamique (E) qui forme deux liaisons covalentes coordonnées avec l’ion, 1 molécule d’eau de la solution et 1 molécule de carbonyle du squelette. Le site de liaison de la calmoduline est constitué d’un ion Ca2+ entouré de 6 ligands tout en formant 7 liaisons.
On peut remarquer que le motif EF dans la calmoduline comprend plusieurs des mêmes ligands, juste à des endroits différents. Cette conformation peut donner une idée de pourquoi la calmoduline est sélective pour le calcium et comment seule la présence d’un ion calcium peut satisfaire le site de liaison qui provoque l’activation de la protéine. Ceci est lié à la thermodynamique de la calmoduline dans la cellule et à la façon dont elle réagit à la présence d’ions calcium.
Pour comprendre la thermodynamique qui couple l’activation de la calmoduline, il faut d’abord comprendre la concentration d’ions tels que le calcium et le magnésium au sein d’une cellule eucaryote, y compris celle d’un humain. La concentration de ces ions doit être étroitement régulée. Dans la cellule, la signalisation calcique s’accompagne d’une augmentation temporaire de la concentration en ions calcium, détectée par des protéines telles que la calmoduline (Bertini et. Al., 636). Cette poussée de calcium pourrait être due aux protéines G intracellulaires qui induisent le réticulum rugueux et lisse à libérer du calcium, ou les ions calcium pourraient être introduits de l’espace extracellulaire. Dans le cas de la calmoduline, elle répond généralement à l’apport de calcium dans la cellule de l’extérieur, ce qui se produit lors de processus tels que la signalisation nerveuse (Bertini et. Al. 637). Avant que la concentration de calcium ne soit momentanément augmentée, la concentration dans la cellule est généralement comprise entre 10 et 100 nm, tandis que pendant le bref afflux d’ions, la concentration augmente jusqu’à 1 000 à 100 000 nm. Le changement de concentration amène la calmoduline à détecter les ions calcium, à les lier et à initier une transduction supplémentaire du signal (Bertini et. Al., 635).
Comment la calmoduline lie-t-elle définitivement les ions calcium et non, par exemple, les ions magnésium? Les ions Mg2+ sont en fait assez similaires aux ions calcium: ils s’engageraient dans des interactions électrostatiques plutôt que covalentes, et ils sont considérés comme des atomes durs. La raison pour laquelle la calmoduline semble favoriser les ions calcium plutôt que les ions magnésium est liée aux constantes de liaison de chaque ion. La calmoduline peut exister lorsqu’elle est liée à d’autres ions, tels que le magnésium, mais s’il y a une concentration plus élevée de calcium, les ions calcium vont immédiatement concurrencer les ions magnésium pour occuper les sites de liaison au calcium. En effet, la constante de liaison de CaM et Ca2+ (Ka) est plus grande que celle de CaM et Mg2+, comme le montre la figure 7. Cela indique que lorsqu’elle est liée aux ions calcium, la calmoduline produirait plus de produits. Il faut considérer toutes ces idées en gardant à l’esprit que ce processus se produit d’innombrables fois par seconde, et que le renouvellement de cette protéine change pour répondre à la concentration de calcium toujours modulée de la cellule.
Pourquoi la calmoduline se lie-t-elle aux ions calcium plus favorablement qu’avec d’autres métaux? Cela pourrait être dû à la taille des ions par rapport à l’obstacle stérique induit par les ligands. Le site de liaison est caractérisé par 6 ligands réalisant 7 liaisons de coordonnées. Comme les ions calcium sont plus gros que les ions magnésium, comme le montre la figure 8, il est possible que le calcium soit favorisé car il augmente la distance des ligands les uns par rapport aux autres, diminuant ainsi les interactions stériques entre les ligands. La structure même de la protéine elle-même pourrait également expliquer la sélectivité des ions calcium. Dans l’ensemble, on sait qu’en raison de la thermodynamique basée sur une concentration cellulaire variable d’ions calcium, la calmoduline détectera l’augmentation des ions, les liera et aidera à remplir sa fonction.
CAM +Ca2 + <– > Ca2 + CaM (KCaM-Ca)
CaM +Mg2 + <
Mg2+-CaM + Ca2 + <– > Ca2 + CaM+ Mg2 +
parce que KCaM-Ca > KCaM-Mg
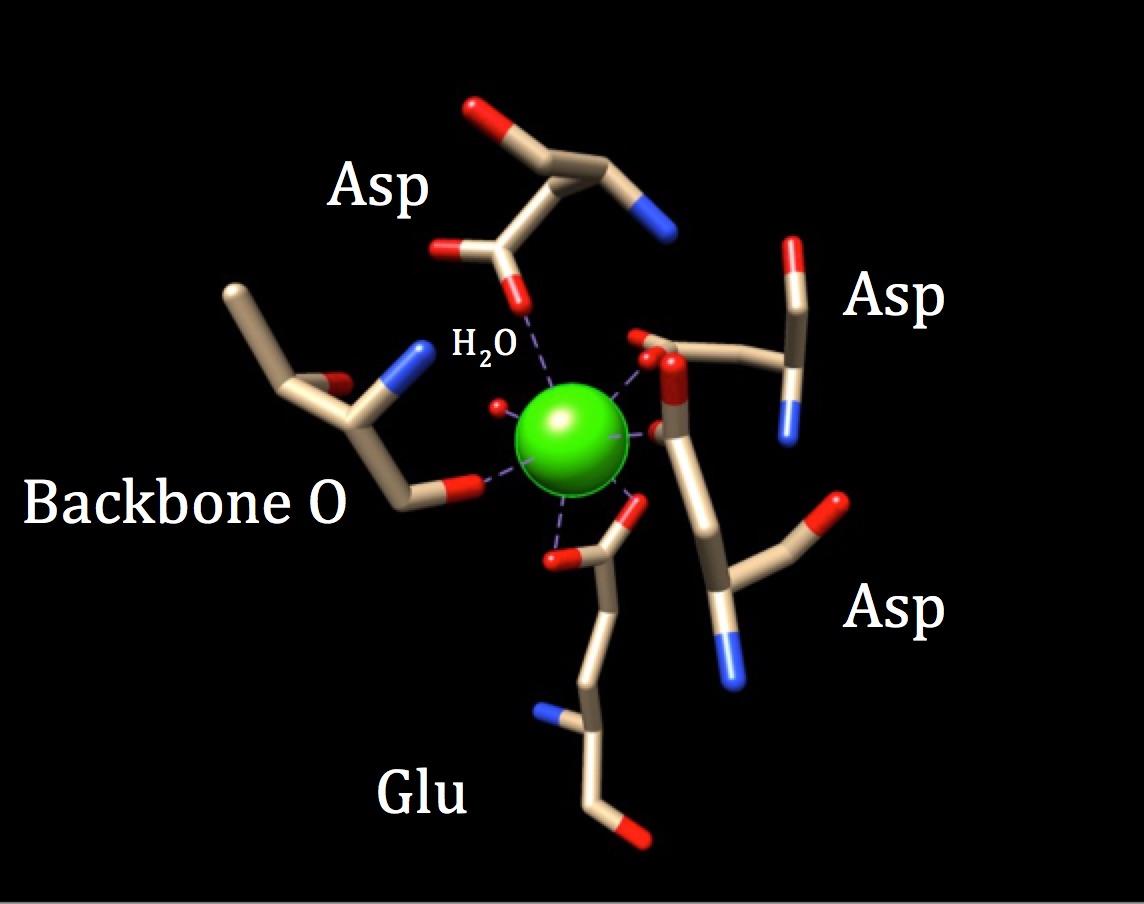
Dans une discussion plus approfondie de la chimie du site de liaison de la calmoduline, la géométrie de coordination doit être explorée. Parce que l’ion calcium interagit avec sept atomes donneurs, le système est connu sous le nom de système heptadentate. La calmoduline étant entourée de six ligands, on pourrait supposer une géométrie de coordination octaédrique. Mais, parce que l’un des ligands interagit de manière bidentée avec l’ion — ce qui signifie qu’il a deux liaisons covalentes coordonnées provenant d’atomes différents dans un acide aminé — le complexe de coordination prend une forme octaédrique déformée. La coordination spécifique est décrite dans la figure ci-dessous.
La géométrie de coordination du site de liaison au calcium de la calmoduline. L’ion calcium métal central est entouré de trois asparagines (Asp), d’un oxygène dorsal, d’un acide gluatmique (Glu) et d’une molécule d’eau. (Code APB 3CLN)
Nous pouvons également nous référer à la théorie de l’effet chélate pour mieux comprendre la capacité de la calmoduline à se lier aux ions métalliques à haute affinité. Un chélateur est un atome capable de se lier à plus d’un atome donneur. La liaison polydentate est liée à l’effet chélate, qui stipule que lorsqu’un ligand se lie à de nombreux groupes donneurs (poly), les liaisons covalentes coordonnées sont beaucoup plus fortes ou plus étroitement maintenues. Cette théorie est soutenue par la thermodynamique, en particulier que la liaison polydentée augmente l’entropie d’un système, le rendant plus positif (plus de désordre), ce qui est thermodynamiquement favorable. L’application de cette théorie à la calmoduline permet d’expliquer non seulement l’importance de la liaison polydendate au sein des sites eux-mêmes, mais aussi la nécessité pour la protéine de se lier à 4 ions calcium différents pour activer sa fonction. En nécessitant essentiellement la liaison de quatre ions Ca2+ dans les sites, le système favorise une augmentation de l’entropie en introduisant plus de substrats / réactifs pour former un plus grand nombre de produits. Cela se produit en raison du nombre plus élevé de liaisons au sein des interactions de ligands de chaque site de liaison. Dans l’ensemble, la liaison de l’ion calcium dans les sites du polypeptide est étayée par la théorie de l’effet chélate et éclaire l’efficacité de la calmoduline dans la liaison du calcium.
Les motifs EF-hand ont une certaine structure basée sur le fait que le calcium est le métal central. Cela est également vrai pour les sites de liaison à la calmoduline. L’ion Ca2 + se lie avec des atomes similaires dans les structures de certains acides aminés basés sur une théorie appelée Théorie Acide-Base Dure / Molle. Cette théorie sépare les métaux et les ligands en deux catégories en fonction de la polarisabilité et de leur rapport charge / rayon. Les acides durs et les bases sont des ions plus petits qui ont un rapport charge / taille plus important, ce qui les amène à interagir de manière électrostatique (c’est–à-dire des attractions entre les charges + et -), alors que les acides mous et les bases sont de plus grande taille et ont donc un rapport charge / rayon plus petit, les conduisant à faire des liaisons avec un caractère covalent. L’expression « comme se lie avec comme » fait référence au fait que les acides et les bases durs ont tendance à interagir avec d’autres atomes durs, et il en va de même pour les acides et les bases mous. Le Ca2+ est caractérisé comme un acide dur car, bien qu’il ait un grand rayon, il interagit avec les ligands de manière principalement électrostatique. En regardant le site de liaison au calcium de la calmoduline, on peut voir que l’ion calcium se lie aux atomes d’oxygène des 3 acides aspartiques, de l’acide glutamique, de l’eau et du carbonyle dorsal. Cette liaison est en ligne avec « like se lie avec like » car l’eau et les ligands des acides aminés, l’acide glutamique et l’acide asparatique, se lient à travers des donneurs d’oxygène qui sont caractérisés comme des bases dures. La figure 10 revisite les sites de liaison de la calmoduline tout en montrant les chaînes latérales négatives des acides aminés qui interagiraient avec les ions calcium désignés en bleu.
Concernant les atomes donneurs des ligands liés et leur capacité à donner des paires d’électrons au complexe de coordination, la série spectrochimique explique comment les atomes interagissent avec le métal central. Dans le cas du site de liaison au calcium, les oxygènes qui interagissent avec l’ion Ca2+ sont tous considérés comme donneurs σ et donneurs π car les oxygènes donneurs possèdent 2 paires d’électrons ou plus. Les catégories des séires spectrochimiques qui spécifient la disponibilité et le don d’électrons ont des implications sur la désignation du spin (faible ou élevé), qui désigne la façon dont les électrons d remplissent leurs orbitales, et la taille du delta (Δ) entre les orbitales d du métal, mais cela ne fait pas de différence pour le calcium car les orbitales d du calcium sont inoccupées en raison d’une absence d’électrons de valence d. Cela rend les orbitales d essentiellement négligeables dans la plupart des conversations concernant la protéine. Une exception est liée à la prise en compte de la labilité de l’ion calcium dans le système.
Le manque d’électrons dans les orbitales d de Ca produit une énergie de stabilisation du champ de ligand nulle et explique la grande labilité de l’ion calcium. La labilité fait référence à la vitesse à laquelle les ligands peuvent être remplacés dans les complexes de coordination, et décrit donc la cinétique d’un système. Les atomes sont labiles s’ils échangent rapidement des ligands. En raison de sa fonction pertinente dans toutes les cellules eucaryotes, la calmoduline devrait se lier et libérer des ions calcium des millions de fois par seconde afin d’envoyer et de recevoir des messages des cellules environnantes par le transfert d’ions calcium. En ce qui concerne la capacité de la calmoduline à se lier et à libérer rapidement du Ca2+, il est important de considérer l’occupation des orbitales d’électrons de valence d. Comme indiqué, le calcium possède des orbitales vides de valence d. Ces orbitales inoccupées peuvent donner lieu à une explication de la labilité d’un ion Ca2+. Comme toutes les orbitales d de l’ion calcium sont vides, il possède une énergie de stabilisation du champ de ligand (LFSE) de 0. Cela indique que le calcium est instable lorsqu’on considère le LFSE en raison du fait que les molécules stables ont généralement une valeur négative pour le LFSE. L’instabilité dans ce cas se traduit par une volonté de réagir rapidement et de se déplacer sur et hors des complexes, soutenant l’affirmation selon laquelle les ions Ca2 + encouragent des réactions rapides et peuvent être caractérisés comme labiles. Bien que cela semble contre-intuitif à la discussion impliquant l’effet chélate, il est entendu que ces deux théories ne se contredisent pas. La stabilité des liaisons de coordination étroitement maintenues suggérée par l’effet chélate encourage la calmoduline à rester stable suffisamment longtemps pour lier les protéines de complément. Une fois que cela est terminé et que la concentration de calcium revient à la normale, il est efficace pour éliminer le site des ions calcium.
La calmoduline, de par sa structure et la composition de son site de liaison vital, fait partie intégrante d’innombrables processus effectués par les cellules eucaryotes. Grâce à l’acceptation et à la liaison des ions calcium dans la transduction du signal, la calmoduline agit comme un composant pivot du fonctionnement de base et de haut niveau chez des organismes tels que les humains. En appliquant la théorie bioinorganique et en comprenant l’environnement délicatement surveillé d’une cellule eucaryote, on peut bien comprendre la capacité de la calmoduline à sélectionner les ions calcium et encourager un fonctionnement ultérieur impliquant plus de 100 protéines partenaires.