Traitement à la vitamine E pour les patients atteints de Stéatohépatite Non alcoolique
Jhonathan Ferney Vélez M. (1), Gustavo Amador Crespo H. (1), Juan Carlos Restrepo G. MD. Esp, MSc, PhD. (2)
(1) Étudiant en médecine à la Faculté de médecine de l’Université d’Antioquia à Medellín, en Colombie.
(2) Professeur agrégé au Département de Médecine Interne et au Groupe de Gastrohépatologie de l’Université d’Antioquia et Hépatologue à l’Hôpital Pablo Tobón Uribe de Medellín, Colombie. [email protected]
Reçu: 12-02-14 Accepté: 05-11-14
Résumé
La stéatohépatite non alcoolique (NASH) se caractérise histologiquement par le gonflement des hépatocytes, une inflammation lobulaire et une stéatose. Si ce diagnostic est suspecté, il est important d’exclure d’autres causes de lésions hépatiques, en particulier une consommation excessive d’alcool. Néanmoins, à ce jour, une biopsie est la seule méthode disponible pour confirmer le diagnostic. La vitamine E doit être considérée comme un traitement de première intention pour le traitement de cette maladie car plusieurs études cliniques ont montré qu’une dose de 800 UI / jour améliore l’histologie des adultes non diabétiques souffrant de NASH même lorsqu’il n’y a pas d’impact significatif sur la fibrose. Ces résultats ont été confirmés par des biopsies. Malgré les avantages prouvés de l’utilisation de ce médicament, il est important de savoir que son utilisation ne peut pas remplacer les changements de régime alimentaire et d’exercice, mais doit plutôt être considérée comme un complément à ces mesures.
Mots clés
Stéatohépatite non alcoolique, vitamine E, stress oxydatif.
INTRODUCTION
La NASH est caractérisée histologiquement par un gonflement des hépatocytes, une inflammation lobulaire et une stéatose (1, 2). Actuellement, la NASH ne peut être diagnostiquée que par une biopsie du foie, qui est l’étalon-or diagnostique. Il fournit également des informations sur la présence et le degré d’inflammation, de nécrose et de fibrose qui sont tous importants pour établir le pronostic du patient (2-5). Les différences entre la NASH et la stéatohépatite alcoolique sont microscopiquement petites, ce qui rend difficile la différenciation histologique entre elles. Pour cette raison, il est important d’obtenir des informations du patient sur ses habitudes de consommation d’alcool (4).
La NASH fait partie d’une entité beaucoup plus large appelée NAFLD (stéatose hépatique non alcoolique) qui comprend les premiers stades de la stéatose hépatique: stéatose sans inflammation et stéatose avec inflammation légère. En fin de compte, la NAFLD se développe dans l’état inflammatoire caractéristique de la NASH qui évolue vers la fibrose et enfin la cirrhose (1, 2, 5). Il n’est pas encore tout à fait clair que les individus passent de la simple stéatose à l’état inflammatoire. Les interactions entre la susceptibilité génétique, les troubles métaboliques et le stress oxydatif sont les facteurs les plus importants (6, 7).
La NAFLD est la maladie hépatique la plus répandue dans le monde (2, 4, 6). La prévalence de la NAFLD est estimée entre 20% et 30%, et la prévalence de la NASH serait de 2% à 3% dans la population générale du monde occidental (8).
En raison de ses qualités antioxydantes, la vitamine E a été recommandée dans les directives américaines actuelles pour le traitement de la NASH. « La vitamine E (α-tocophérol) administrée à la dose quotidienne de 800 UI / jour améliore l’histologie hépatique chez les adultes non diabétiques présentant une NASH prouvée par biopsie » Cela n’élimine pas l’importance de l’intervention dans le mode de vie et l’alimentation du patient dans le cadre du traitement de base pour les patients atteints de NASH (9, 10). Dans cet article, nous passons en revue la physiopathologie de la NASH en mettant l’accent sur le rôle de la vitamine E dans le traitement des patients atteints de cette maladie.
PHYSIOPATHOLOGIE
Bien que la pathogenèse de la NASH ne soit pas encore complètement claire, l’hypothèse la mieux acceptée proposée à ce jour pour expliquer les événements menant à la stéatose puis à la stéatohépatite est la théorie des « deux coups ». Le premier coup dans l’apparition de cette maladie est la surcharge graisseuse (11, 12). Un mode de vie sédentaire, des facteurs génétiques et un apport calorique accru rendent les individus plus sensibles au développement d’une résistance à l’insuline et d’une hyperinsulinémie, ce qui entraîne une augmentation de la synthèse des lipides hépatiques et la libération d’acides gras libres du tissu adipeux. Si le foie est maintenu dans cet état, il devient incapable de métaboliser tous les acides gras qu’il produit et qui sont retirés de la circulation. Cette condition conduit finalement au deuxième coup qui est la stéatose hépatique et le stress oxydatif (4, 5, 13).
Le stress oxydatif est un déséquilibre favorisant les pro-oxydants par rapport aux antioxydants (3). Au cours de la stéatose hépatique, les hépatocytes entrent dans un état hypermétabolique qui entraîne une augmentation de la production de radicaux libres dans les organites cellulaires (13). Des quantités croissantes d’espèces réactives de l’oxygène (ROS) dans les hépatocytes conduisent à une peroxydation lipidique qui est une réaction qui fournit un apport continu de radicaux libres supplémentaires avec des effets potentiellement dévastateurs (14, 15).
Un antioxydant est la vitamine E (tocophérol) qui réagit avec les peroxydes lipidiques pour les réduire en acides gras. Ils forment le radical tocophéroxyle relativement stable qui persiste suffisamment longtemps pour revenir au tocophérol par réaction avec la vitamine C à la surface cellulaire (12). En raison de cette caractéristique, la vitamine E a été envisagée comme traitement pour les patients atteints de NASH (13, 16).
MANIFESTATIONS ET DIAGNOSTIC
La NAFLD est un syndrome courant qui va de la stéatose simple à la stéatohépatite (NASH) avec fibrose et cirrhose subséquentes (5). Bien qu’au diagnostic la plupart des patients soient asymptomatiques, certains patients, en particulier les enfants, peuvent se plaindre de fatigue et d’inconfort. L’inconfort dans le quadrant supérieur droit de l’abdomen, la suspicion due à une augmentation des taux d’aminotransférases et une échographie abdominale avec une maladie du foie brillante sont tous des signes de cette maladie. L’obésité, le diabète et la dyslipidémie doivent également être pris en compte lors de l’évaluation des affections pouvant être associées à la NAFLD et à la NASH (5, 17).
Au cours de l’évaluation diagnostique, d’autres causes courantes de maladie du foie doivent être exclues, mais une biopsie du foie est finalement la seule méthode disponible pour confirmer le diagnostic. Il est également important pour définir le pronostic du patient (tableau 1) (3, 4). Malgré sa grande valeur clinique, une biopsie est coûteuse et entraîne une légère augmentation de la morbidité et, en de rares occasions, une mortalité. Cet outil ne doit être envisagé que pour les patients pour lesquels la présence d’une stéatose hépatique non alcoolique est suspectée et qui présentent un risque élevé de stéatohépatite et de fibrose avancée (obésité, diabète sucré de type II, dyslipidémie et syndrome métabolique) et en cas de diagnostic incertain (3, 9).

RÔLE DE LA VITAMINE E DANS LE TRAITEMENT DE LA STÉATOHÉPATITE NON ALCOOLIQUE
Il n’existe actuellement aucun traitement efficace de la NASH. Néanmoins, compte tenu du rôle important de la vitamine E en tant que facteur antioxydant, plusieurs essais cliniques ont été menés afin de démontrer ses avantages dans l’évolution clinique et histopathologique de cette maladie (tableau 2).
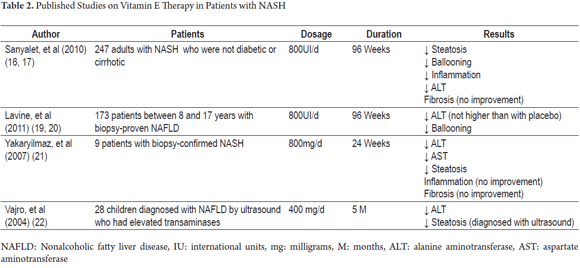
Parmi ceux-ci figure l’essai PIVENS (Pioglitazone versus vitamine E versus placebo pour le traitement des patients non diabétiques atteints de stéatohépatite non alcoolique). Il s’agissait d’une étude multicentrique, en double aveugle, contrôlée contre placebo dans laquelle une amélioration histologique a été évaluée chez 247 patients non diabétiques et non cirrhotiques atteints de NASH. Les patients ont été assignés au hasard pour recevoir une dose quotidienne de pioglitazone (80 patients), de vitamine E (84 patients) ou un placebo (83 patients) pendant quatre-vingt-seize semaines (18). Les doses quotidiennes étaient de 30 mg pour la pioglitazone et de 800 U pour la vitamine E. Cette étude a révélé que 43% des patients ayant reçu de la vitamine E (P = 0,001) s’amélioraient contre 34% de ceux ayant reçu de la pioglitazone (P = 0,04) et 19% de ceux ayant reçu des placebos. La différence dans les taux d’amélioration entre la pioglitazone et les placebos n’était pas statistiquement significative alors que la différence entre les taux d’amélioration de la vitamine E et des placebos l’était. Néanmoins, les deux médicaments ont été associés à une amélioration des taux d’aminotransférase, à une réduction de la stéatose et de l’inflammation lobulaire, mais aucun n’a entraîné d’amélioration de la fibrose. La même étude a montré qu’après un traitement avec de la vitamine E en suspension, les taux d’aminotransférase augmentaient, ce qui indique qu’une administration indéfinie du traitement peut être nécessaire. De plus, aucune différence significative n’a été trouvée entre les effets indésirables de la vitamine E et les effets indésirables des placebos (19).
Une réévaluation de l’essai PIVENS par Hoofnagle et al. axé sur la réponse de l’ALT sérique chez les patients ayant reçu de la vitamine E ou des placebos et sur l’association de cette réponse avec les changements cliniques et histologiques initiaux et les interactions avec les changements de poids corporel. Ils ont constaté que les changements d’ALT étaient plus fréquents chez ceux qui recevaient de la vitamine E (48%) que chez ceux qui recevaient des placebos (16%; p < 0,001). Parmi le groupe recevant de la vitamine E, les réponses aux ALT étaient associées à une diminution de l’activité de la stéatose hépatique non alcoolique (NAFLD), mais il n’y avait aucune amélioration de la fibrose après la fin du traitement à 96 semaines. Les taux d’ALAT ont augmenté dans le groupe vitamine E après la fin de l’administration, mais n’ont pas augmenté dans le groupe placebo après la fin de l’administration. Les deux groupes de traitement présentaient des taux d’ALAT presque identiques à la semaine 120. Ces résultats sont similaires à ceux présentés dans la cohorte complète de la publication principale de l’essai PIVENS. De plus, les résultats ont montré que la perte de poids (2 kg ou plus) est également associée à une réponse aux ALT, avec une amélioration de la NAFLD (< 0,001) et une amélioration de la fibrose (p < 0,02), mais la vitamine E a eu des effets plus importants sur la NAFLD indépendamment des changements de poids corporel. Enfin, il convient de noter que les effets de la vitamine E et de la perte de poids sur la réponse aux ALT et l’histologie sont indépendants, ce qui signifie que même les patients qui perdent du poids bénéficieraient d’un traitement à la vitamine E (20).
L’essai TONIC (Traitement de la stéatose hépatique non alcoolique chez les enfants) était une autre étude multicentrique, en double aveugle, contrôlée par placebo. Il comprenait 173 patients âgés de huit à dix-sept ans. Les patients ont été assignés au hasard pour recevoir de la vitamine E (58 patients), de la metformine (57 patients) ou des placebos (58 patients) pendant 96 semaines. Les doses étaient de 400 UI deux fois par jour pour la vitamine E et de 500 mg deux fois par jour pour la metformine (21). Aucun des deux agents n’était supérieur aux placebos pour obtenir des réductions soutenues d’au moins 50% des taux d’ALAT de base ou des taux d’ALAT soutenus de 40 U/L ou moins. Les mesures ont été prises toutes les 12 semaines de la semaine 48 à la semaine 96. Cette étude a également révélé que la résolution de la NASH était significativement plus élevée dans le groupe de patients traités avec de la vitamine E que dans le groupe placebo. Ce résultat a été attribué à la diminution significative du gonflement hépatocellulaire constaté chez les patients traités par de la vitamine E. Ceci est similaire aux résultats de PIVENS même si l’essai TONIC n’a pas examiné la diminution de la montgolfière hépatocellulaire comme résultat principal en raison des différences histopathologiques entre la NALFD chez les patients pédiatriques et les adultes. L’étude TONIC n’a révélé aucune amélioration de la fibrose (22).
Avant ces deux grandes études, il y avait eu d’autres études plus petites qui avaient des résultats avec des différences majeures dans les résultats primaires évalués. En plus de populations beaucoup plus petites, ces études ont eu moins de temps de surveillance et certaines d’entre elles n’ont pas été contrôlées avec des groupes placebo.
Une étude réalisée en 2007 par Yakaryilmaz et al. a examiné l’effet de la vitamine E sur neuf patients dont le diagnostic de NASH avait été vérifié par biopsie. L’étude a évalué l’effet de la vitamine E sur le récepteur gamma activé par les proliférateurs de peroxysomes (PPARG) et sur la résistance à l’insuline. Les patients ont reçu 800 mg de vitamine E par jour pendant 24 semaines. Avant le début du traitement, les foies des patients ont été évalués biochimiquement et histologiquement. Ces évaluations ont été répétées après la fin du traitement. À la fin des 24 semaines, des diminutions statistiquement significatives de l’AST, de l’ALAT et de la stéatose ont été constatées, mais aucun changement histologique n’a été constaté dans le niveau d’inflammation et de fibrose. Aucun patient n’a présenté d’effets indésirables à cette dose de vitamine E (23).
Vajro, et al. (2004) ont mené une étude sur un groupe de 28 enfants présentant un dysfonctionnement hépatique lié à l’obésité. Les patients ont été divisés en deux groupes. L’âge moyen du premier groupe était de 9,88 ans (+/- 3,97 ans) et celui du deuxième groupe était de 10,7 ans (+/-3,45 ans). Les patients ont été évalués pour déterminer s’il existait des effets bénéfiques du traitement à la vitamine E sur la perte de poids, les taux de transaminases et la stéatose mesurés par échographie. Les enfants inclus dans cette étude présentaient tous une hypertransaminasémie chronique (taux d’AST ou d’ALAT 1,5 fois supérieurs à la valeur normale pendant plus de 6 mois) et des signes de stéatose à l’échographie. L’étude avait un plan en une seule aveugle dans lequel les patients étaient randomisés dans l’un des deux groupes: le groupe 1 (placebo plus régime alimentaire) et le groupe 2 (vitamine E + régime alimentaire). Plus tard, chaque groupe a été subdivisé en fonction de l’observance du traitement par le patient. Le groupe 1 était divisé en Sous-groupe 1A pour ceux qui se conformaient à la diète et Sous-Groupe 1B pour ceux qui ne s’y conformaient pas. Le groupe 2 a été divisé en sous-groupe 2A pour ceux qui avaient suivi un traitement à la vitamine E et Sous-groupe 2B pour ceux qui n’avaient pas suivi un traitement à la vitamine E. Le sous-groupe 2A a été divisé en sous-groupe 2A1 pour ceux qui ne se conformaient pas au régime et Sous-groupe 2A2 pour ceux qui se conformaient au régime. L’étude a révélé que la dose de 400 mg / jour de vitamine E produisait une diminution significative des valeurs d’ALAT chez les patients du sous-groupe 2A qui approchaient de la normalisation indépendamment de tout changement de poids. D’autre part, les patients qui ont atteint des taux sériques élevés de vitamine E et qui ont également perdu du poids ont atteint une normalisation des ALT et une rémission de la stéatose. En outre, une comparaison entre le Sous-groupe 1A ne respectant que le régime alimentaire et le Sous-groupe 2A1 ne respectant que le traitement à la vitamine E a révélé que les taux d’ALAT des deux groupes de patients avaient diminué à deux mois de surveillance, mais qu’il y avait une diminution plus importante du Sous-Groupe 1A (ne respectant que le régime alimentaire) que du Sous-Groupe 2A1 (ne respectant que la vitamine E) à cinq mois de surveillance. Tous les signes de stéatose ont disparu des images échographiques dans le groupe du sous-groupe 2A2 qui a perdu du poids pendant le traitement avec 400 mg de vitamine E. Ces résultats soulignent l’importance de promouvoir une alimentation saine comme l’une des interventions thérapeutiques majeures pour les patients atteints de NASH, mais il faut également noter que de nombreux patients ne respectent pas les régimes alimentaires conduisant à l’échec de l’intervention. Cela souligne l’importance d’utiliser des antioxydants tels que la vitamine E comme une bonne thérapie alternative pour ces patients (24).
Une étude pilote de Kugelmas, et al. (2003) ont évalué les effets de l’étape 1 du régime alimentaire de l’American Heart Association combiné à une augmentation de l’exercice aérobie avec et sans administration quotidienne de vitamine E sur les profils de cytokines (TNF alpha, IL-8, IL-6) et les niveaux d’enzymes hépatiques chez 16 patients âgés de 18 à 65 ans présentant une NASH prouvée par biopsie. Il s’agissait d’une étude en simple aveugle dans laquelle les patients ont été assignés au hasard à recevoir 800 UI de vitamine E par jour. Les patients qui n’ont pas reçu de vitamine E ont reçu des placebos. Le test a été effectué sur une période de 12 semaines. Les valeurs de cytokines n’ont pas diminué de manière significative avec la perte de poids avec ou sans administration de vitamine E au cours de l’étude. Les changements de mode de vie ont été associés à des améliorations des enzymes hépatiques et du cholestérol plasmatique chez les patients atteints de NASH, tandis que la dose de vitamine E utilisée dans cette étude n’a montré aucun avantage supplémentaire. Ce résultat peut être dû à la petite taille de l’échantillon, au temps de suivi court ou à la dose de vitamine E utilisée (25, 26).
Une revue publiée en novembre 2013 sur les options actuellement disponibles pour le traitement des patients atteints de NASH a reconnu la recommandation actuelle d’utiliser la vitamine E comme traitement de première intention chez les patients atteints de NASH confirmés par biopsie qui ne sont pas cirrhotiques et qui ne souffrent pas de diabète, mais a également souligné le fait que ce traitement n’a montré un bénéfice significatif que chez moins de la moitié des patients. Pour cette raison, l’examen a conclu que les stratégies de traitement futures devraient être basées sur les voies pathogènes de la maladie si un traitement efficace pour les patients atteints de NASH devait être mis au point (27).
Ji H-F et al. a effectué une méta-analyse pour évaluer l’effet de la vitamine E sur la diminution des aminotransférases chez les patients atteints de NAFLD, de NASH et d’hépatite C chronique (CHC). Les quatre études qu’ils ont examinées comprenaient des patients atteints de NASH qui ont reçu des suppléments de vitamine E. Les études comprenaient les essais TONIC et PIVENS. Ils ont constaté que la vitamine E pouvait optimiser les niveaux d’AST et d’ALT chez ces patients. Cependant, il convient de noter que cette méta-analyse a été limitée par une incapacité à exclure l’incapacité à exclure les effets d’interventions impliquant des changements de mode de vie, de l’exercice et de l’utilisation d’autres antioxydants et une incapacité à exclure les effets d’autres facteurs de risque de maladie hépatique chronique tels que la consommation d’alcool et de drogues. À cela s’ajoute l’hétérogénéité des études qui doit être prise en compte car elle limite l’analyse globale ainsi qu’une moindre spécificité pour les taux d’aminotransférases que les biopsies prises au moment du diagnostic et de l’évaluation de la maladie hépatique (28).
Bien que parmi les principales études visant à évaluer l’effet de l’utilisation de la vitamine E chez les patients atteints de NASH, nous n’ayons pas trouvé de différences statistiquement significatives avec l’utilisation de placebos et d’autres options thérapeutiques à court terme, on s’inquiète des effets indésirables possibles d’une utilisation prolongée de la vitamine E.
Une revue systématique de neuf essais randomisés comprenait de nouveaux essais randomisés contrôlés par placebo afin d’évaluer les effets de la vitamine E pendant une période d’au moins un an sur l’incidence globale des accidents vasculaires cérébraux ainsi que des sous-types d’accidents vasculaires cérébraux. Il a constaté un risque accru d’AVC hémorragique (RR = 1,22, IC à 95%: 1,0 à 1,48, p = 0,045). En raison des résultats obtenus de leur examen, les chercheurs recommandent d’éviter l’utilisation aveugle de la vitamine E en raison des conséquences graves des accidents vasculaires cérébraux hémorragiques sur la morbidité et la mortalité (29).
Une étude randomisée contrôlée par placebo qui a inclus 35 533 patients suivis pendant au moins sept ans a étudié les risques de la vitamine E liés au cancer de la prostate. Il a comparé un groupe placebo à un groupe recevant de la vitamine E à une dose quotidienne de 400 UI. Il y avait une augmentation significative du risque de cancer de la prostate chez ceux qui prenaient de la vitamine E (HR 1,17; IC à 99%, 1,004-1,360; p = 0,008). L’augmentation absolue du risque était de 1,6 pour 1 000 années-personnes (30).
Une autre méta-analyse a examiné la relation dose-réponse entre la supplémentation en vitamine E et la mortalité totale chez les adultes. Il a montré que les patients recevant des doses élevées de vitamine E (supérieures ou égales à 400 UI / jour) présentaient une mortalité accrue toutes causes confondues. Cette méta-analyse a limité sa recherche à des essais contrôlés randomisés dont les échantillons de patients étaient constitués d’adultes traités par de la vitamine E seule ou en association avec d’autres vitamines ou minéraux et qui excluaient les femmes enceintes et qui avaient un minimum de 1 an de traitement et de suivi. Les résultats fournis par cette méta-analyse doivent être considérés avec prudence car plusieurs des études ont des échantillons de petite taille et ont été réalisées chez des patients atteints de plusieurs maladies chroniques. Cela limite la capacité de l’étude à généraliser les résultats à la population adulte en bonne santé (31).
CONCLUSION
Bien qu’il n’existe actuellement aucun traitement médicamenteux efficace pour les patients atteints de NASH, les données de l’étude PIVENS suggèrent qu’une administration appropriée de vitamine E améliore l’histologie hépatique chez les patients adultes non cirrhotiques atteints de NASH qui ne sont pas diabétiques. Néanmoins, d’autres études sont nécessaires avant que cette recommandation puisse être étendue aux patients diabétiques ou aux patients atteints de cirrhose avec NASH. Les études menées sur des patients pédiatriques atteints de NASH n’ont pas trouvé de preuves suffisantes pour soutenir l’utilisation de la vitamine E. En plus de l’administration de vitamine E, il a été démontré que la perte de poids réduit la stéatose et l’inflammation du foie. La perte de poids par un régime hypocalorique combiné à une activité physique accrue devrait être recommandée pour tous les patients. En ce qui concerne les effets secondaires, nous n’avons pas trouvé de différences statistiquement significatives dans l’utilisation à court terme de vitamine E avec des placebos et d’autres options de traitement. Pourtant, l’utilisation aveugle de vitamine E n’est pas recommandée pendant de longues périodes car il existe des preuves suggérant des risques accrus de cancer de la prostate, d’accident vasculaire cérébral hémorragique et de décès de toutes les causes.
1. Abbas AK, Fausto N. Hígado, vesícula biliar y vías biliares. En: Robbins SL, Mitchell RN, Kumar V, Abbas AK, Fausto N. Patología funcional y estructural. 8va Ed. Barcelone: Elsevier; 2012. p. 645 à 687.
2. Brunt E, Neuschwander-Tetri B, Burt AD. Stéatose hépatique: alcoolique et non alcoolique. Fr: Burt AD, Ferrell, L Portmann BC. Pathologie du foie de MacSween. 6ème édition. Royaume-Uni: Elservier; 2012. p. 293 à 359.
3. Corrado RL, Torres DM, Harrison SA. Examen des options de traitement de la stéatose hépatique non alcoolique. Med Clin N Am 2014; 98:55-72.
4. Koek GH, Liedorp PR, Bast A. Le rôle du stress oxydatif dans la stéatohépatite non alcoolique. Clinica Chimica Acta 2011; 412: 1297-1305.
5. Cortez-Pinto H, Ermelinda Camilo M. Stéatose hépatique non alcoolique / stéatohépatite non alcoolique (NAFLD / NASH): diagnostic et évolution clinique. Best Practice & Research Clinical Gastroenterology 2004; 18 (6): 1089-104.
6. Mishra A, Younossi ZM. Épidémiologie et Histoire naturelle de la stéatose hépatique Non alcoolique. Journal of Clinical and Experimental Hepatology 2012; 2 (2): 135-44.
7. Rolo AP, Teodoro JS, Palmeira CM. Rôle du stress oxydatif dans la pathogenèse de la stéatohépatite non alcoolique. Radic Libre Biol Med 2012; 52 (1): 59-69.
8. Machado MV, Cortez-Pinto H. Diagnostic non invasif de la stéatose hépatique non alcoolique. Une évaluation critique. Journal d’hépatologie 2013; 58 (5): 1007-19.
9. Chalasani N, et coll. Le diagnostic et la prise en charge de la stéatose hépatique Non alcoolique: Guide de pratique de l’American Association for the Study of Liver Diseases, de l’American College of Gastroenterology et de l’American Gastroenterological Association. Hépatologie 2012; 55.
10. Mazzella N, Ricciardi LR, Mazzotti A, Marchesini G. Le rôle des médicaments pour la prise en charge des patients atteints de NAFLD. Clin Liver Dis 2014; 18:73-89.
11. Chunga MON, Yeunga SF, Parka HJ, Volekb JS, Brunoa RS. La supplémentation alimentaire en α- et γ-tocophérol atténue le stress oxydatif induit par les lipopolysaccharides et les réponses liées à l’inflammation dans un modèle de souris obèse de stéatohépatite non alcoolique. Journal de biochimie nutritionnelle 2010; 21: 1200-1206.
12. Jour CP, James DE. Stéatohépatite: Une histoire de deux « succès »? Gastroentérologie 1998; 114: 842-4.
13. Harper HA, Murray RK, Rodwell VW, Bender DA. Bioquímica ilustrada, 28 éd. Mexique: McGraw-Hill Interamericana; 2010. p. 484-485.
14. Neuschwander – Tetri BA. Lipotoxicité hépatique et pathogenèse de la stéatohépatite non alcoolique: le rôle central des métabolites d’acides gras non triglycérides. Hépatologie 2010; 52 (2): 774-88.
15. Le T, Loomba R. Prise en charge de la stéatose hépatique Non alcoolique et de la stéatohépatite. Journal of Clinical and Experimental Hepatology 2012; 2:156-173.
16. Verdam FJ, Dallinga JW, Driessen, de Jonge C, Moonen E, van Berkel J, Luijk J, Bouvy ND, Buurman AW, Rensen SS, Greve JW. Stéatohépatite non alcoolique: Un diagnostic non invasif par analyse de l’haleine expirée. Journal d’hépatologie 2013; 58: 543-548.
17. Palmentieri B, de Sio I, La Mura V, et al. Le rôle du motif d’écho hépatique brillant sur l’examen échographique B-mod dans le diagnostic de la stéatose hépatique. Dig Liver Dis 2006; 38:485-9.
18. Sanyal AJ, et coll. Pioglitazone versus vitamine E versus placebo pour le traitement des patients non diabétiques atteints de stéatohépatite non alcoolique: Conception de l’essai PIVENS. Contemp Clin Trials 2009; 30 (1): 88-96.
19. Sanyal AJ, Chalasani N, Kowdley KV, McCullough A, Diehl AM, Bass NM, et al. Pioglitazone, vitamine E ou placebo pour la stéatohépatite non alcoolique. N Engl J Med 2010; 362 (18): 1675-85.
20. Les résultats de l’étude sont les suivants : Vitamine E et modifications des taux sériques d’alanine aminotransférase chez les patients atteints de stéatohépatite non alcoolique. Alimentation Pharmacol Ther 2013; 38 (2): 134-43.
21. Lavine JE, Schwimmer JB, Molleston JP, Scheimann AO, Murray KF, Abrams SH, et al. Traitement de la stéatose hépatique non alcoolique chez les enfants: Conception d’essai TONIQUE. Contemp Clin Trials 2010; 31 (1): 62-70.
22. Lavine JE, Schwimmer JB, Van Natta ML, et coll. Effet de la vitamine e ou de la metformine pour le traitement de la stéatose hépatique non alcoolique chez les enfants et les adolescents: L’essai contrôlé randomisé tonic. JAMA 2011; 305 (16): 1659-68.
23. Yakaryilmaz F, Guliter S, Savas B, Erdem O, Ersoy R, Erden E, et al. Effets du traitement à la vitamine E sur l’expression alpha des récepteurs activés par les proliférateurs de peroxysomes et la résistance à l’insuline chez les patients atteints de stéatohépatite non alcoolique: résultats d’une étude pilote. Intern Med J 2007; 37(4): 229-35.
24. Vajro P, Mandato C, Franzese A, Ciccimarra E, Lucariello S, Savoia M, et al. Traitement à la vitamine E dans les maladies du foie liées à l’obésité pédiatrique: une étude randomisée. J Pediatr Gastroentérol Nutr 2004; 38(1): 48-55
25. Papastergiou V, et coll. Neuf modèles de notation pour la mortalité à court terme dans l’hépatite alcoolique: validation croisée dans une cohorte prouvée par biopsie. Alimentation Pharmacol Ther 2014; 39: 721-732.
26. Kugelmas M, Hill DB, Vivian B, Marsano L, McClain CJ. Cytokines et NASH: Une étude pilote des effets de la modification du mode de vie et de la vitamine E. Hépatologie 2003; 38 (2): 413-9.
27. Younossi ZM, Reyes MJ, Mishra MA, Mehta R, Henry L. Revue systématique avec méta-analyse: stéatohépatite non alcoolique – un cas de traitement personnalisé basé sur des cibles pathogènes. Aliment Pharmacol Ther2014; 39:3-14.
28. Ji HF, et coll. Effet de la supplémentation en vitamine E sur les niveaux d’aminotransférase chez les patients atteints de NAFLD, de NASH et de CHC: Résultats d’une méta-analyse. Nutrition 2014; 1-6.
29. Markus S, Robert JG, Pamela MR, Christophe T, Tobias K. Effets de la vitamine E sur les sous-types d’AVC: méta-analyse d’essais contrôlés randomisés. JMB 2010; 341.
30. Klein EA, Thompson IM, Tangen CM, et al. La vitamine e et le risque de cancer de la prostate: L’essai de prévention du cancer au sélénium et à la vitamine e (select). JAMA 2011; 306(14): 1549-56.
31. Miller ER, 3e, Pastor-Barriuso R, Dalal D, Riemersma RA, Appel LJ, Guallar E. Méta-analyse: une supplémentation en vitamine E à forte dose peut augmenter la mortalité toutes causes confondues. Ann Intern Med 2005; 142(1): 37-46.