Ionos elektrolitok
a víz és más poláris molekulák vonzódnak az ionokhoz, amint azt a \(\pageindex{2}\) ábra mutatja. Az ion és a dipólusú molekula közötti elektrosztatikus vonzást ion-dipólus vonzásnak nevezzük. Ezek a látnivalók fontos szerepet játszanak az ionos vegyületek vízben való oldódásában.
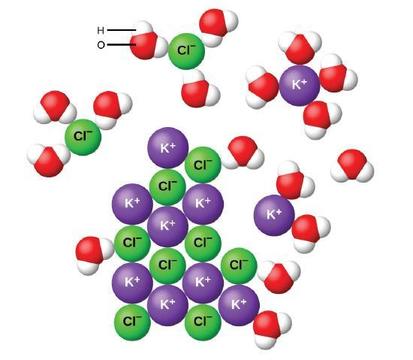
amikor az ionos vegyületek vízben oldódnak, a szilárd anyagban lévő ionok elválnak és egyenletesen eloszlanak az oldatban, mivel a vízmolekulák körülveszik és szolvatálják az ionokat, csökkentve a köztük lévő erős elektrosztatikus erőket. Ez a folyamat fizikai változást jelent, amelyet disszociációnak neveznek. A legtöbb esetben az ionos vegyületek feloldódásukkor szinte teljesen disszociálnak, ezért erős elektrolitok közé sorolják őket.
nézzük meg, mi történik mikroszkopikus szinten, amikor szilárd KCl-t adunk a vízhez. Az Ion-dipól erők vonzzák a poláris vízmolekulák pozitív (hidrogén) végét a szilárd anyag felszínén lévő negatív kloridionokhoz,a negatív (oxigén) végeket pedig a pozitív káliumionokhoz. A vízmolekulák behatolnak az egyes K+ és Cl− ionok közé, és körülveszik őket, csökkentve az erős interionikus erőket, amelyek összekötik az ionokat, és lehetővé teszik, hogy oldatba kerüljenek, mint szolvatált ionok, amint azt az ábra mutatja. Az elektrosztatikus vonzás csökkentése lehetővé teszi az egyes hidratált ionok önálló mozgását egy híg oldatban, ami a rendszer zavarának növekedését eredményezi, amikor az ionok a kristályban rögzített és rendezett helyzetükből az oldatban mozgó és sokkal rendezetlenebb állapotokká válnak. Ez a megnövekedett rendellenesség felelős számos ionos vegyület, köztük a KCl feloldódásáért,amelyek a hő felszívódásával oldódnak.
más esetekben a kristályban lévő ionok közötti elektrosztatikus vonzerők olyan nagyok, vagy az ionok és a vízmolekulák közötti ion-dipólus vonzó erők olyan gyengék, hogy a rendellenesség növekedése nem képes kompenzálni az ionok elválasztásához szükséges energiát, és a kristály oldhatatlan. Ilyen például a kalcium-karbonát (mészkő), a kalcium-foszfát (a csont szervetlen összetevője) és a vas-oxid (rozsda).