az oldatban nem katalizált reakciók lassúak, mivel a töltés kialakulása és az elválasztás átmeneti állapotban történik. Kötések létrehozásakor vagy megszakadásakor gyakran olyan töltött köztitermékek képződnek, amelyek energiája nagyobb, mint a reagenseké. Mivel az intermedier magasabb energiájú, mint a reagensek, az átmeneti állapot még magasabb energiájú lenne, ezért jobban hasonlít a töltött intermedierre. Bármi, ami stabilizálni tudja a köztitermék töltéseit, és ezáltal az átmeneti állapotokban kialakuló töltéseket, csökkenti az átmeneti állapot energiáját, és katalizálja a reakciót. Ebben a részben megvizsgáljuk a kémiai reakciók kis molekuláival történő katalízis alapjául szolgáló mechanizmust. Feltehetően a biológiai makromolekuláris katalizátor (például a fehérje enzimek) hasonló mechanizmusokat fog használni katalitikus hatásaikban (amelyeket a következő szakaszban tárgyalunk).
a katalizátorok, beleértve az enzimeket is, legalább 5 különböző módszert alkalmazhatnak az átmeneti állapotok stabilizálására.
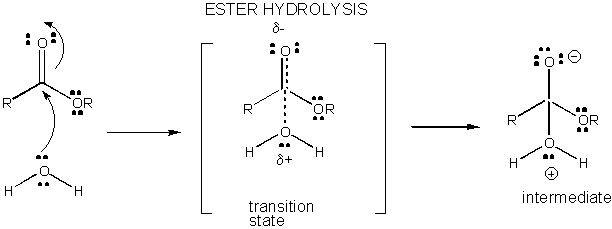
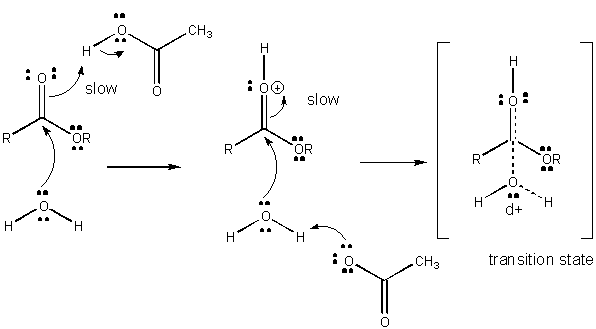
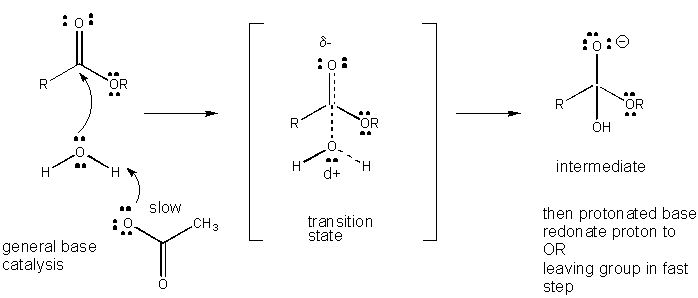
a TÖLTÉSFEJLŐDÉS a TS-ben csökkenthető az Általános savakból (például ecetsavból vagy protonált indolgyűrűből) származó proton adományozásával egy olyan atomhoz, mint a karbonil o amely részleges negatív töltést alakít ki a TS-ben, amikor azt nukleofil köti össze. A protonadományozás csökkenti a fejlődő negatív értéket a TS-ben. Alternatív megoldásként egy nukleofil, például víz, amely részleges pozitív töltést fejleszt ki a TS-ben, amikor kötést kezd kialakítani egy karbonilban lévő elektrofil C-vel, általános bázis (például acetát vagy a protonált indolgyűrű) jelenlétével stabilizálható. A Proton absztrakció csökkenti a fejlődő pozitív töltést
ábra: TÖLTÉSFEJLŐDÉS az észter hidrolízis átmeneti állapotában
ábra: az Általános SAVKATALÍZIS mechanizmusa
ábra: az Általános BÁZISKATALÍZIS mechanizmusa
közreműködők és nevezések
- Prof. Henry Jakubowski (Szent Benedek Főiskola / Szent János Egyetem)